P53 - P53
Опухолевый белок Р53, также известный как p53, сотовый опухолевый антиген p53 (UniProt имя), Хранитель генома,[5] фосфопротеин p53, опухолевый супрессор p53, антиген NY-CO-13, или же связанный с трансформацией белок 53 (TRP53), любой изоформа белка, кодируемого гомологичным гены у различных организмов, таких как TP53 (люди) и Trp53 (мышей). Этот гомолог (первоначально предполагаемый и часто упоминаемый как единственный белок) имеет решающее значение для многоклеточный позвоночные, где это мешает рак формирование, и, таким образом, функционирует как подавитель опухолей.[6] Таким образом, p53 был описан как «хранитель геном "из-за его роли в сохранении стабильности путем предотвращения мутации генома.[7] Следовательно TP53[примечание 1] классифицируется как ген-супрессор опухоли.[8][9][10][11][12]
Название p53 был дан в 1979 году с описанием очевидного молекулярная масса; SDS-СТРАНИЦА Анализ показывает, что это 53-килодальтон (кДа) белок. Однако фактическая масса полноразмерного белка p53 (p53α), основанная на сумме масс белка аминокислота остатков составляет всего 43,7 кДа. Это различие связано с большим количеством пролин остатки в белке, которые замедляют его миграцию на SDS-PAGE, что делает его более тяжелым, чем есть на самом деле.[13] Помимо полноразмерного белка, человеческий TP53 Ген кодирует по меньшей мере 15 изоформ белков размером от 3,5 до 43,7 кДа. Все эти белки p53 называют изоформы p53.[6] Ген TP53 является наиболее часто мутируемым геном (> 50%) при раке человека, что указывает на то, что TP53 ген играет решающую роль в предотвращении образования рака.[6] TP53 Ген кодирует белки, которые связываются с ДНК и регулируют экспрессию генов, чтобы предотвратить мутации генома.[14]
Ген
У людей TP53 ген расположен на коротком плече хромосома 17 (17p13.1).[8][9][10][11] Ген охватывает 20 т.п.н. с некодирующим экзоном 1 и очень длинным первым интроном размером 10 т.п.н. Кодирующая последовательность содержит пять областей, демонстрирующих высокую степень консервативности у позвоночных, преимущественно в экзонах 2, 5, 6, 7 и 8, но последовательности, обнаруженные у беспозвоночных, обнаруживают лишь отдаленное сходство с TP53 млекопитающих.[15] TP53 ортологи[16] были выявлены в большинстве млекопитающие для которого доступны полные данные о геноме.
У людей обычная полиморфизм предполагает замену аргинин для пролин в кодон Позиция 72. Во многих исследованиях изучалась генетическая связь между этой изменчивостью и восприимчивостью к раку; однако результаты были противоречивыми. Например, метаанализ 2009 года не смог показать связь с раком шейки матки.[17] Исследование 2011 года показало, что TP53 Мутация пролина действительно оказала сильное влияние на риск рака поджелудочной железы у мужчин.[18] Исследование арабских женщин показало, что гомозиготность пролина у TP53 кодон 72 связан со сниженным риском рака груди.[19] Одно исследование показало, что TP53 полиморфизмы кодона 72, MDM2 SNP309, и A2164G в совокупности могут быть связаны с восприимчивостью к неорофарингеальному раку и что MDM2 SNP309 в сочетании с TP53 кодон 72 может ускорить развитие неорофарингеального рака у женщин.[20] Исследование 2011 года показало, что TP53 Полиморфизм кодона 72 был связан с повышенным риском рака легких.[21]
Мета-анализ 2011 года не выявил значимых связей между TP53 полиморфизм кодона 72 и риск колоректального рака[22] и риск рака эндометрия.[23] Исследование 2011 года бразильской когорты новорожденных обнаружило связь между немутантным аргинином. TP53 и люди без семейной истории рака.[24] Другое исследование 2011 года показало, что гомозиготный (Pro / Pro) генотип p53 был связан со значительно повышенным риском почечно-клеточного рака.[25]
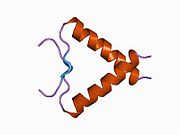
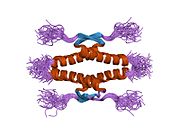
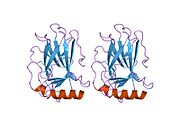
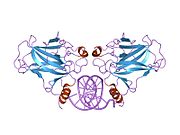
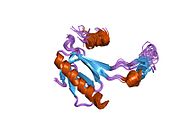
Структура


- кислый N-конец домен активации транскрипции (TAD), также известный как домен активации 1 (AD1), который активирует факторы транскрипции. N-конец содержит два комплементарных домена активации транскрипции, главный из которых находится на остатках 1–42, а второстепенный - на остатках 55–75, специфически участвующих в регуляции нескольких проапоптотических генов.[26]
- домен активации 2 (AD2) важен для апоптотический активность: остатки 43–63.
- пролин богатый домен, важный для апоптотической активности р53 путем экспорта из ядра через MAPK: остатки 64–92.
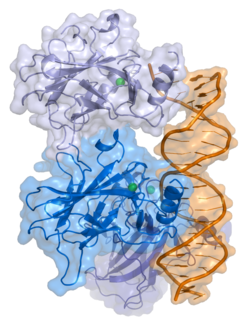
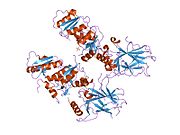
- центральный ДНК -вязывание основного домена (DBD ). Содержит один атом цинка и несколько аргинин аминокислоты: остатки 102–292. Эта область отвечает за связывание с репрессором р53. LMO3.[27]
- Сигнализация ядерной локализации (NLS), остатки 316–325.
- домен гомоолигомеризации (OD): остатки 307–355. Тетрамеризация необходима для активности p53. in vivo.
- C-терминал участвует в подавлении связывания ДНК центрального домена: остатки 356–393.[28]
Мутации, которые деактивируют p53 при раке, обычно происходят в DBD. Большинство этих мутаций нарушают способность белка связываться с его последовательностями ДНК-мишени и, таким образом, предотвращают активацию транскрипции этих генов. Таким образом, мутации в DBD рецессивный Потеря функции мутации. Молекулы p53 с мутациями в димеризе OD с дикого типа p53 и не дают им активировать транскрипцию. Следовательно, мутации OD оказывают доминирующее негативное влияние на функцию p53.
P53 дикого типа представляет собой лабильный белок, состоящий из сложенного и неструктурированные регионы которые действуют синергетически.[29]
Функция
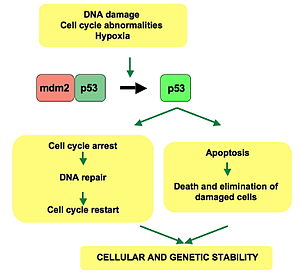
Повреждение и восстановление ДНК
р53 играет роль в регуляции или прохождении клеточного цикла, апоптоз, и геномная стабильность с помощью нескольких механизмов:
- Он может активировать Ремонт ДНК белки, когда ДНК подверглась повреждению. Таким образом, это может быть важным фактором в старение.[30]
- Он может остановить рост, удерживая клеточный цикл на Точка регулирования G1 / S при распознавании повреждений ДНК - если он удерживает клетку здесь достаточно долго, белки репарации ДНК успеют исправить повреждение, и клетке будет позволено продолжить клеточный цикл.
- Он может инициировать апоптоз (т.е. запрограммированная гибель клеток ), если повреждение ДНК окажется непоправимым.
- Это важно для старение ответ на короткий теломеры.
Кодировка WAF1 / CIP1 для стр.21 и сотни других последующих генов. p21 (WAF1) связывается с G1 -S /CDK (CDK4 /CDK6, CDK2, и CDK1 ) комплексы (молекулы, важные для Переход G1 / S в клеточном цикле), подавляя их активность.
Когда p21 (WAF1) образует комплекс с CDK2, клетка не может перейти к следующей стадии клеточного деления. Мутантный p53 больше не будет связывать ДНК эффективным образом, и, как следствие, белок p21 не сможет действовать как «стоп-сигнал» для деления клетки.[31] Исследования эмбриональных стволовых клеток человека (hESCs) обычно описывают нефункциональную ось p53-p21 пути контрольной точки G1 / S с последующим значением для регуляции клеточного цикла и ответа на повреждение ДНК (DDR). Важно отметить, что мРНК p21 явно присутствует и активируется после DDR в hESC, но белок p21 не обнаруживается. В этом типе клеток p53 активирует многочисленные микроРНК (например, miR-302a, miR-302b, miR-302c и miR-302d), которые непосредственно ингибируют экспрессию p21 в hESC.
Белок p21 связывается непосредственно с комплексами циклин-CDK, которые продвигают клеточный цикл и ингибируют их киназную активность, тем самым вызывая остановку клеточного цикла, позволяющую произойти репарации. p21 может также опосредовать остановку роста, связанную с дифференцировкой, и более постоянную остановку роста, связанную с клеточным старением. Ген p21 содержит несколько ответных элементов p53, которые опосредуют прямое связывание белка p53, что приводит к активации транскрипции гена, кодирующего белок p21.
P53 и RB1 пути связаны через p14ARF, что повышает вероятность того, что эти пути могут регулировать друг друга.[32]
Экспрессия p53 может стимулироваться УФ-светом, который также вызывает повреждение ДНК. В этом случае p53 может инициировать события, приводящие к дубление.[33][34]
Стволовые клетки
Уровни p53 играют важную роль в поддержании стволовых клеток на протяжении всего развития и всей остальной жизни человека.
В человеческом эмбриональные стволовые клетки (hESCs) s, p53 поддерживается на низком неактивном уровне.[35] Это связано с тем, что активация р53 приводит к быстрой дифференцировке чЭСК.[36] Исследования показали, что отключение p53 задерживает дифференцировку и что добавление p53 вызывает спонтанную дифференцировку, показывая, как p53 способствует дифференцировке чЭСК и играет ключевую роль в клеточном цикле в качестве регулятора дифференцировки. Когда p53 стабилизируется и активируется в hESCs, он увеличивает p21, чтобы установить более длинный G1. Обычно это приводит к отмене входа в S-фазу, что останавливает клеточный цикл в G1, что приводит к дифференцировке. Однако работа с эмбриональными стволовыми клетками мыши недавно показала, что экспрессия P53 не обязательно приводит к дифференцировке.[37] p53 также активирует miR-34a и miR-145, которые затем репрессируют факторы плюрипотентности hESCs, далее провоцируя дифференцировку.[35]
Во взрослых стволовых клетках регуляция p53 важна для поддержания стволовости в ниши взрослых стволовых клеток. Механические сигналы, такие как гипоксия влияют на уровни p53 в этих клетках ниши через факторы, индуцируемые гипоксией, HIF-1α и HIF-2α. В то время как HIF-1α стабилизирует p53, HIF-2α подавляет его.[38] Подавление p53 играет важную роль в фенотипе раковых стволовых клеток, индуцированных плюрипотентных стволовых клетках и других ролях и поведении стволовых клеток, таких как образование бластемы. Было показано, что клетки со сниженным уровнем p53 репрограммируются в стволовые клетки с гораздо большей эффективностью, чем нормальные клетки.[39][40] Статьи предполагают, что отсутствие остановки клеточного цикла и апоптоза дает возможность перепрограммировать большему количеству клеток. Было также показано, что снижение уровня p53 является важным аспектом бластема образование в ногах саламандр.[41] Регуляция p53 очень важна, поскольку действует как барьер между стволовыми клетками и состоянием дифференцированных стволовых клеток, а также как барьер между функциональными и злокачественными стволовыми клетками.[42]
Другой
Помимо клеточных и молекулярных эффектов, описанных выше, p53 оказывает противоопухолевое действие на тканевом уровне, которое действует путем ингибирования ангиогенез. По мере роста опухоли им необходимо привлекать новые кровеносные сосуды для снабжения их кровью, а p53 ингибирует это, (i) вмешиваясь в регуляторы опухолевая гипоксия которые также влияют на ангиогенез, такие как HIF1 и HIF2, (ii) ингибируют продукцию факторов, способствующих ангиогенезу, и (iii) напрямую увеличивают продукцию ингибиторов ангиогенеза, таких как арестовать.[43][44]
p53 путем регулирования Фактор ингибирования лейкемии было показано, что облегчает имплантация в размножении мышей и, возможно, людей.[45]
Регулирование
p53 активируется в ответ на множество стрессоров, включая, помимо прочего, Повреждение ДНК (индуцированный либо УФ, ИК или химические агенты, такие как перекись водорода), окислительный стресс,[46] осмотический шок истощение рибонуклеотидов и нарушение регуляции экспрессии онкогенов. Эта активация отмечена двумя важными событиями. Во-первых, период полужизни белка p53 резко увеличивается, что приводит к быстрому накоплению p53 в стрессированных клетках. Во-вторых, конформационное изменение заставляет p53 активироваться как регулятор транскрипции в этих камерах. Критическим событием, приводящим к активации p53, является фосфорилирование его N-концевого домена. N-концевой домен активации транскрипции содержит большое количество сайтов фосфорилирования и может рассматриваться как основная мишень для протеинкиназ, передающих сигналы стресса.
В протеинкиназы которые, как известно, нацелены на этот домен активации транскрипции р53, можно грубо разделить на две группы. Первая группа протеинкиназ принадлежит к MAPK семейство (JNK1-3, ERK1-2, p38 MAPK), которое, как известно, реагирует на несколько типов стресса, таких как повреждение мембраны, окислительный стресс, осмотический шок, тепловой шок и т. д. Вторая группа протеинкиназ (ATR, Банкомат, CHK1 и CHK2, ДНК-ПК, CAK, TP53RK ) вовлечен в контрольную точку целостности генома, молекулярный каскад, который обнаруживает и реагирует на несколько форм повреждения ДНК, вызванных генотоксическим стрессом. Онкогены также стимулируют активацию p53, опосредованную белком. p14ARF.
В нестрессированных клетках уровни p53 поддерживаются на низком уровне за счет непрерывной деградации p53. Белок под названием Mdm2 (также называемый HDM2 у людей), связывается с p53, предотвращая его действие и транспортирует его из ядро к цитозоль. Mdm2 также действует как убиквитинлигаза и ковалентно прикрепляет убиквитин к p53 и, таким образом, маркирует p53 для деградации протеасома. Однако убиквитилирование p53 обратимо. При активации p53 также активируется Mdm2, создавая Обратная связь. уровни p53 могут показать колебания (или повторяющиеся импульсы) в ответ на определенные стрессы, и эти импульсы могут быть важны для определения того, выдерживают ли клетки стресс или умирают.[47]
MI-63 связывается с MDM2, реактивируя p53 в ситуациях, когда функция p53 ингибируется.[48]
Убиквитинспецифическая протеаза, USP7 (или же HAUSP ), может отщеплять убиквитин от р53, тем самым защищая его от протеасомозависимой деградации через путь убиквитинлигазы . Это один из способов стабилизации р53 в ответ на онкогенные поражения. USP42 также было показано, что он деубиквитинирует p53 и может быть необходим для способности p53 реагировать на стресс.[49]
Недавние исследования показали, что HAUSP в основном локализован в ядре, хотя его часть может быть обнаружена в цитоплазме и митохондриях. Сверхэкспрессия HAUSP приводит к стабилизации p53. Однако истощение HAUSP не приводит к снижению уровней p53, а скорее увеличивает уровни p53 из-за того, что HAUSP связывает и деубиквитинирует Mdm2. Было показано, что HAUSP является лучшим партнером по связыванию с Mdm2, чем p53 в нестрессированных клетках.
Однако было показано, что USP10 располагается в цитоплазме нестрессированных клеток и деубиквитинирует цитоплазматический p53, обращая убиквитинирование Mdm2. После повреждения ДНК USP10 перемещается в ядро и способствует стабильности р53. Также USP10 не взаимодействует с Mdm2.[50]
Фосфорилирование N-концевого конца р53 вышеуказанными протеинкиназами нарушает связывание Mdm2. Другие белки, такие как Pin1, затем привлекаются к p53 и вызывают конформационные изменения в p53, что еще больше предотвращает связывание Mdm2. Фосфорилирование также позволяет связывать коактиваторы транскрипции, такие как p300 и PCAF, которые затем ацетилируют карбокси-конец р53, обнажая ДНК-связывающий домен р53, позволяя ему активировать или репрессировать определенные гены. Ферменты деацетилазы, такие как Sirt1 и Sirt7, может деацетилировать p53, что приводит к ингибированию апоптоза.[51] Некоторые онкогены могут также стимулировать транскрипцию белков, которые связываются с MDM2, и ингибировать его активность.
Роль в болезни


Если TP53 ген поврежден, подавление опухоли серьезно нарушено. Люди, которые наследуют только одну функциональную копию TP53 ген, скорее всего, разовьет опухоли в раннем взрослом возрасте, заболевание, известное как Синдром Ли-Фраумени.
В TP53 ген также может быть изменен мутагены (химикаты, радиация, или же вирусы ), увеличивая вероятность неконтролируемого деления клеток. Более 50 процентов человека опухоли содержать мутация или же удаление из TP53 ген.[52] Потеря p53 создает геномную нестабильность, которая чаще всего приводит к анеуплоидия фенотип.[53]
Увеличение количества p53 может показаться решением для лечения опухолей или предотвращения их распространения. Однако это неприменимый метод лечения, так как он может вызвать преждевременное старение.[54] Восстановление эндогенный нормальная функция p53 обнадеживает. Исследования показали, что это восстановление может привести к регрессу некоторых раковых клеток, не повреждая при этом другие клетки. Способы регрессии опухоли зависят в основном от типа опухоли. Например, восстановление эндогенной функции p53 в лимфомах может вызывать апоптоз, в то время как рост клеток может быть снижен до нормального уровня. Таким образом, фармакологическая реактивация p53 представляет собой жизнеспособный вариант лечения рака.[55][56] Первая коммерческая генная терапия, Гендицина, был одобрен в Китае в 2003 году для лечения плоскоклеточный рак головы и шеи. Он доставляет функциональную копию гена p53 с помощью инженерного аденовирус.[57]
Некоторые патогены также могут влиять на белок p53, который TP53 ген экспрессирует. Один из таких примеров, вирус папилломы человека (HPV), кодирует белок E6, который связывается с белком p53 и инактивирует его. Этот механизм в синергии с инактивацией регулятора клеточного цикла pRb белком Е7 ВПЧ, позволяет повторное деление клеток, клинически проявляющееся как бородавки. Определенные типы ВПЧ, в частности типы 16 и 18, также могут привести к прогрессированию доброкачественной бородавки до низкой или высокой степени. дисплазия шейки матки, которые являются обратимыми формами предраковых поражений. Стойкая инфекция шейка матки с годами может вызвать необратимые изменения, приводящие к карцинома in situ и, в конечном итоге, инвазивный рак шейки матки. Это является результатом воздействия генов HPV, особенно генов, кодирующих E6 и E7, которые представляют собой два вирусных онкобелка, которые предпочтительно сохраняются и экспрессируются при раке шейки матки путем интеграции вирусной ДНК в геном хозяина.[58]
Белок p53 постоянно продуцируется и распадается в клетках здоровых людей, в результате чего затухающие колебания. Распад белка p53 связан со связыванием MDM2. В петле отрицательной обратной связи сам MDM2 индуцируется белком p53. Мутантные белки p53 часто не могут индуцировать MDM2, в результате чего p53 накапливается на очень высоком уровне. Более того, сам мутантный белок p53 может ингибировать нормальный уровень белка p53. В некоторых случаях было показано, что одиночные миссенс-мутации в p53 нарушают стабильность и функцию p53.[59]
Показано, что подавление p53 в клетках рака груди человека приводит к увеличению CXCR5 экспрессия гена хемокинового рецептора и активация миграции клеток в ответ на хемокин CXCL13.[60]
Одно исследование показало, что p53 и Мой с белки были ключом к выживанию Хронический миелоидный лейкоз (CML) клетки. Нацеливание на белки p53 и Myc с помощью лекарств дало положительные результаты на мышах с CML.[61][62]
Экспериментальный анализ мутаций р53
Большинство мутаций р53 обнаруживается с помощью секвенирования ДНК. Однако известно, что единичные миссенс-мутации могут иметь широкий спектр функциональных нарушений - от довольно легких до очень тяжелых.[59]
Большой спектр фенотипов рака из-за мутаций в TP53 ген также подтверждается тем фактом, что разные изоформы белков p53 имеют различные клеточные механизмы предотвращения рака. Мутации в TP53 могут давать начало различным изоформам, препятствуя их общей функциональности в различных клеточных механизмах и тем самым расширяя фенотип рака от легкого до тяжелого. Недавние исследования показывают, что изоформы р53 по-разному экспрессируются в разных тканях человека, и мутации с потерей или усилением функции внутри изоформ может вызывать тканеспецифический рак или вызывать рак стволовая клетка потенциал в разных тканях.[12][63][64][65] Мутация TP53 также влияет на энергетический обмен и увеличивает гликолиз в клетках рака груди.[нужна цитата ]
Динамика белков р53 вместе с его антагонистом Mdm2, показывают, что уровни p53 в единицах концентрации, колебаться как функция времени. Этот "затухающий "колебания клинически подтверждены [66] и математически смоделированный.[67][68] Математические модели также показывают, что концентрация p53 колеблется намного быстрее, когда тератогены, такие как двухцепочечные разрывы (DSB) или УФ-излучение, знакомятся с система. Это поддерживает и моделирует текущее понимание динамики p53, где повреждение ДНК вызывает активацию p53 (см. p53 регуляция для дополнительной информации). Современные модели также могут быть полезны для моделирования мутаций в изоформах p53 и их влияния на колебания p53, тем самым способствуя de novo тканеспецифический фармакологический открытие лекарств.
Открытие
p53 был идентифицирован в 1979 г. Лайонел Кроуфорд, Дэвид П. Лейн, Арнольд Левин, и Ллойд Олд, работая в Императорский фонд исследования рака (ВЕЛИКОБРИТАНИЯ) Университет Принстона / UMDNJ (Институт рака Нью-Джерси) и Мемориальный онкологический центр Слоуна-Кеттеринга, соответственно. Ранее предполагалось, что он существует как цель SV40 вирус, штамм, вызывающий развитие опухолей. В TP53 ген от мыши был впервые клонирован Петр Чумаков из Академия наук СССР в 1982 г.,[69] и независимо в 1983 г. Моше Орен в сотрудничестве с Дэвид Гивол (Институт науки Вейцмана ).[70][71] Человек TP53 ген был клонирован в 1984 г.[8] и полноразмерный клон в 1985 году.[72]
Первоначально предполагалось, что это онкоген из-за использования мутировавших кДНК после очистки опухолевой клетки мРНК. Его роль как ген-супрессор опухоли был открыт в 1989 году Берт Фогельштейн на Школа медицины Джона Хопкинса и Арнольд Левин в Принстонском университете.[73][74]
Уоррен Мальцман из Института Ваксмана Университета Рутгерса впервые продемонстрировал, что TP53 реагирует на повреждение ДНК в виде ультрафиолетового излучения.[75] В серии публикаций 1991–92 гг. Майкл Кастан из Университет Джона Хопкинса, сообщили, что TP53 является важной частью пути передачи сигнала, который помогает клеткам реагировать на повреждение ДНК.[76]
В 1993 году проголосовали за p53. молекула года к Наука журнал.[77]
Изоформы
Как и 95% генов человека, TP53 кодирует более одного белка. Несколько изоформы были обнаружены в 2005 году, и к настоящему времени идентифицировано 12 изоформ p53 человека (p53α, p53β, p53γ, ∆40p53α, ∆40p53β, ∆40p53γ, ∆133p53α, ∆133p53β, ∆133p53γ, ∆160p53α, ∆γ160p53pβ, ∆160p53β, ∆160). Кроме того, изоформы p53 экспрессируются тканезависимым образом, а p53α никогда не экспрессируется отдельно.[12]
Белки изоформы р53 полной длины можно подразделить на различные белковые домены. Начиная с N-конца, сначала находятся аминоконцевые домены трансактивации (TAD 1, TAD 2), которые необходимы для индукции субнабора целевых генов p53. За этим доменом следует богатый пролином домен (PXXP), при этом мотив PXXP повторяется (P представляет собой пролин, а X может быть любой аминокислотой). Это необходимо среди прочего для опосредованного p53 апоптоз.[78] У некоторых изоформ отсутствует богатый пролином домен, например Δ133p53β, γ и Δ160p53α, β, γ; следовательно, некоторые изоформы p53 не опосредуют апоптоз, что подчеркивает диверсифицирующую роль TP53 ген.[63] Затем идет ДНК-связывающий домен (DBD), который позволяет белкам секвенировать специфическое связывание. В карбоксильный терминал домен завершает белок. Он включает сигнал ядерной локализации (NLS), сигнал ядерного экспорта (NES) и домен олигомеризации (OD). NLS и NES отвечают за субклеточную регуляцию p53. Через OD p53 может образовывать тетрамер, а затем связываться с ДНК. Среди изоформ некоторые домены могут отсутствовать, но все они имеют большую часть высококонсервативного ДНК-связывающего домена.
Изоформы образуются по разным механизмам. Бета- и гамма-изоформы генерируются путем множественного сплайсинга интрона 9, что приводит к другому С-концу. Более того, использование внутреннего промотора в интроне 4 приводит к образованию изоформ ∆133 и ∆160, в которых отсутствует домен TAD и часть DBD. Более того, альтернативная инициация трансляции в кодоне 40 или 160 несет изоформы ∆40p53 и ∆160p53.[12]
Из-за изоформный природы белков р53, было несколько источников доказательств того, что мутации внутри TP53 ген, дающий начало мутировавшим изоформам, является возбудителем различных фенотипов рака, от легкого до тяжелого, из-за единственной мутации в TP53 ген (см. раздел Экспериментальный анализ мутаций р53 Больше подробностей).
Взаимодействия
p53 было показано взаимодействовать с:
- AIMP2,[79]
- ANKRD2,[80]
- APTX,[81]
- Банкомат,[82][83][84][85][86]
- ATR,[82][83]
- ATF3,[87][88]
- АУРКА,[89]
- BAK1,[90]
- BARD1,[91]
- BLM,[92][93][94][95]
- BRCA1,[91][96][97][98][99]
- BRCA2,[91][100]
- BRCC3,[91]
- BRE,[91]
- CEBPZ,[101]
- CDC14A,[102]
- Cdk1,[103][104]
- CFLAR,[105]
- ЧЕК1,[92][106][107]
- CCNG1,[108]
- CREBBP,[109][110][111]
- CREB1,[111]
- Циклин H,[112]
- CDK7,[112][113]
- ДНК-PKcs,[83][106][114]
- E4F1,[115][116]
- EFEMP2,[117]
- EIF2AK2,[118]
- ELL,[119]
- EP300,[110][120][121][122]
- ERCC6,[123][124]
- GNL3,[125]
- GPS2,[126]
- GSK3B,[127]
- HSP90AA1,[128][129][130]
- HIF1A,[131][132][133][134]
- HIPK1,[135]
- HIPK2,[136][137]
- HMGB1,[138][139]
- HSPA9,[140]
- Хантингтин,[141]
- ING1,[142][143]
- ING4,[144][145]
- ING5,[144]
- IκBα,[146]
- КПНБ1,[128]
- LMO3,[27]
- Mdm2,[109][147][148][149]
- MDM4,[150][151]
- MED1,[152][153]
- MAPK9,[154][155]
- MNAT1,[113]
- NDN,[156]
- NCL,[157]
- ОНЕМЕВШИЙ,[158]
- NF-κB,[159]
- P16,[115][149][160]
- PARC,[161]
- PARP1,[81][162]
- PIAS1,[117][163]
- CDC14B,[102]
- PIN1,[164][165]
- PLAGL1,[166]
- PLK3,[167][168]
- PRKRA,[169]
- PHB,[170]
- PML,[147][171][172]
- PSME3,[173]
- PTEN,[148]
- ПТК2,[174]
- PTTG1,[175]
- RAD51,[91][176][177]
- RCHY1,[178][179]
- РЕЛА,[159]
- Репримо[180]
- RPA1,[181][182]
- RPL11,[160]
- S100B,[183]
- SUMO1,[184][185]
- SMARCA4,[186]
- SMARCB1,[186]
- SMN1,[187]
- STAT3,[159]
- TBP,[188][189]
- TFAP2A,[190]
- TFDP1,[191]
- ТИГАР,[192]
- ТОП1,[193][194]
- TOP2A,[195]
- TP53BP1,[92][196][197][198][199][200][201]
- TP53BP2,[201][202]
- TOP2B,[195]
- TP53INP1,[203][204]
- TSG101,[205]
- UBE2A,[206]
- UBE2I,[117][184][207][208]
- UBC,[79][173][185][209][210][211][212][213]
- USP7,[214]
- WRN,[95][215]
- WWOX,[216]
- XPB,[123]
- YBX1,[80][217]
- YPEL3,[218]
- YWHAZ,[219]
- Zif268,[220]
- ZNF148,[221]
- SIRT1,[222]
- circRNA_014511.[223]
Смотрите также
- Пифитрин, ингибитор P53
Примечания
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000141510 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000059552 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Toufektchan, E .; Толедо, Ф. (2018). «Возвращение к хранителю генома: P53 подавляет гены, необходимые для поддержания теломер, восстановления ДНК и структуры центромеры». Рак. 10 (5): 135. Дои:10.3390 / раки10050135. ЧВК 5977108. PMID 29734785.
- ^ а б c Surget S, Khoury MP, Bourdon JC (декабрь 2013 г.). «Раскрытие роли вариантов сплайсинга p53 в злокачественных новообразованиях человека: клиническая перспектива». ОнкоЦели и терапия. 7: 57–68. Дои:10.2147 / OTT.S53876. ЧВК 3872270. PMID 24379683.
- ^ Прочтите AP, Strachan T (1999). «Глава 18: Генетика рака». Молекулярная генетика человека 2. Нью-Йорк: Вили. ISBN 978-0-471-33061-5.
- ^ а б c Матлашевски Г., Лэмб П., Пим Д., Пикок Дж., Кроуфорд Л., Бенчимол С. (декабрь 1984 г.). «Выделение и характеристика клона кДНК человеческого р53: экспрессия гена р53 человека». Журнал EMBO. 3 (13): 3257–62. Дои:10.1002 / j.1460-2075.1984.tb02287.x. ЧВК 557846. PMID 6396087.
- ^ а б Исобе М., Эмануэль Б.С., Гивол Д., Орен М., Кроче С.М. (1986). «Локализация гена опухолевого антигена человека p53 на полосе 17p13». Природа. 320 (6057): 84–5. Bibcode:1986Натура 320 ... 84I. Дои:10.1038 / 320084a0. PMID 3456488. S2CID 4310476.
- ^ а б Керн С.Е., Кинцлер К.В., Брускин А., Ярош Д., Фридман П., Привес С., Фогельштейн Б. (июнь 1991 г.). «Идентификация p53 как последовательности-специфичного ДНК-связывающего белка». Наука. 252 (5013): 1708–11. Bibcode:1991Научный ... 252.1708K. Дои:10.1126 / science.2047879. PMID 2047879. S2CID 19647885.
- ^ а б Макбрайд О.В., Мерри Д., Гивол Д. (январь 1986 г.). «Ген антигена клеточной опухоли человека p53 расположен на коротком плече хромосомы 17 (17p13)». Труды Национальной академии наук Соединенных Штатов Америки. 83 (1): 130–4. Bibcode:1986ПНАС ... 83..130М. Дои:10.1073 / пнас.83.1.130. ЧВК 322805. PMID 3001719.
- ^ а б c d Бурдон Дж. К., Фернандес К., Мюррей-Змиевски Ф., Лю Дж., Диот А., Ксиродимас Д. П., Сэвилл М.К., Лейн Д.П. (сентябрь 2005 г.). «Изоформы p53 могут регулировать транскрипционную активность p53». Гены и развитие. 19 (18): 2122–37. Дои:10.1101 / gad.1339905. ЧВК 1221884. PMID 16131611.
- ^ Цимер М.А., Мейсон А., Карлсон Д.М. (сентябрь 1982 г.). «Бесклеточные трансляции мРНК богатого пролином белка». Журнал биологической химии. 257 (18): 11176–80. PMID 7107651.
- ^ Левин А.Дж., Лейн Д.П., ред. (2010). Семейство p53. Перспективы Колд-Спринг-Харбор в биологии. Колд-Спринг-Харбор, Нью-Йорк: Лаборатория Колд-Спринг-Харбор. ISBN 978-0-87969-830-0.
- ^ May P, May E (декабрь 1999 г.). «Двадцать лет исследований p53: структурные и функциональные аспекты белка p53». Онкоген. 18 (53): 7621–36. Дои:10.1038 / sj.onc.1203285. PMID 10618702.
- ^ «Филогенетический маркер OrthoMaM: кодирующая последовательность TP53». Архивировано из оригинал на 2018-03-17. Получено 2009-12-02.
- ^ Клуг С.Дж., Рессинг М., Кениг Дж., Абба М.К., Агорастос Т., Бренна С.М. и др. (Август 2009 г.). «Полиморфизм кодона 72 TP53 и рак шейки матки: объединенный анализ индивидуальных данных из 49 исследований». Ланцет. Онкология. 10 (8): 772–84. Дои:10.1016 / S1470-2045 (09) 70187-1. PMID 19625214.
- ^ Сонояма Т., Сакаи А., Мита Й, Ясуда Ю., Кавамото Х, Яги Т., Йошиока М., Мимура Т., Накачи К., Оучида М., Ямамото К., Симидзу К. (2011). «Полиморфизм кодона 72 TP53 связан с риском рака поджелудочной железы у мужчин, курильщиков и пьющих». Отчеты по молекулярной медицине. 4 (3): 489–95. Дои:10.3892 / ммр.2011.449. PMID 21468597.
- ^ Alawadi S, Ghabreau L, Alsaleh M, Abdulaziz Z, Rafeek M, Akil N, Alkhalaf M (сентябрь 2011 г.). «Полиморфизм гена P53 и риск рака груди у арабских женщин». Медицинская онкология. 28 (3): 709–15. Дои:10.1007 / s12032-010-9505-4. PMID 20443084. S2CID 207372095.
- ^ Ю Х, Хуанг Й. Дж., Лю З., Ван ЛЭ, Ли Дж., Стерджис Э. М., Джонсон Д. Г., Вэй Кью (сентябрь 2011 г.). «Влияние полиморфизма промотора MDM2 и полиморфизма кодона 72 p53 на риск и возраст начала плоскоклеточного рака головы и шеи». Молекулярный канцерогенез. 50 (9): 697–706. Дои:10.1002 / mc.20806. ЧВК 3142329. PMID 21656578.
- ^ Пяо Дж. М., Ким Х. Н., Сон Х. Р., Квион С. С., Чой Дж. С., Юн В.Дж., Ким Й.С., О Ай-Джей, Ким К.С., Шин М.Х. (сентябрь 2011 г.). «Полиморфизм кодона 72 p53 и риск рака легких в корейской популяции». Рак легких. 73 (3): 264–7. Дои:10.1016 / j.lungcan.2010.12.017. PMID 21316118.
- ^ Ван Дж.Дж., Чжэн Й., Сунь Л., Ван Л., Ю ПБ, Донг Дж.Х., Чжан Л., Сю Дж., Ши В., Рен Ю.С. (ноябрь 2011 г.). «Полиморфизм кодона 72 TP53 и восприимчивость к колоректальному раку: метаанализ». Отчеты по молекулярной биологии. 38 (8): 4847–53. Дои:10.1007 / s11033-010-0619-8. PMID 21140221. S2CID 11730631.
- ^ Цзян Д.К., Яо Л., Рен У.Х., Ван В.З., Пэн Б., Ю Л. (декабрь 2011 г.). «Полиморфизм TP53 Arg72Pro и риск рака эндометрия: метаанализ». Медицинская онкология. 28 (4): 1129–35. Дои:10.1007 / s12032-010-9597-х. PMID 20552298. S2CID 32990396.
- ^ Thurow HS, Haack R, Hartwig FP, Oliveira IO, Dellagostin OA, Gigante DP, Horta BL, Collares T, Seixas FK (декабрь 2011 г.). «Полиморфизм гена TP53: важность для рака, этнической принадлежности и веса при рождении в бразильской когорте». Журнал биологических наук. 36 (5): 823–31. Дои:10.1007 / s12038-011-9147-5. PMID 22116280. S2CID 23027087.
- ^ Хуанг CY, Su CT, Chu JS, Huang SP, Pu YS, Yang HY, Chung CJ, Wu CC, Hsueh YM (декабрь 2011 г.). «Полиморфизм кодона 72 P53 и MDM2 SNP309 и риск почечно-клеточной карциномы в зоне с низким уровнем воздействия мышьяка». Токсикология и прикладная фармакология. 257 (3): 349–55. Дои:10.1016 / j.taap.2011.09.018. PMID 21982800.
- ^ Venot C, Maratrat M, Dureuil C, Conseiller E, Bracco L, Debussche L (август 1998). «Потребность в функциональном домене p53, богатом пролином, для опосредования апоптоза коррелирует со специфической трансактивацией гена PIG3 и с репрессией транскрипции». Журнал EMBO. 17 (16): 4668–79. Дои:10.1093 / emboj / 17.16.4668. ЧВК 1170796. PMID 9707426.
- ^ а б Ларсен С., Йокочи Т., Исогай Э., Накамура Ю., Одзаки Т., Накагавара А. (февраль 2010 г.). «LMO3 взаимодействует с p53 и подавляет его транскрипционную активность». Сообщения о биохимических и биофизических исследованиях. 392 (3): 252–7. Дои:10.1016 / j.bbrc.2009.12.010. PMID 19995558.
- ^ Хармс К.Л., Чен Х (март 2005 г.). «С-конец белков семейства р53 является детерминантом клеточной судьбы». Молекулярная и клеточная биология. 25 (5): 2014–30. Дои:10.1128 / MCB.25.5.2014-2030.2005. ЧВК 549381. PMID 15713654.
- ^ Белл С., Кляйн С., Мюллер Л., Хансен С., Бюхнер Дж. (Октябрь 2002 г.). «p53 содержит большие неструктурированные области в своем естественном состоянии». Журнал молекулярной биологии. 322 (5): 917–27. Дои:10.1016 / S0022-2836 (02) 00848-3. PMID 12367518.
- ^ Гилберт, Скотт Ф. Биология развития, 10-е изд.. Сандерленд, Массачусетс, США: Издательство Sinauer Associates, Inc. п. 588.
- ^ Национальный центр биотехнологической информации (1998 г.). Белок-супрессор опухолей p53. Гены и болезнь. Национальные институты здравоохранения США. Получено 2008-05-28.
- ^ Бейтс С., Филлипс А.С., Кларк П.А., Стотт Ф., Петерс Г., Людвиг Р.Л., Вусден К.Х. (сентябрь 1998 г.). «p14ARF связывает опухолевые супрессоры RB и p53». Природа. 395 (6698): 124–5. Bibcode:1998Натура.395..124Б. Дои:10.1038/25867. PMID 9744267. S2CID 4355786.
- ^ "Хранитель генома загорает". Новый ученый. 17 марта 2007 г.. Получено 2007-03-29.
- ^ Cui R, Widlund HR, Feige E, Lin JY, Wilensky DL, Igras VE, D'Orazio J, Fung CY, Schanbacher CF, Granter SR, Fisher DE (март 2007 г.). «Центральная роль p53 в ответе на загар и патологической гиперпигментации». Клетка. 128 (5): 853–64. Дои:10.1016 / j.cell.2006.12.045. PMID 17350573.
- ^ а б Джайн А.К., Оллтон К., Яковино М., Махен Э., Милчарек Р.Дж., Звака Т.П., Киба М., Бартон М.К. (2012). «p53 регулирует клеточный цикл и микроРНК, способствуя дифференцировке эмбриональных стволовых клеток человека». PLOS Биология. 10 (2): e1001268. Дои:10.1371 / journal.pbio.1001268. ЧВК 3289600. PMID 22389628.
- ^ Маймец Т., Неганова И., Армстронг Л., Лако М. (сентябрь 2008 г.). «Активация р53 нутлином приводит к быстрой дифференцировке эмбриональных стволовых клеток человека». Онкоген. 27 (40): 5277–87. Дои:10.1038 / onc.2008.166. PMID 18521083.
- ^ тер Хурне М., Пэн Т., Йи Дж., ван Мирло Г., Маркс Х., Штунненберг Г. Г. (февраль 2020 г.). «Критическая роль P53 в регуляции клеточного цикла основных эмбриональных стволовых клеток». Отчеты о стволовых клетках. 14 (2): 175–183. Дои:10.1016 / j.stemcr.2020.01.001. ЧВК 7013234. PMID 32004494.
- ^ Дас Б., Баят-Мохтари Р., Цуй М., Лотфи С., Цучида Р., Фельшер Д. В., Егер Х. (август 2012 г.). «HIF-2α подавляет p53 для повышения стволовости и регенеративного потенциала эмбриональных стволовых клеток человека». Стволовые клетки. 30 (8): 1685–95. Дои:10.1002 / шток.1142. ЧВК 3584519. PMID 22689594.
- ^ Lake BB, Fink J, Klemetsaune L, Fu X, Jeffers JR, Zambetti GP, Xu Y (май 2012 г.). «Контекстно-зависимое усиление индуцированного репрограммирования плюрипотентных стволовых клеток путем подавления звука Puma». Стволовые клетки. 30 (5): 888–97. Дои:10.1002 / стержень.1054. ЧВК 3531606. PMID 22311782.
- ^ Марион Р.М., Страти К., Ли Х., Мурга М., Бланко Р., Ортега С., Фернандес-Капетильо О., Серрано М., Бласко М.А. (август 2009 г.). «P53-опосредованная реакция на повреждение ДНК ограничивает перепрограммирование, чтобы гарантировать целостность генома iPS-клеток». Природа. 460 (7259): 1149–53. Bibcode:2009 Натур.460.1149М. Дои:10.1038 / природа08287. ЧВК 3624089. PMID 19668189.
- ^ Юн М. Х., Гейтс ПБ, Брокес Дж. П. (октябрь 2013 г.). «Регулирование p53 имеет решающее значение для регенерации конечностей позвоночных». Труды Национальной академии наук Соединенных Штатов Америки. 110 (43): 17392–7. Bibcode:2013ПНАС..11017392Г. Дои:10.1073 / pnas.1310519110. ЧВК 3808590. PMID 24101460.
- ^ Алони-Гринштейн Р., Шетцер Ю., Кауфман Т., Роттер В. (август 2014 г.). «p53: барьер для образования раковых стволовых клеток». Письма FEBS. 588 (16): 2580–9. Дои:10.1016 / j.febslet.2014.02.011. PMID 24560790. S2CID 37901173.
- ^ Теодоро Дж. Г., Эванс С. К., Грин М. Р. (ноябрь 2007 г.). «Ингибирование опухолевого ангиогенеза с помощью p53: новая роль хранителя генома». Журнал молекулярной медицины (Рассмотрение). 85 (11): 1175–86. Дои:10.1007 / s00109-007-0221-2. PMID 17589818. S2CID 10094554.
- ^ Ассадиан С., Эль-Ассад В., Ван XQ, Ганнон П.О., Баррес В., Латур М., Мес-Массон А.М., Саад Ф., Садо Й., Дости Дж., Теодоро Д.Г. (март 2012 г.). «p53 ингибирует ангиогенез, индуцируя выработку аррестена». Исследования рака. 72 (5): 1270–9. Дои:10.1158 / 0008-5472.CAN-11-2348. PMID 22253229.
- ^ Ху В., Фэн З., Терески А.К., Левин А.Дж. (ноябрь 2007 г.). «p53 регулирует материнское воспроизводство через LIF». Природа. 450 (7170): 721–4. Bibcode:2007Натура.450..721H. Дои:10.1038 / природа05993. PMID 18046411. S2CID 4357527.
- ^ Хан Э.С., Мюллер Флорида, Перес В.И., Ци В., Лян Х., Си Л., Фу С., Дойл Э, Хики М., Корнелл Дж., Эпштейн С.Дж., Робертс Л.Дж., Ван Реммен Х., Ричардсон А. (июнь 2008 г.). «Признак экспрессии гена in vivo окислительного стресса». Физиологическая геномика. 34 (1): 112–26. Дои:10.1152 / физиолгеномика.00239.2007. ЧВК 2532791. PMID 18445702.
- ^ Первис, Джереми Э .; Karhohs, Kyle W .; Мок, Кэролайн; Бэтчелор, Эрик; Лёвер, Александр; Лахав, Галит (15.06.2012). "динамика p53 контролирует судьбу клетки". Наука. 336 (6087): 1440–1444. Bibcode:2012Научный ... 336.1440P. Дои:10.1126 / наука.1218351. ISSN 1095-9203. ЧВК 4162876. PMID 22700930.
- ^ Каннер Дж. А., Собо М., Болл С., Хатцен Б., ДеАнгелис С., Уиллис В., Студебеккер А. В., Динг К., Ван С., Ян Д., Лин Дж. (Сентябрь 2009 г.). «MI-63: новый низкомолекулярный ингибитор нацелен на MDM2 и вызывает апоптоз в эмбриональных и альвеолярных клетках рабдомиосаркомы с р53 дикого типа». Британский журнал рака. 101 (5): 774–81. Дои:10.1038 / sj.bjc.6605199. ЧВК 2736841. PMID 19707204.
- ^ Hock AK, Vigneron AM, Carter S, Ludwig RL, Vousden KH (ноябрь 2011 г.). «Регулирование стабильности и функции p53 с помощью деубиквитинирующего фермента USP42». Журнал EMBO. 30 (24): 4921–30. Дои:10.1038 / emboj.2011.419. ЧВК 3243628. PMID 22085928.
- ^ Юань Дж., Ло К., Чжан Л., Чевиль Дж. К., Лу З. (февраль 2010 г.). «USP10 регулирует локализацию и стабильность p53 путем деубиквитинирования p53». Клетка. 140 (3): 384–96. Дои:10.1016 / j.cell.2009.12.032. ЧВК 2820153. PMID 20096447.
- ^ Вахрушева О., Смолка С., Гаджавада П., Костин С., Боетгер Т., Кубин Т., Браун Т., Бобер Е. (март 2008 г.). «Sirt7 повышает стрессоустойчивость кардиомиоцитов и предотвращает апоптоз и воспалительную кардиомиопатию у мышей». Циркуляционные исследования. 102 (6): 703–10. Дои:10.1161 / CIRCRESAHA.107.164558. PMID 18239138.
- ^ Холлштейн М., Сидранский Д., Фогельштейн Б., Харрис С.К. (июль 1991 г.). «мутации p53 при раке человека». Наука. 253 (5015): 49–53. Bibcode:1991Наука ... 253 ... 49H. Дои:10.1126 / science.1905840. PMID 1905840.
- ^ Шмитт CA, Фридман Дж.С., Ян М., Баранов Э., Хоффман Р.М., Лоу С.В. (апрель 2002 г.). «Рассечение опухолевых супрессорных функций p53 in vivo». Раковая клетка. 1 (3): 289–98. Дои:10.1016 / S1535-6108 (02) 00047-8. PMID 12086865.
- ^ Тайнер С.Д., Венкатачалам С., Чой Дж., Джонс С., Гебраниус Н., Игельманн Х., Лу Х, Сорон Дж., Купер Б., Брайтон С., Парк С.Х., Томпсон Т., Карсенти Дж., Брэдли А., Донехауэр Л.А. (январь 2002 г.). «Мыши с мутантом р53, которые проявляют фенотипы, связанные со старением». Природа. 415 (6867): 45–53. Bibcode:2002 Натур 415 ... 45 т. Дои:10.1038 / 415045a. PMID 11780111. S2CID 749047.
- ^ Вентура А., Кирш Д. Г., Маклафлин М. Е., Тувсон Д. А., Гримм Дж., Линто Л., Ньюман Дж., Речек Е. Е., Вайследер Р., Джекс Т. (февраль 2007 г.). «Восстановление функции p53 приводит к регрессии опухоли in vivo». Природа. 445 (7128): 661–5. Дои:10.1038 / природа05541. PMID 17251932. S2CID 4373520.
- ^ Герц HD, Дэн В., Хельма Дж., Леонхардт Х., Кардосо М.С. (2013). «Визуализация и целенаправленное нарушение белковых взаимодействий в живых клетках». Nature Communications. 4: 2660. Bibcode:2013 НатКо ... 4.2660H. Дои:10.1038 / ncomms3660. ЧВК 3826628. PMID 24154492.
- ^ Пирсон С., Джиа Х, Кандачи К. (январь 2004 г.). «Китай одобрил первую генную терапию». Природа Биотехнологии. 22 (1): 3–4. Дои:10.1038 / nbt0104-3. ЧВК 7097065. PMID 14704685.
- ^ Анджелетти П.С., Чжан Л., Вуд С. (2008). «Вирусная этиология злокачественных новообразований, связанных со СПИДом». Вирусная этиология злокачественных новообразований, связанных со СПИДом. Успехи фармакологии. 56. С. 509–57. Дои:10.1016 / S1054-3589 (07) 56016-3. ISBN 9780123736017. ЧВК 2149907. PMID 18086422.
- ^ а б Баллок А.Н., Хенкель Дж., ДеДеккер Б.С., Джонсон С.М., Николова П.В., Проктор М.Р., Лейн Д.П., Фершт А.Р. (декабрь 1997 г.). «Термодинамическая стабильность корового домена р53 дикого типа и мутантного». Труды Национальной академии наук Соединенных Штатов Америки. 94 (26): 14338–42. Bibcode:1997PNAS ... 9414338B. Дои:10.1073 / пнас.94.26.14338. ЧВК 24967. PMID 9405613.
- ^ Миткин Н.А., Крюк С.Д., Шварц А.М., Бисвас С., Кочетков Д.В., Муратова А.М., Афанасьева М.А., Кравченко Ю.Е., Бхаттачарья А., Купраш Д.В. (март 2015). «p53-зависимая экспрессия хемокинового рецептора CXCR5 в клетках рака молочной железы MCF-7». Научные отчеты. 5 (5): 9330. Bibcode:2015НатСР ... 5Э9330М. Дои:10.1038 / srep09330. ЧВК 4365401. PMID 25786345.
- ^ Abraham SA, Hopcroft LE, Carrick E, Drotar ME, Dunn K, Williamson AJ, Korfi K, Baquero P, Park LE, Scott MT, Pellicano F, Pierce A, Copland M, Nourse C, Grimmond SM, Vetrie D, Whetton AD , Holyoake TL (июнь 2016 г.). «Двойное нацеливание на p53 и c-MYC избирательно устраняет лейкемические стволовые клетки». Природа. 534 (7607): 341–6. Bibcode:2016Натура.534..341A. Дои:10.1038 / природа18288. ЧВК 4913876. PMID 27281222.
- ^ «Ученые идентифицируют лекарства, нацеленные на« ахиллесову пяту »клеток хронического миелоидного лейкоза». myScience. 2016-06-08. Получено 2016-06-09.
- ^ а б Хури, член парламента Бурдон (апрель 2011 г.). "Изоформы p53: внутриклеточный микропроцессор?". Гены и рак. 2 (4): 453–65. Дои:10.1177/1947601911408893. ЧВК 3135639. PMID 21779513.
- ^ Эвери-Кейда К.А., Мортен Б., Вонг-Браун М.В., Мате А., Скотт Р.Дж. (март 2014 г.). «Относительная экспрессия мРНК изоформ p53 при раке груди связана с клиническими особенностями и исходом». Канцерогенез. 35 (3): 586–96. Дои:10.1093 / carcin / bgt411. PMID 24336193.
- ^ Арсич Н., Гадеа Дж., Лагерквист Е.Л., Бюссон М., Каузак Н., Брок С., Олланд Ф., Жир В., Паннекен Дж., Ру П. (апрель 2015 г.). «Изоформа p53 Δ133p53β способствует развитию потенциала раковых стволовых клеток». Отчеты о стволовых клетках. 4 (4): 531–40. Дои:10.1016 / j.stemcr.2015.02.001. ЧВК 4400643. PMID 25754205.
- ^ Гева-Заторский Н., Розенфельд Н., Ицковиц С., Майло Р., Сигал А., Декель Е., Ярницкий Т., Лирон Ю., Полак П., Лахав Г., Алон Ю. (июнь 2006 г.). «Колебания и изменчивость в системе p53». Молекулярная системная биология. 2: 2006.0033. Дои:10.1038 / msb4100068. ЧВК 1681500. PMID 16773083.
- ^ Проктор CJ, Грей Д.А. (август 2008 г.). «Объяснение колебаний и вариабельности в системе p53-Mdm2». BMC Systems Biology. 2 (75): 75. Дои:10.1186/1752-0509-2-75. ЧВК 2553322. PMID 18706112.
- ^ Чонг К.Х., Самарасинге С., Куласири Д. (декабрь 2013 г.). «Математическое моделирование базальной динамики p53 и ответа на повреждение ДНК». C-FACS. 259 (20-й Международный конгресс по математическому моделированию и моделированию): 670–6. Дои:10.1016 / j.mbs.2014.10.010. PMID 25433195.
- ^ Чумаков П.М., Иоцова В.С., Георгиев Г.П. (1982). «[Выделение клона плазмиды, содержащего последовательность мРНК невирусного Т-антигена мыши]». Доклады Академии Наук СССР (на русском). 267 (5): 1272–5. PMID 6295732.
- ^ Орен М., Левин А.Дж. (январь 1983 г.). «Молекулярное клонирование кДНК, специфичной для мышиного антигена клеточной опухоли p53». Труды Национальной академии наук Соединенных Штатов Америки. 80 (1): 56–9. Bibcode:1983ПНАС ... 80 ... 56О. Дои:10.1073 / pnas.80.1.56. ЧВК 393308. PMID 6296874.
- ^ Закут-Хоури Р., Орен М., Биенц Б., Лави В., Хазум С., Гивол Д. (1983). «Один ген и псевдоген клеточного опухолевого антигена p53». Природа. 306 (5943): 594–7. Bibcode:1983Натура.306..594Z. Дои:10.1038 / 306594a0. PMID 6646235. S2CID 4325094.
- ^ Закут-Хоури Р., Бьенц-Тадмор Б., Гивол Д., Орен М. (май 1985 г.). «Антиген клеточной опухоли человека p53: последовательность кДНК и экспрессия в клетках COS». Журнал EMBO. 4 (5): 1251–5. Дои:10.1002 / j.1460-2075.1985.tb03768.x. ЧВК 554332. PMID 4006916.
- ^ Бейкер С.Дж., Фирон Э.Р., Нигро Дж. М., Гамильтон С. Р., Прайзингер А. С., Джессап Дж. М., ванТуйнен П., Ледбеттер Д.Х., Баркер Д.Ф., Накамура И., Уайт Р., Фогельштейн Б. (апрель 1989 г.). «Делеции хромосомы 17 и мутации гена p53 в колоректальных карциномах». Наука. 244 (4901): 217–21. Bibcode:1989Научный ... 244..217B. Дои:10.1126 / science.2649981. PMID 2649981.
- ^ Finlay CA, Hinds PW, Levine AJ (июнь 1989 г.). «Протоонкоген p53 может действовать как супрессор трансформации». Клетка. 57 (7): 1083–93. Дои:10.1016/0092-8674(89)90045-7. PMID 2525423.
- ^ Мальцман В., Чзык Л. (сентябрь 1984 г.). «УФ-облучение стимулирует уровни клеточного опухолевого антигена p53 в нетрансформированных клетках мыши». Молекулярная и клеточная биология. 4 (9): 1689–94. Дои:10.1128 / mcb.4.9.1689. ЧВК 368974. PMID 6092932.
- ^ Кастан MB, Kuerbitz SJ (декабрь 1993 г.). «Контроль остановки G1 после повреждения ДНК». Перспективы гигиены окружающей среды. 101 Дополнение 5 (Дополнение 5): 55–8. Дои:10.2307/3431842. JSTOR 3431842. ЧВК 1519427. PMID 8013425.
- ^ Кошланд Д.Е. (декабрь 1993 г.). «Молекула года». Наука. 262 (5142): 1953. Bibcode:1993Научный ... 262,1953K. Дои:10.1126 / наука.8266084. PMID 8266084.
- ^ Чжу Дж., Чжан С., Цзян Дж., Чен Х (декабрь 2000 г.). «Определение функциональных доменов р53, необходимых для индукции апоптоза». Журнал биологической химии. 275 (51): 39927–34. Дои:10.1074 / jbc.M005676200. PMID 10982799.
- ^ а б Хан Дж.М., Пак Би Джей, Пак С.Г., О Й.С., Чой С.Дж., Ли С.В., Хван С.К., Чанг Ш., Чо М.Х., Ким С. (август 2008 г.). «AIMP2 / p38, каркас для комплекса мульти-тРНК синтетазы, отвечает на генотоксические стрессы через p53». Труды Национальной академии наук Соединенных Штатов Америки. 105 (32): 11206–11. Bibcode:2008PNAS..10511206H. Дои:10.1073 / pnas.0800297105. ЧВК 2516205. PMID 18695251.
- ^ а б Kojic S, Medeot E, Guccione E, Krmac H, Zara I, Martinelli V, Valle G, Faulkner G (май 2004 г.). «Белок Ankrd2, связующее звено между саркомером и ядром скелетных мышц». Журнал молекулярной биологии. 339 (2): 313–25. Дои:10.1016 / j.jmb.2004.03.071. PMID 15136035.
- ^ а б Гевен Н., Бешерел О.Дж., Киджас А.В., Чен П., Хоу О., Рудольф Дж. Х., Гатти Р., Дате Х., Онодера О., Таучер-Шольц Г., Лавин М. Ф. (май 2004 г.). «Апратаксин, новый белок, защищающий от генотоксического стресса». Молекулярная генетика человека. 13 (10): 1081–93. Дои:10,1093 / hmg / ddh122. PMID 15044383.
- ^ а б Фаббро М., Сэвидж К., Хобсон К., Динс А.Дж., Пауэлл С.Н., Макартур Г.А., Ханна К.К. (июль 2004 г.). «Комплексы BRCA1-BARD1 необходимы для фосфорилирования p53Ser-15 и остановки G1 / S после повреждения ДНК, вызванного ионизирующим излучением». Журнал биологической химии. 279 (30): 31251–8. Дои:10.1074 / jbc.M405372200. PMID 15159397.
- ^ а б c Ким С.Т., Лим Д.С., Канман С.Е., Кастан МБ (декабрь 1999 г.). «Субстратные особенности и идентификация предполагаемых субстратов членов семейства киназ ATM». Журнал биологической химии. 274 (53): 37538–43. Дои:10.1074 / jbc.274.53.37538. PMID 10608806.
- ^ Кан Дж., Фергюсон Д., Сонг Х, Бассинг С., Экерсдорф М., Альт Ф. В., Сюй И (январь 2005 г.). «Функциональное взаимодействие H2AX, NBS1 и p53 в ATM-зависимых ответах на повреждение ДНК и подавлении опухоли». Молекулярная и клеточная биология. 25 (2): 661–70. Дои:10.1128 / MCB.25.2.661-670.2005. ЧВК 543410. PMID 15632067.
- ^ Ханна К.К., Китинг К.Э., Козлов С., Скотт С., Гейтей М., Хобсон К., Тая Ю., Габриэлли Б., Чан Д., Лис-Миллер С.П., Лавин М.Ф. (декабрь 1998 г.). «ATM связывает и фосфорилирует p53: картирование области взаимодействия». Природа Генетика. 20 (4): 398–400. Дои:10.1038/3882. PMID 9843217. S2CID 23994762.
- ^ Вестфаль С.Х., Шмальц С., Роуэн С., Элсон А., Фишер Д.Е., Ледер П. (май 1997 г.). «Генетические взаимодействия между atm и p53 влияют на клеточную пролиферацию и контрольные точки клеточного цикла, вызванные облучением». Исследования рака. 57 (9): 1664–7. PMID 9135004.
- ^ Stelzl U, Worm U, Lalowski M, Haenig C, Brembeck FH, Goehler H, Stroedicke M, Zenkner M, Schoenherr A, Koeppen S, Timm J, Mintzlaff S, Abraham C, Bock N, Kietzmann S, Goedde A, Toksöz E , Droege A, Krobitsch S, Korn B, Birchmeier W, Lehrach H, Wanker EE (сентябрь 2005 г.). «Сеть белок-белкового взаимодействия человека: ресурс для аннотирования протеома». Клетка. 122 (6): 957–68. Дои:10.1016 / j.cell.2005.08.029. PMID 16169070.
- ^ Ян Ц., Ван Х, Бойд Д.Д. (март 2002 г.). «ATF3 подавляет экспрессию 72-кДа коллагеназы типа IV (MMP-2) путем антагонизма р53-зависимой трансактивации промотора коллагеназы». Журнал биологической химии. 277 (13): 10804–12. Дои:10.1074 / jbc.M112069200. PMID 11792711.
- ^ Чен С.С., Чанг П.С., Ченг Ю.В., Тан Ф.М., Лин Ю.С. (сентябрь 2002 г.). «Подавление онкогенной активности STK15 требует независимой от трансактивации функции p53». Журнал EMBO. 21 (17): 4491–9. Дои:10.1093 / emboj / cdf409. ЧВК 126178. PMID 12198151.
- ^ Леу Джи, Дюмон П., Хафей М., Мерфи М.Э., Джордж Д.Л. (май 2004 г.). «Митохондриальный p53 активирует Bak и вызывает нарушение комплекса Bak-Mcl1». Природа клеточной биологии. 6 (5): 443–50. Дои:10.1038 / ncb1123. PMID 15077116. S2CID 43063712.
- ^ а б c d е ж Донг Й., Хакими М.А., Чен Х, Кумарасвами Э., Куч Н.С., Годвин А.К., Шихаттар Р. (ноябрь 2003 г.). «Регулирование BRCC, холоферментного комплекса, содержащего BRCA1 и BRCA2, с помощью субъединицы, подобной сигнаносоме, и ее роль в репарации ДНК». Молекулярная клетка. 12 (5): 1087–99. Дои:10.1016 / S1097-2765 (03) 00424-6. PMID 14636569.
- ^ а б c Сенгупта С., Роблес А.И., Линке С.П., Синогеева Н.И., Чжан Р., Педе Р., Уорд И.М., Селеста А., Нуссенцвейг А., Чен Дж., Халазонетис Т.Д., Харрис С.К. (сентябрь 2004 г.). «Функциональное взаимодействие между геликазой BLM и 53BP1 в Chk1-опосредованном пути во время остановки S-фазы». Журнал клеточной биологии. 166 (6): 801–13. Дои:10.1083 / jcb.200405128. ЧВК 2172115. PMID 15364958.
- ^ Wang XW, Tseng A, Ellis NA, Spillare EA, Linke SP, Robles AI, Seker H, Yang Q, Hu P, Beresten S, Bemmels NA, Garfield S, Harris CC (август 2001 г.). «Функциональное взаимодействие p53 и ДНК-геликазы BLM при апоптозе». Журнал биологической химии. 276 (35): 32948–55. Дои:10.1074 / jbc.M103298200. PMID 11399766.
- ^ Гаркавцев И.В., Клей Н., Григорян И.А., Гудков А.В. (декабрь 2001 г.). «Белок синдрома Блума взаимодействует и взаимодействует с p53 в регуляции транскрипции и контроле роста клеток». Онкоген. 20 (57): 8276–80. Дои:10.1038 / sj.onc.1205120. PMID 11781842.
- ^ а б Ян К., Чжан Р., Ван XW, Спилларе Е.А., Линке С.П., Субраманиан Д., Гриффит Д.Д., Ли Дж.Л., Хиксон И.Д., Шен Дж.С., Леб Л.А., Мазур С.Дж., Аппелла Е, Брош Р.М., Кармакар П., Бор В.А., Харрис К.С. (Август 2002 г.). «Процессинг соединений Холлидея с помощью геликаз BLM и WRN регулируется p53». Журнал биологической химии. 277 (35): 31980–7. Дои:10.1074 / jbc.M204111200. PMID 12080066.
- ^ Абрамович С, Вернер Х (2003). «Функциональные и физические взаимодействия между BRCA1 и p53 в регуляции транскрипции гена IGF-IR». Гормоны и метаболические исследования. 35 (11–12): 758–62. Дои:10.1055 / с-2004-814154. PMID 14710355.
- ^ Оучи Т., Монтейро А.Н., Август А., Ааронсон С.А., Ханафуса Н. (март 1998 г.). «BRCA1 регулирует экспрессию p53-зависимого гена». Труды Национальной академии наук Соединенных Штатов Америки. 95 (5): 2302–6. Bibcode:1998PNAS ... 95.2302O. Дои:10.1073 / пнас.95.5.2302. ЧВК 19327. PMID 9482880.
- ^ Чай Ю.Л., Цуй Дж., Шао Н., Шьям Э., Редди П., Рао В.Н. (январь 1999 г.). «Второй домен BRCT белков BRCA1 взаимодействует с p53 и стимулирует транскрипцию с промотора p21WAF1 / CIP1». Онкоген. 18 (1): 263–8. Дои:10.1038 / sj.onc.1202323. PMID 9926942.
- ^ Чжан Х., Сомасундарам К., Пэн Й., Тиан Х., Чжан Х., Би Д., Вебер Б.Л., Эль-Дейри В.С. (апрель 1998 г.). «BRCA1 физически связывается с p53 и стимулирует его транскрипционную активность». Онкоген. 16 (13): 1713–21. Дои:10.1038 / sj.onc.1201932. PMID 9582019.
- ^ Марморштейн Л.Ю., Оучи Т., Ааронсон С.А. (ноябрь 1998 г.). «Продукт гена BRCA2 функционально взаимодействует с p53 и RAD51». Труды Национальной академии наук Соединенных Штатов Америки. 95 (23): 13869–74. Bibcode:1998ПНАС ... 9513869М. Дои:10.1073 / пнас.95.23.13869. ЧВК 24938. PMID 9811893.
- ^ Урамото Х., Изуми Х., Нагатани Г., Омори Х., Нагасуэ Н., Исе Т, Йошида Т, Ясумото К., Коно К. (апрель 2003 г.). «Физическое взаимодействие опухолевого супрессора p53 / p73 с CCAAT-связывающим фактором транскрипции 2 (CTF2) и дифференциальная регуляция экспрессии гена группы 1 высокой мобильности человека (HMG1)». Биохимический журнал. 371 (Pt 2): 301–10. Дои:10.1042 / BJ20021646. ЧВК 1223307. PMID 12534345.
- ^ а б Ли Л., Юнгман М., Диксон Дж. Э. (январь 2000 г.). «Фосфатазы Cdc14 человека взаимодействуют с белком-супрессором опухоли p53 и дефосфорилируют его». Журнал биологической химии. 275 (4): 2410–4. Дои:10.1074 / jbc.275.4.2410. PMID 10644693.
- ^ Лучани М.Г., Хатчинс Дж. Р., Желева Д., Хапп Т. Р. (июль 2000 г.). «С-концевой регуляторный домен р53 содержит функциональный сайт стыковки для циклина А». Журнал молекулярной биологии. 300 (3): 503–18. Дои:10.1006 / jmbi.2000.3830. PMID 10884347.
- ^ Ababneh M, Götz C, Montenarh M (май 2001 г.). «Подавление активности протеинкиназы cdc2 / циклин B путем связывания p53 с p34 (cdc2)». Сообщения о биохимических и биофизических исследованиях. 283 (2): 507–12. Дои:10.1006 / bbrc.2001.4792. PMID 11327730.
- ^ Abedini MR, Muller EJ, Brun J, Bergeron R, Gray DA, Tsang BK (июнь 2008 г.). «Цисплатин индуцирует р53-зависимое убиквитинирование FLICE-подобного ингибирующего белка в раковых клетках яичников». Исследования рака. 68 (12): 4511–7. Дои:10.1158 / 0008-5472.CAN-08-0673. PMID 18559494.
- ^ а б Goudelock DM, Jiang K, Pereira E, Russell B, Sanchez Y (август 2003 г.). «Регуляторные взаимодействия между киназой контрольной точки Chk1 и белками ДНК-зависимого протеинкиназного комплекса». Журнал биологической химии. 278 (32): 29940–7. Дои:10.1074 / jbc.M301765200. PMID 12756247.
- ^ Тиан Х., Фадже А.Т., Ли С.Л., Йоргенсен Т.Дж. (2002). «Радиационно-индуцированное фосфорилирование Chk1 по S345 связано с p53-зависимыми путями остановки клеточного цикла». Неоплазия. 4 (2): 171–80. Дои:10.1038 / sj.neo.7900219. ЧВК 1550321. PMID 11896572.
- ^ Zhao L, Samuels T, Winckler S, Korgaonkar C, Tompkins V, Horne MC, Quelle DE (январь 2003 г.). «Циклин G1 обладает активностью ингибирования роста, связанной с путями подавления опухоли ARF-Mdm2-p53 и pRb». Молекулярные исследования рака. 1 (3): 195–206. PMID 12556559.
- ^ а б Ито А., Кавагути Ю., Лай С.Х., Ковач Дж. Дж., Хигашимото Ю., Аппелла Е., Яо Т.П. (ноябрь 2002 г.). «MDM2-HDAC1-опосредованное деацетилирование р53 необходимо для его деградации». Журнал EMBO. 21 (22): 6236–45. Дои:10.1093 / emboj / cdf616. ЧВК 137207. PMID 12426395.
- ^ а б Ливенгуд Дж. А., Скоггин К. Э., Ван Орден К., Макбрайант С. Дж., Эдайатумангалам Р. С., Лейборн П. Дж., Нюборг Дж. К. (март 2002 г.). «Транскрипционная активность p53 опосредована через SRC1-взаимодействующий домен CBP / p300». Журнал биологической химии. 277 (11): 9054–61. Дои:10.1074 / jbc.M108870200. PMID 11782467.
- ^ а б Giebler HA, Lemasson I, Nyborg JK (июль 2000 г.). «Рекрутирование p53 CREB-связывающего белка, опосредованного фосфорилированным CREB: новый путь регуляции опухолевого супрессора». Молекулярная и клеточная биология. 20 (13): 4849–58. Дои:10.1128 / MCB.20.13.4849-4858.2000. ЧВК 85936. PMID 10848610.
- ^ а б Шнайдер Э., Монтенарх М., Вагнер П. (ноябрь 1998 г.). «Регулирование активности киназы САК с помощью р53». Онкоген. 17 (21): 2733–41. Дои:10.1038 / sj.onc.1202504. PMID 9840937.
- ^ а б Ко Л.Дж., Шие С.Ю., Чен Х, Джаяраман Л., Тамай К., Тайя Й., Привес С., Пан З. К. (декабрь 1997 г.). «p53 фосфорилируется CDK7-циклином H p36MAT1-зависимым образом». Молекулярная и клеточная биология. 17 (12): 7220–9. Дои:10.1128 / mcb.17.12.7220. ЧВК 232579. PMID 9372954.
- ^ Явузер У., Смит Г.К., Блисс Т., Вернер Д., Джексон С.П. (июль 1998 г.). «Независимая от конца ДНК активация ДНК-ПК, опосредованная посредством ассоциации с ДНК-связывающим белком C1D». Гены и развитие. 12 (14): 2188–99. Дои:10.1101 / gad.12.14.2188. ЧВК 317006. PMID 9679063.
- ^ а б Ризос Х., Дифенбах Э., Бадхвар П., Вудрафф С., Беккер TM, Руни Р.Дж., Кеффорд РФ (февраль 2003 г.). «Ассоциация p14ARF с репрессором транскрипции p120E4F усиливает ингибирование клеточного цикла». Журнал биологической химии. 278 (7): 4981–9. Дои:10.1074 / jbc.M210978200. PMID 12446718.
- ^ Сэнди П., Гостисса М., Фогал В., Секко Л.Д., Салай К., Руни Р.Дж., Шнайдер С., Дель Сал Дж. (Январь 2000 г.). «p53 участвует в задержке роста, опосредованной p120E4F». Онкоген. 19 (2): 188–99. Дои:10.1038 / sj.onc.1203250. PMID 10644996.
- ^ а б c Галлахер В.М., Аргентини М., Сьерра V, Бракко Л., Дебюше Л., Консейлер Е. (июнь 1999 г.). «MBP1: новый мутантный p53-специфический белок-партнер с онкогенными свойствами». Онкоген. 18 (24): 3608–16. Дои:10.1038 / sj.onc.1202937. PMID 10380882.
- ^ Каддихи А.Р., Вонг А.Х., Там Н.В., Ли С., Коромилас А.Е. (апрель 1999 г.). «Двухцепочечная РНК-активированная протеинкиназа PKR физически связывается с опухолевым супрессорным белком p53 и фосфорилирует человеческий p53 по серину 392 in vitro». Онкоген. 18 (17): 2690–702. Дои:10.1038 / sj.onc.1202620. PMID 10348343.
- ^ Синобу Н., Маэда Т., Асо Т., Ито Т., Кондо Т., Коике К., Хатакеяма М. (июнь 1999 г.). «Физическое взаимодействие и функциональный антагонизм между фактором элонгации РНК-полимеразы II ELL и p53». Журнал биологической химии. 274 (24): 17003–10. Дои:10.1074 / jbc.274.24.17003. PMID 10358050.
- ^ Гроссман С.Р., Перес М., Кунг А.Л., Джозеф М., Мансур К., Сяо ZX, Кумар С., Хоули П.М., Ливингстон Д.М. (октябрь 1998 г.). «Комплексы p300 / MDM2 участвуют в MDM2-опосредованной деградации p53». Молекулярная клетка. 2 (4): 405–15. Дои:10.1016 / S1097-2765 (00) 80140-9. PMID 9809062.
- ^ Ан В., Ким Дж., Родер Р. (июнь 2004 г.). «Упорядоченные кооперативные функции PRMT1, p300 и CARM1 в активации транскрипции с помощью p53». Клетка. 117 (6): 735–48. Дои:10.1016 / j.cell.2004.05.009. PMID 15186775.
- ^ Пасторчич М., Дас ХК (ноябрь 2000 г.). «Регулирование транскрипции гена пресенилина-1 человека с помощью факторов транскрипции ets и протоонкогена p53». Журнал биологической химии. 275 (45): 34938–45. Дои:10.1074 / jbc.M005411200. PMID 10942770.
- ^ а б Ван XW, Yeh H, Schaeffer L, Roy R, Moncollin V, Egly JM, Wang Z, Freidberg EC, Evans MK, Taffe BG (июнь 1995 г.). «Модуляция p53 TFIIH-ассоциированной активности эксцизионной репарации нуклеотидов». Природа Генетика. 10 (2): 188–95. Дои:10.1038 / ng0695-188. PMID 7663514. S2CID 38325851.
- ^ Ю А., Фан Х.Й., Ляо Д., Бейли А.Д., Вайнер А.М. (май 2000 г.). «Активация p53 или потеря репарационного белка группы В при синдроме Кокейна вызывает хрупкость метафазы человеческих генов U1, U2 и 5S». Молекулярная клетка. 5 (5): 801–10. Дои:10.1016 / S1097-2765 (00) 80320-2. PMID 10882116.
- ^ Цай Р. Я., Маккей Р. Д. (декабрь 2002 г.). «Ядрышковый механизм, контролирующий пролиферацию стволовых и раковых клеток». Гены и развитие. 16 (23): 2991–3003. Дои:10.1101 / gad.55671. ЧВК 187487. PMID 12464630.
- ^ Пэн Ю.К., Куо Ф., Брейдинг Д.Э., Ван Ю.Ф., Мансур С.П., Андрофи Э.Д. (сентябрь 2001 г.). «AMF1 (GPS2) модулирует трансактивацию p53». Молекулярная и клеточная биология. 21 (17): 5913–24. Дои:10.1128 / MCB.21.17.5913-5924.2001. ЧВК 87310. PMID 11486030.
- ^ Watcharasit P, Bijur GN, Zmijewski JW, Song L, Zmijewska A, Chen X, Johnson GV, Jope RS (июнь 2002 г.). «Прямое активирующее взаимодействие между киназой-3бета гликогенсинтазы и р53 после повреждения ДНК». Труды Национальной академии наук Соединенных Штатов Америки. 99 (12): 7951–5. Bibcode:2002PNAS ... 99,7951 Вт. Дои:10.1073 / pnas.122062299. ЧВК 123001. PMID 12048243.
- ^ а б Акакура С., Йошида М., Йонеда Ю., Хориноути С. (май 2001 г.). «Роль Hsc70 в регуляции ядерно-цитоплазматического транспорта чувствительного к температуре p53 (p53Val-135)». Журнал биологической химии. 276 (18): 14649–57. Дои:10.1074 / jbc.M100200200. PMID 11297531.
- ^ Ван Ц., Чен Дж. (Январь 2003 г.). «Фосфорилирование и связывание hsp90 опосредуют стабилизацию p53 тепловым шоком». Журнал биологической химии. 278 (3): 2066–71. Дои:10.1074 / jbc.M206697200. PMID 12427754.
- ^ Пэн И, Чен Л., Ли Ц, Лу В., Чен Дж. (Ноябрь 2001 г.). «Ингибирование MDM2 с помощью hsp90 способствует стабилизации мутантного p53». Журнал биологической химии. 276 (44): 40583–90. Дои:10.1074 / jbc.M102817200. PMID 11507088.
- ^ Чен Д., Ли М., Ло Дж, Гу В. (апрель 2003 г.). «Прямые взаимодействия между HIF-1 альфа и Mdm2 модулируют функцию p53». Журнал биологической химии. 278 (16): 13595–8. Дои:10.1074 / jbc.C200694200. PMID 12606552.
- ^ Рави Р., Мукерджи Б., Бхуджвалла З.М., Саттер С.Х., Артемов Д., Зенг К., Диллехей Л.Э., Мадан А., Семенца Г.Л., Беди А. (январь 2000 г.). «Регулирование опухолевого ангиогенеза посредством р53-индуцированной деградации индуцируемого гипоксией фактора 1альфа». Гены и развитие. 14 (1): 34–44. Дои:10.1101 / gad.14.1.34 (неактивно 2020-10-05). ЧВК 316350. PMID 10640274.CS1 maint: DOI неактивен по состоянию на октябрь 2020 г. (связь)
- ^ Ханссон Л.О., Фридлер А., Фройнд С., Рудигер С., Фершт А.Р. (август 2002 г.). «Два мотива последовательности из HIF-1alpha связываются с ДНК-связывающим сайтом p53». Труды Национальной академии наук Соединенных Штатов Америки. 99 (16): 10305–9. Bibcode:2002PNAS ... 9910305H. Дои:10.1073 / pnas.122347199. ЧВК 124909. PMID 12124396.
- ^ An WG, Канекал М., Саймон М.К., Малтепе Э., Благосклонный М.В., Некерс Л.М. (март 1998 г.). «Стабилизация р53 дикого типа с помощью фактора 1альфа, индуцируемого гипоксией». Природа. 392 (6674): 405–8. Bibcode:1998Натура.392..405А. Дои:10.1038/32925. PMID 9537326. S2CID 4423081.
- ^ Кондо С., Лу И, Деббас М., Лин А. В., Сарози И., Ити А., Уэйкхэм А., Туан Дж., Сарис С., Эллиотт Дж., Ма В., Бенчимол С., Лоу С. В., Мак Т.В., Тукрал С.К. (апрель 2003 г.). «Характеристика клеток и мышей, нацеленных на ген, дефицитных по р53-связывающей киназе, взаимодействующей с гомеодоменом протеинкиназы 1 (HIPK1)». Труды Национальной академии наук Соединенных Штатов Америки. 100 (9): 5431–6. Bibcode:2003ПНАС..100.5431К. Дои:10.1073 / пнас.0530308100. ЧВК 154362. PMID 12702766.
- ^ Hofmann TG, Möller A, Sirma H, Zentgraf H, Taya Y, Dröge W, Will H, Schmitz ML (январь 2002 г.). «Регулирование активности р53 путем его взаимодействия с гомеодомен-взаимодействующей протеинкиназой-2». Природа клеточной биологии. 4 (1): 1–10. Дои:10.1038 / ncb715. PMID 11740489. S2CID 37789883.
- ^ Ким Э.Дж., Пак Дж.С., Ум С.Дж. (август 2002 г.). «Идентификация и характеристика HIPK2, взаимодействующего с p73 и модулирующего функции семейства p53 in vivo». Журнал биологической химии. 277 (35): 32020–8. Дои:10.1074 / jbc.M200153200. PMID 11925430.
- ^ Имамура Т., Изуми Х., Нагатани Дж., Исэ Т., Номото М., Ивамото Ю., Коно К. (март 2001 г.). «Взаимодействие с р53 усиливает связывание модифицированной цисплатином ДНК белком группы 1 с высокой подвижностью». Журнал биологической химии. 276 (10): 7534–40. Дои:10.1074 / jbc.M008143200. PMID 11106654.
- ^ Dintilhac A, Bernués J (март 2002 г.). «HMGB1 взаимодействует со многими очевидно неродственными белками, распознавая короткие аминокислотные последовательности». Журнал биологической химии. 277 (9): 7021–8. Дои:10.1074 / jbc.M108417200. PMID 11748221.
- ^ Wadhwa R, Yaguchi T., Hasan MK, Mitsui Y, Reddel RR, Kaul SC (апрель 2002 г.). «Член семейства Hsp70, mot-2 / mthsp70 / GRP75, связывается с цитоплазматическим доменом секвестрации белка p53». Экспериментальные исследования клеток. 274 (2): 246–53. Дои:10.1006 / excr.2002.5468. PMID 11900485.
- ^ Стеффан Дж. С., Казанцев А., Спасич-Боскович О., Гринвальд М., Жу Ю. З., Гохлер Х., Ванкер Э. Э., Бейтс Г. П., Хаусман Д. Е., Томпсон Л. М. (июнь 2000 г.). «Белок болезни Хантингтона взаимодействует с p53 и CREB-связывающим белком и подавляет транскрипцию». Труды Национальной академии наук Соединенных Штатов Америки. 97 (12): 6763–8. Bibcode:2000PNAS ... 97.6763S. Дои:10.1073 / pnas.100110097. ЧВК 18731. PMID 10823891.
- ^ Леунг К.М., По Л.С., Цанг ФК, Сиу В.Й., Лау А., Хо Х.Т., Пун Р.Й. (сентябрь 2002 г.). «Кандидат в опухолевые супрессоры ING1b может стабилизировать p53, нарушая регуляцию p53 с помощью MDM2». Исследования рака. 62 (17): 4890–3. PMID 12208736.
- ^ Гаркавцев И.А., Григорян И.А., Оссовская В.С., Чернов М.В., Чумаков П.М., Гудков А.В. (январь 1998 г.). «Кандидат в супрессор опухолей p33ING1 взаимодействует с p53 в контроле роста клеток». Природа. 391 (6664): 295–8. Bibcode:1998Натура.391..295Г. Дои:10.1038/34675. PMID 9440695. S2CID 4429461.
- ^ а б Шисеки М., Нагашима М., Педе Р.М., Китахама-Шисеки М., Миура К., Окамура С., Оноги Х., Хигашимото И., Аппелла Е., Йокота Дж., Харрис К.С. (май 2003 г.) «p29ING4 и p28ING5 связываются с p53 и p300 и усиливают активность p53». Исследования рака. 63 (10): 2373–8. PMID 12750254.
- ^ Цай К.В., Цзэн Х.С., Лин В.К. (октябрь 2008 г.). «Два события сплайсинга колебания влияют на субядерную локализацию и деградацию белка ING4». Экспериментальные исследования клеток. 314 (17): 3130–41. Дои:10.1016 / j.yexcr.2008.08.002. PMID 18775696.
- ^ Чанг Н.С. (март 2002 г.). «Неанкириновый С-конец Ikappa Balpha физически взаимодействует с p53 in vivo и диссоциирует в ответ на апоптотический стресс, гипоксию, повреждение ДНК и подавление роста, опосредованное трансформирующим фактором роста бета-1». Журнал биологической химии. 277 (12): 10323–31. Дои:10.1074 / jbc.M106607200. PMID 11799106.
- ^ а б Курки С., Латонен Л., Лайхо М. (октябрь 2003 г.). «Клеточный стресс и повреждение ДНК вызывают временно разные комплексы Mdm2, p53 и PML и специфичную для повреждений ядерную релокализацию». Журнал клеточной науки. 116 (Pt 19): 3917–25. Дои:10.1242 / jcs.00714. PMID 12915590.
- ^ а б Freeman DJ, Li AG, Wei G, Li HH, Kertesz N, Lesche R, Whale AD, Martinez-Diaz H, Rozengurt N, Cardiff RD, Liu X, Wu H (февраль 2003 г.). «Опухолевый супрессор PTEN регулирует уровни и активность белка p53 посредством фосфатазозависимых и независимых механизмов». Раковая клетка. 3 (2): 117–30. Дои:10.1016 / S1535-6108 (03) 00021-7. PMID 12620407.
- ^ а б Чжан Ю., Сюн Ю., Ярбро В.Г. (март 1998 г.). «ARF способствует деградации MDM2 и стабилизирует p53: делеция локуса ARF-INK4a нарушает пути подавления опухоли Rb и p53». Клетка. 92 (6): 725–34. Дои:10.1016 / S0092-8674 (00) 81401-4. PMID 9529249.
- ^ Badciong JC, Haas AL (декабрь 2002 г.). «MdmX представляет собой убиквитинлигазу RING finger, способную синергетически усиливать убиквитинирование Mdm2». Журнал биологической химии. 277 (51): 49668–75. Дои:10.1074 / jbc.M208593200. PMID 12393902.
- ^ Шварц А., Базуин М., Деккер П., Рамос Ю. Ф., Стигенга В. Т., Меркс Дж., Ван Хэм Р. С., ван дер Хувен ван Оордт В., ван дер Эб А. Дж., Йохемсен АГ (июль 1997 г.). «Выделение и идентификация человеческого гомолога нового p53-связывающего белка Mdmx» (PDF). Геномика. 43 (1): 34–42. Дои:10.1006 / geno.1997.4775. HDL:2066/142231. PMID 9226370.
- ^ Frade R, Balbo M, Barel M (декабрь 2000 г.). «RB18A, ген которого локализован на хромосоме 17q12-q21.1, регулирует трансактивирующую активность p53 in vivo». Исследования рака. 60 (23): 6585–9. PMID 11118038.
- ^ Дране П., Барел М., Бальбо М., Фраде Р. (декабрь 1997 г.). «Идентификация RB18A, нового регуляторного белка р53 массой 205 кДа, который имеет общие антигенные и функциональные свойства с р53». Онкоген. 15 (25): 3013–24. Дои:10.1038 / sj.onc.1201492. PMID 9444950.
- ^ Ху МС, Цю В.Р., Ван Ю.П. (ноябрь 1997 г.). «JNK1, JNK2 и JNK3 представляют собой N-концевые сериновые 34 киназы p53». Онкоген. 15 (19): 2277–87. Дои:10.1038 / sj.onc.1201401. PMID 9393873.
- ^ Лин Ю., Хохлатчев А., Фигейс Д., Авруч Дж. (Декабрь 2002 г.). «Связанный со смертью белок 4 связывает MST1 и усиливает апоптоз, индуцированный MST1». Журнал биологической химии. 277 (50): 47991–8001. Дои:10.1074 / jbc.M202630200. PMID 12384512.
- ^ Таниура Х., Мацумото К., Йошикава К. (июнь 1999 г.). «Физические и функциональные взаимодействия necdin, подавляющего рост нейронов, с p53». Журнал биологической химии. 274 (23): 16242–8. Дои:10.1074 / jbc.274.23.16242. PMID 10347180.
- ^ Даниели Ю., Димитрова Д.Д., Боровец Ю.А. (август 2002 г.). «Стресс-зависимая мобилизация нуклеолина, опосредованная образованием комплекса р53-нуклеолин». Молекулярная и клеточная биология. 22 (16): 6014–22. Дои:10.1128 / MCB.22.16.6014-6022.2002. ЧВК 133981. PMID 12138209.
- ^ Colaluca IN, Tosoni D, Nuciforo P, Senic-Matuglia F, Galimberti V, Viale G, Pece S, Di Fiore PP (январь 2008 г.). «NUMB контролирует активность супрессора опухоли p53». Природа. 451 (7174): 76–80. Bibcode:2008 Натур 451 ... 76C. Дои:10.1038 / природа06412. PMID 18172499. S2CID 4431258.
- ^ а б c Чой М.К., Мовассаг М., Сиггенс Л., Вуич А., Годдард М., Санчес А., Перкинс Н., Фигг Н., Беннет М., Кэрролл Дж., Фу Р. (июнь 2010 г.). «Высокопроизводительное секвенирование идентифицирует STAT3 как ДНК-ассоциированный фактор для экспрессии гена, зависимого от p53-NF-kappaB, при сердечной недостаточности человека». Геномная медицина. 2 (6): 37. Дои:10,1186 / г 158. ЧВК 2905097. PMID 20546595.
- ^ а б Чжан Ю., Вольф Г. В., Бхат К., Джин А., Аллио Т., Буркхарт В. А., Сюн Ю. (декабрь 2003 г.). «Рибосомный белок L11 отрицательно регулирует онкопротеин MDM2 и опосредует p53-зависимый путь контрольной точки рибосомного стресса». Молекулярная и клеточная биология. 23 (23): 8902–12. Дои:10.1128 / MCB.23.23.8902-8912.2003. ЧВК 262682. PMID 14612427.
- ^ Николаев А.Ю., Ли М., Пушкаш Н., Цинь Дж, Гу В. (январь 2003 г.). «Parc: цитоплазматический якорь для p53». Клетка. 112 (1): 29–40. Дои:10.1016 / S0092-8674 (02) 01255-2. PMID 12526791.
- ^ Malanga M, Pleschke JM, Kleczkowska HE, Althaus FR (май 1998 г.). «Поли (АДФ-рибоза) связывается со специфическими доменами р53 и изменяет его функции связывания ДНК». Журнал биологической химии. 273 (19): 11839–43. Дои:10.1074 / jbc.273.19.11839. PMID 9565608.
- ^ Кахио Т., Нисида Т., Ясуда Х. (сентябрь 2001 г.). «Участие PIAS1 в сумоилировании опухолевого супрессора p53». Молекулярная клетка. 8 (3): 713–8. Дои:10.1016 / S1097-2765 (01) 00349-5. PMID 11583632.
- ^ Wulf GM, Liou YC, Ryo A, Lee SW, Lu KP (декабрь 2002 г.). «Роль Pin1 в регуляции стабильности p53 и трансактивации p21, а также контрольных точек клеточного цикла в ответ на повреждение ДНК». Журнал биологической химии. 277 (50): 47976–9. Дои:10.1074 / jbc.C200538200. PMID 12388558.
- ^ Zacchi P, Gostissa M, Uchida T, Salvagno C, Avolio F, Volinia S, Ronai Z, Blandino G, Schneider C, Del Sal G (октябрь 2002 г.). «Пролилизомераза Pin1 раскрывает механизм контроля функций p53 после генотоксических повреждений». Природа. 419 (6909): 853–7. Bibcode:2002Натура.419..853Z. Дои:10.1038 / природа01120. PMID 12397362. S2CID 4311658.
- ^ Хуанг С.М., Шенталь А.Х., Сталлкап MR (апрель 2001 г.). «Усиление р53-зависимой активации гена транскрипционным коактиватором Zac1». Онкоген. 20 (17): 2134–43. Дои:10.1038 / sj.onc.1204298. PMID 11360197.
- ^ Xie S, Wu H, Wang Q, Cogswell JP, Husain I., Conn C., Stambrook P, Jhanwar-Uniyal M, Dai W. (ноябрь 2001 г.). «Plk3 функционально связывает повреждение ДНК с остановкой клеточного цикла и апоптозом, по крайней мере частично, через путь p53». Журнал биологической химии. 276 (46): 43305–12. Дои:10.1074 / jbc.M106050200. PMID 11551930.
- ^ Бахасси Е.М., Конн С.В., Майер Д.Л., Хенниган Р.Ф., Макгоуэн С.Х., Санчес И., Стембрук П.Дж. (сентябрь 2002 г.). «Поло-подобная киназа 3 (Plk3) млекопитающих представляет собой многофункциональный белок, участвующий в путях реакции на стресс». Онкоген. 21 (43): 6633–40. Дои:10.1038 / sj.onc.1205850. PMID 12242661.
- ^ Саймонс А., Меламед-Бессудо С., Волкович Р., Сперлинг Дж., Сперлинг Р., Айзенбах Л., Роттер В. (январь 1997 г.). «PACT: клонирование и характеристика клеточного белка, связывающего p53, который взаимодействует с Rb». Онкоген. 14 (2): 145–55. Дои:10.1038 / sj.onc.1200825. PMID 9010216.
- ^ Fusaro G, Dasgupta P, Rastogi S, Joshi B, Chellappan S (ноябрь 2003 г.). «Prohibitin индуцирует транскрипционную активность p53 и выводится из ядра при апоптотической передаче сигналов». Журнал биологической химии. 278 (48): 47853–61. Дои:10.1074 / jbc.M305171200. PMID 14500729.
- ^ Фогал В., Гостисса М., Сэнди П., Закки П., Стернсдорф Т., Йенсен К., Пандольфи П.П., Уилл Х., Шнайдер С., Дель Сал Дж. (Ноябрь 2000 г.). «Регулирование активности p53 в ядерных тельцах с помощью конкретной изоформы PML». Журнал EMBO. 19 (22): 6185–95. Дои:10.1093 / emboj / 19.22.6185. ЧВК 305840. PMID 11080164.
- ^ Гуо А., Саломони П., Ло Дж., Ши А., Чжун С., Гу В., Пандольфи П. П. (октябрь 2000 г.). «Функция PML при p53-зависимом апоптозе». Природа клеточной биологии. 2 (10): 730–6. Дои:10.1038/35036365. PMID 11025664. S2CID 13480833.
- ^ а б Чжан З., Чжан Р. (март 2008 г.). «Активатор протеасомы PA28 гамма регулирует p53, усиливая его MDM2-опосредованную деградацию». Журнал EMBO. 27 (6): 852–64. Дои:10.1038 / emboj.2008.25. ЧВК 2265109. PMID 18309296.
- ^ Lim ST, Chen XL, Lim Y, Hanson DA, Vo TT, Howerton K, Larocque N, Fisher SJ, Schlaepfer DD, Ilic D (январь 2008 г.). «Ядерный FAK способствует пролиферации и выживанию клеток за счет деградации р53, усиленной FERM». Молекулярная клетка. 29 (1): 9–22. Дои:10.1016 / j.molcel.2007.11.031. ЧВК 2234035. PMID 18206965.
- ^ Берналь Дж. А., Луна Р., Эспина А., Ласаро I, Рамос-Моралес Ф, Ромеро Ф, Ариас С., Сильва А., Тортолеро М., Пинтор-Торо Дж. А. (октябрь 2002 г.). «Секурин человека взаимодействует с p53 и модулирует опосредованную p53 транскрипционную активность и апоптоз». Природа Генетика. 32 (2): 306–11. Дои:10,1038 / ng997. PMID 12355087. S2CID 1770399.
- ^ Stürzbecher HW, Donzelmann B, Henning W., Knippschild U, Buchhop S (апрель 1996 г.). «p53 напрямую связан с процессами гомологичной рекомбинации через взаимодействие белков RAD51 / RecA». Журнал EMBO. 15 (8): 1992–2002. Дои:10.1002 / j.1460-2075.1996.tb00550.x. ЧВК 450118. PMID 8617246.
- ^ Buchhop S, Gibson MK, Wang XW, Wagner P, Stürzbecher HW, Harris CC (октябрь 1997 г.). «Взаимодействие р53 с человеческим белком Rad51». Исследования нуклеиновых кислот. 25 (19): 3868–74. Дои:10.1093 / nar / 25.19.3868. ЧВК 146972. PMID 9380510.
- ^ Ленг Р.П., Лин И, Ма В., Ву Х, Леммерс Б., Чанг С., Парант Дж. М., Лозано Г., Хакем Р., Бенчимол С. (март 2003 г.). «Pirh2, p53-индуцированная убиквитин-протеиновая лигаза, способствует деградации p53». Клетка. 112 (6): 779–91. Дои:10.1016 / S0092-8674 (03) 00193-4. PMID 12654245.
- ^ Sheng Y, Laister RC, Lemak A, Wu B, Tai E, Duan S, Lukin J, Sunnerhagen M, Srisailam S, Karra M, Benchimol S, Arrowsmith CH (декабрь 2008 г.). «Молекулярные основы Pirh2-опосредованного убиквитилирования p53». Структурная и молекулярная биология природы. 15 (12): 1334–42. Дои:10.1038 / nsmb.1521. ЧВК 4075976. PMID 19043414.
- ^ нужна цитата
- ^ Романова Л.Ю., Виллерс Х., Благосклонный М.В., Пауэлл С.Н. (декабрь 2004 г.). «Взаимодействие р53 с белком репликации А опосредует подавление гомологичной рекомбинации». Онкоген. 23 (56): 9025–33. Дои:10.1038 / sj.onc.1207982. PMID 15489903.
- ^ Рива Ф., Зуко В., Винк А.А., Супино Р., Проспери Е. (декабрь 2001 г.). «УФ-индуцированный разрез ДНК и привлечение ядерного антигена пролиферирующих клеток к сайтам репарации происходит независимо от взаимодействия белка А репликации p53 в клетках дикого типа p53 и мутантных клетках карциномы яичников». Канцерогенез. 22 (12): 1971–8. Дои:10.1093 / carcin / 22.12.1971. PMID 11751427.
- ^ Лин Дж., Ян Кью, Ян З., Марковиц Дж., Уайлдер П. Т., Кэрриер Ф, Вебер Д. Д. (август 2004 г.). «Ингибирование S100B восстанавливает уровни p53 в клетках первичной злокачественной меланомы». Журнал биологической химии. 279 (32): 34071–7. Дои:10.1074 / jbc.M405419200. PMID 15178678.
- ^ а б Minty A, Dumont X, Kaghad M, Caput D (ноябрь 2000 г.). «Ковалентная модификация p73alpha с помощью SUMO-1. Двухгибридный скрининг с p73 идентифицирует новые взаимодействующие с SUMO-1 белки и мотив взаимодействия SUMO-1». Журнал биологической химии. 275 (46): 36316–23. Дои:10.1074 / jbc.M004293200. PMID 10961991.
- ^ а б Иванчук С.М., Мондал С., Рутка Ю.Т. (июнь 2008 г.). «p14ARF взаимодействует с DAXX: влияет на HDM2 и p53». Клеточный цикл. 7 (12): 1836–50. Дои:10.4161 / cc.7.12.6025. PMID 18583933.
- ^ а б Ли Д., Ким Дж. В., Со Т., Хван С. Г., Чхве Э. Дж., Чхве Дж. (Июнь 2002 г.). «Комплекс SWI / SNF взаимодействует с опухолевым супрессором р53 и необходим для активации р53-опосредованной транскрипции». Журнал биологической химии. 277 (25): 22330–7. Дои:10.1074 / jbc.M111987200. PMID 11950834.
- ^ Молодой П.Дж., Дэй ПМ, Чжоу Дж., Андрофи Э.Дж., Моррис Г.Э., Лорсон К.Л. (январь 2002 г.). «Прямое взаимодействие между белком двигательного нейрона выживания и p53 и его связь со спинальной мышечной атрофией». Журнал биологической химии. 277 (4): 2852–9. Дои:10.1074 / jbc.M108769200. PMID 11704667.
- ^ Сето Э., Ушева А., Замбетти Г. П., Моманд Дж., Хорикоши Н., Вайнманн Р., Левин А. Дж., Шенк Т. (декабрь 1992 г.). «Р53 дикого типа связывается с ТАТА-связывающим белком и подавляет транскрипцию». Труды Национальной академии наук Соединенных Штатов Америки. 89 (24): 12028–32. Bibcode:1992PNAS ... 8912028S. Дои:10.1073 / пнас.89.24.12028. ЧВК 50691. PMID 1465435.
- ^ Цвекл А, Кашанчи Ф, Брэди Дж., Пятигорский Дж. (Июнь 1999 г.). «Взаимодействие Pax-6 с ТАТА-бокс-связывающим белком и белком ретинобластомы». Исследовательская офтальмология и визуализация. 40 (7): 1343–50. PMID 10359315.
- ^ Макферсон Л.А., Локтев А.В., Вейгель Р.Дж. (ноябрь 2002 г.). «Опухолевая супрессорная активность AP2alpha, опосредованная прямым взаимодействием с p53». Журнал биологической химии. 277 (47): 45028–33. Дои:10.1074 / jbc.M208924200. PMID 12226108.
- ^ Соренсен Т.С., Гирлинг Р., Ли К.В., Ганнон Дж., Бандара Л.Р., Ла Танге Н.Б. (октябрь 1996 г.). «Функциональное взаимодействие между DP-1 и p53». Молекулярная и клеточная биология. 16 (10): 5888–95. Дои:10.1128 / mcb.16.10.5888. ЧВК 231590. PMID 8816502.
- ^ Green DR, Chipuk JE (июль 2006 г.). «p53 и метаболизм: внутри TIGAR». Клетка. 126 (1): 30–2. Дои:10.1016 / j.cell.2006.06.032. PMID 16839873.
- ^ Гоберт С., Складановски А., Ларсен А.К. (август 1999 г.). «Взаимодействие между p53 и ДНК-топоизомеразой I регулируется по-разному в клетках с диким типом и мутантным p53». Труды Национальной академии наук Соединенных Штатов Америки. 96 (18): 10355–60. Bibcode:1999PNAS ... 9610355G. Дои:10.1073 / пнас.96.18.10355. ЧВК 17892. PMID 10468612.
- ^ Мао Ю., Мель И. Р., Мюллер М. Т. (февраль 2002 г.). «Субъядерное распределение топоизомеразы I связано с продолжающейся транскрипцией и статусом p53». Труды Национальной академии наук Соединенных Штатов Америки. 99 (3): 1235–40. Bibcode:2002ПНАС ... 99.1235М. Дои:10.1073 / pnas.022631899. ЧВК 122173. PMID 11805286.
- ^ а б Коуэлл И.Г., Окороков А.Л., Каттс С.А., Пэджет К., Белл М., Милнер Дж., Остин, Калифорния (февраль 2000 г.). «Человеческие топоизомеразы IIальфа и IIбета взаимодействуют с С-концевой областью р53». Экспериментальные исследования клеток. 255 (1): 86–94. Дои:10.1006 / excr.1999.4772. PMID 10666337.
- ^ Дербиширский ди-джей, Басу Б.П., Серпелл Л.К., Джу В.С., Дате Т., Ивабучи К., Доэрти А.Дж. (июль 2002 г.). «Кристаллическая структура доменов BRCT человека 53BP1, связанных с опухолевым супрессором p53». Журнал EMBO. 21 (14): 3863–72. Дои:10.1093 / emboj / cdf383. ЧВК 126127. PMID 12110597.
- ^ Экблад С.М., Фридлер А., Вепринцев Д., Вайнберг Р.Л., Ицхаки Л.С. (март 2004 г.). «Сравнение BRCT доменов BRCA1 и 53BP1: биофизический анализ». Белковая наука. 13 (3): 617–25. Дои:10.1110 / пс. 03461404. ЧВК 2286730. PMID 14978302.
- ^ Ло К.В., Кан Х.М., Чан Л.Н., Сюй В.Г., Ван К.П., Ву З., Шэн М., Чжан М. (март 2005 г.). «Легкая цепь динеина 8 кДа связывается с p53-связывающим белком 1 и опосредует накопление ядер p53, вызванное повреждением ДНК». Журнал биологической химии. 280 (9): 8172–9. Дои:10.1074 / jbc.M411408200. PMID 15611139.
- ^ Джу В.С., Джеффри П.Д., Кантор С.Б., Финнин М.С., Ливингстон Д.М., Павлетич Н.П. (март 2002 г.). «Структура области 53BP1 BRCT, связанной с p53, и ее сравнение со структурой Brca1 BRCT». Гены и развитие. 16 (5): 583–93. Дои:10.1101 / gad.959202. ЧВК 155350. PMID 11877378.
- ^ Дербиширский ди-джей, Басу Б.П., Дате Т., Ивабучи К., Доэрти А.Дж. (октябрь 2002 г.). «Очистка, кристаллизация и предварительный рентгеновский анализ доменов BRCT человеческого 53BP1, связанных с супрессором опухоли p53». Acta Crystallographica D. 58 (Pt 10 Pt 2): 1826–9. Дои:10.1107 / S0907444902010910. PMID 12351827.
- ^ а б Ивабучи К., Бартель П.Л., Ли Б., Марраччино Р., Филдс С. (июнь 1994 г.). «Два клеточных белка, которые связываются с р53 дикого типа, но не с мутантным». Труды Национальной академии наук Соединенных Штатов Америки. 91 (13): 6098–102. Bibcode:1994PNAS ... 91.6098I. Дои:10.1073 / пнас.91.13.6098. ЧВК 44145. PMID 8016121.
- ^ Наумовский Л., Клири М.Л. (июль 1996 г.). «Связывающий р53 белок 53BP2 также взаимодействует с Bc12 и препятствует развитию клеточного цикла на уровне G2 / M». Молекулярная и клеточная биология. 16 (7): 3884–92. Дои:10.1128 / MCB.16.7.3884. ЧВК 231385. PMID 8668206.
- ^ Томасини Р., Самир А.А., Перевозчик А, Иснардон Д., Чеккинелли Б., Содду С., Малиссен Б., Дагорн Дж. К., Иованна Дж. Л., Дузетти, штат Нью-Джерси (сентябрь 2003 г.). «TP53INP1 и гомеодомен-взаимодействующая протеинкиназа-2 (HIPK2) являются партнерами в регуляции активности p53». Журнал биологической химии. 278 (39): 37722–9. Дои:10.1074 / jbc.M301979200. PMID 12851404.
- ^ Окамура С., Аракава Х., Танака Т., Наканиши Х., Нг СС, Тая Ю., Монден М., Накамура И. (июль 2001 г.). «p53DINP1, ген, индуцируемый p53, регулирует p53-зависимый апоптоз». Молекулярная клетка. 8 (1): 85–94. Дои:10.1016 / S1097-2765 (01) 00284-2. PMID 11511362.
- ^ Ли Л., Ляо Дж., Руланд Дж., Мак Т.В., Коэн С.Н. (февраль 2001 г.). «Регуляторная петля TSG101 / MDM2 модулирует деградацию MDM2 и управление обратной связью MDM2 / p53». Труды Национальной академии наук Соединенных Штатов Америки. 98 (4): 1619–24. Bibcode:2001PNAS ... 98.1619L. Дои:10.1073 / pnas.98.4.1619. ЧВК 29306. PMID 11172000.
- ^ Ляхович А., Шехар М.П. (апрель 2003 г.). «Образование супрамолекулярного комплекса между Rad6 и белками пути p53 во время реакции, вызванной повреждением ДНК». Молекулярная и клеточная биология. 23 (7): 2463–75. Дои:10.1128 / MCB.23.7.2463-2475.2003. ЧВК 150718. PMID 12640129.
- ^ Шен З, Пардингтон-Пуртимун ЧП, Комо Дж. К., Мойзис Р. К., Чен Д. Д. (октябрь 1996 г.). «Ассоциации UBE2I с белками RAD52, UBL1, p53 и RAD51 в дрожжевой двугибридной системе». Геномика. 37 (2): 183–6. Дои:10.1006 / geno.1996.0540. PMID 8921390.
- ^ Bernier-Villamor V, Sampson DA, Matunis MJ, Lima CD (февраль 2002 г.). «Структурная основа E2-опосредованной конъюгации SUMO, выявленная комплексом между убиквитин-конъюгированным ферментом Ubc9 и RanGAP1». Клетка. 108 (3): 345–56. Дои:10.1016 / S0092-8674 (02) 00630-X. PMID 11853669.
- ^ Сехат Б., Андерссон С., Гирнита Л., Ларссон О. (июль 2008 г.). «Идентификация c-Cbl как новой лигазы для рецептора инсулиноподобного фактора роста-I с различными ролями от Mdm2 в убиквитинировании рецептора и эндоцитозе». Исследования рака. 68 (14): 5669–77. Дои:10.1158 / 0008-5472.CAN-07-6364. PMID 18632619.
- ^ Song MS, Song SJ, Kim SY, Oh HJ, Lim DS (июль 2008 г.). «Супрессор опухолей RASSF1A способствует самоубиквитинизации MDM2, разрушая комплекс MDM2-DAXX-HAUSP». Журнал EMBO. 27 (13): 1863–74. Дои:10.1038 / emboj.2008.115. ЧВК 2486425. PMID 18566590.
- ^ Ян В., Дикер Д. Т., Чен Дж., Эль-Дейри В. С. (март 2008 г.). «CARP усиливают оборот p53 за счет разрушения 14-3-3 сигма и стабилизации MDM2». Клеточный цикл. 7 (5): 670–82. Дои:10.4161 / cc.7.5.5701. PMID 18382127.
- ^ Абэ Й., Ода-Сато Э., Тобиуме К., Каваути К., Тая Й., Окамото К., Орен М., Танака Н. (март 2008 г.). «Передача сигналов Hedgehog преодолевает опосредованное p53 подавление опухоли за счет активации Mdm2». Труды Национальной академии наук Соединенных Штатов Америки. 105 (12): 4838–43. Bibcode:2008ПНАС..105.4838А. Дои:10.1073 / pnas.0712216105. ЧВК 2290789. PMID 18359851.
- ^ Dohmesen C, Koeppel M, Dobbelstein M (январь 2008 г.). «Специфическое ингибирование Mdm2-опосредованного недилирования с помощью Tip60». Клеточный цикл. 7 (2): 222–31. Дои:10.4161 / cc.7.2.5185. PMID 18264029.
- ^ Ли М., Чен Д., Шило А., Ло Дж., Николаев А.Ю., Цинь Дж., Гу В. (апрель 2002 г.). «Деубиквитинирование p53 с помощью HAUSP является важным путем стабилизации p53». Природа. 416 (6881): 648–53. Bibcode:2002Натурал.416..648Л. Дои:10.1038 / природа737. PMID 11923872. S2CID 4389394.
- ^ Брош Р.М., Кармакар П., Соммерс Дж.А., Ян К., Ван XW, Спилларе Е.А., Харрис С.К., Бор В.А. (сентябрь 2001 г.). «p53 Модулирует экзонуклеазную активность белка синдрома Вернера». Журнал биологической химии. 276 (37): 35093–102. Дои:10.1074 / jbc.M103332200. PMID 11427532.
- ^ Чанг Н.С., Пратт Н., Хит Дж., Шульц Л., Слев Д., Кэри Г.Б., Зевотек Н. (февраль 2001 г.). «Индукция гиалуронидазой оксидоредуктазы, содержащей WW-домен, которая усиливает цитотоксичность фактора некроза опухоли». Журнал биологической химии. 276 (5): 3361–70. Дои:10.1074 / jbc.M007140200. PMID 11058590.
- ^ Окамото Т., Изуми Х., Имамура Т., Такано Х., Исэ Т., Учиуми Т., Кувано М., Коно К. (декабрь 2000 г.). «Прямое взаимодействие p53 с Y-бокс-связывающим белком, YB-1: механизм регуляции экспрессии генов человека». Онкоген. 19 (54): 6194–202. Дои:10.1038 / sj.onc.1204029. PMID 11175333.
- ^ Келли К.Д., Миллер К.Р., Тодд А., Келли А.Р., Таттл Р., Берберих С.Дж. (май 2010 г.). «YPEL3, p53-регулируемый ген, который вызывает клеточное старение». Исследования рака. 70 (9): 3566–75. Дои:10.1158 / 0008-5472.CAN-09-3219. ЧВК 2862112. PMID 20388804.
- ^ Уотерман MJ, Ставриди ES, Waterman JL, Halazonetis TD (июнь 1998 г.). «АТМ-зависимая активация р53 включает дефосфорилирование и ассоциацию с белками 14-3-3». Природа Генетика. 19 (2): 175–8. Дои:10.1038/542. PMID 9620776. S2CID 26600934.
- ^ Лю Дж., Гроган Л., Нау М.М., Аллегра С.Дж., Чу Э., Райт Дж.Дж. (апрель 2001 г.). «Физическое взаимодействие между p53 и геном первичного ответа Egr-1». Международный журнал онкологии. 18 (4): 863–70. Дои:10.3892 / ijo.18.4.863. PMID 11251186.
- ^ Бай Л., Торговец Дж. Л. (июль 2001 г.). «ZBP-89 способствует остановке роста за счет стабилизации p53». Молекулярная и клеточная биология. 21 (14): 4670–83. Дои:10.1128 / MCB.21.14.4670-4683.2001. ЧВК 87140. PMID 11416144.
- ^ Ямакучи М., Левенштейн CJ (март 2009 г.). «MiR-34, SIRT1 и p53: петля обратной связи». Клеточный цикл. 8 (5): 712–5. Дои:10.4161 / cc.8.5.7753. PMID 19221490.
- ^ Wang Y, Zhang J, Li J, Gui R, Nie X, Huang R. CircRNA_014511 влияет на радиочувствительность мезенхимальных стволовых клеток костного мозга путем связывания с miR-29b-2-5p. Bosn J of Basic Med Sci [Интернет]. 2019, 20 мая [цит. По 7 апреля]; 19 (2): 155-63. Доступна с: https://www.bjbms.org/ojs/index.php/bjbms/article/view/3935
внешняя ссылка
- «База знаний p53». Lane Group в Институте молекулярной и клеточной биологии (IMCB), Сингапур. Архивировано из оригинал на 2006-01-03. Получено 2008-04-06.
- GeneReviews / NCBI / NIH / UW запись о синдроме Ли-Фраумени
- ОПУХОЛЬНЫЙ БЕЛК p53 @ OMIM
- восстановление функции p53
- p53 @ Атлас генетики и цитогенетики в онкологии и гематологии.
- Ген TP53 @ GeneCards
- p53 Новости предоставлено организацией insciences
- Дэвид С. Гудсел l (1 июля 2002 г.). «Подавитель опухолей p53». Молекула месяца. Банк данных белков RCSB. Получено 2008-04-06.
- Тьерри Сусси. "Веб-сайт p53". Получено 2008-04-06.
- Трест Георгия Панцирки TP53 Группа поддержки из Великобритании для людей, страдающих синдромом Ли-Фраумени или другими заболеваниями, связанными с TP53.
- База данных соматических мутаций IARC TP53 поддерживается в МАИР, Лион, Магали Оливье
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для Human P53.
- научная анимация конформационные изменения p53 при связывании с ДНК