ТАТА-связывающий белок - TATA-binding protein
| TBP | |||||||||
|---|---|---|---|---|---|---|---|---|---|
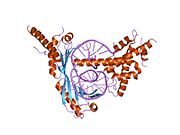
 кристаллическая структура дрожжевого тройного комплекса brf1-tbp-dna | |||||||||
| Идентификаторы | |||||||||
| Символ | TBP | ||||||||
| Pfam | PF00352 | ||||||||
| Pfam клан | CL0407 | ||||||||
| ИнтерПро | IPR000814 | ||||||||
| PROSITE | PDOC00303 | ||||||||
| SCOP2 | 1 столовая ложка / Объем / СУПФАМ | ||||||||
| |||||||||
В ТАТА-связывающий белок (TBP) это общий фактор транскрипции который связывается конкретно с ДНК последовательность называется Коробка ТАТА. Эта последовательность ДНК встречается около 30 пар оснований перед сайт начала транскрипции в некоторых эукариотический ген промоутеры.[4]
Семейство генов TBP
TBP является членом небольшого семейства генов факторов, связанных с TBP.[5] Первый фактор, связанный с ТВР (TRF / TRF1), был идентифицирован у плодовой мухи. Дрозофила, но, похоже, специфичен для мух или насекомых. Впоследствии TBPL1 / TRF2 был обнаружен в геномах многих многоклеточные животные, в то время как позвоночное животное геномы кодируют третьего члена семейства позвоночных, TBPL2 / TRF3. В определенных типах клеток или на определенных промоторах TBP может быть заменен одним из этих связанных с TBP факторов, некоторые из которых взаимодействуют с боксом TATA аналогично TBP.
Роль как фактор транскрипции
TBP - субъединица эукариотической общий фактор транскрипции TFIID. TFIID - это первый белок, связывающийся с ДНК во время образования комплекс преинициации транскрипции из РНК-полимераза II (РНК Pol II).[6] Являясь одним из немногих белков в преинициационном комплексе, который связывает ДНК специфическим для последовательности образом, он помогает позиционировать РНК-полимеразу II над сайт начала транскрипции гена. Однако, по оценкам, только 10–20% промоторов человека имеют боксы ТАТА. Следовательно, TBP, вероятно, не единственный белок, участвующий в позиционировании РНК-полимеразы II. Большинство промоутеров-людей ТАТА -меньше ген домашнего хозяйства промоутеры. Связывание TBP с этими промоторами облегчается регуляторами генов домашнего хозяйства.[7][8] Интересно, что транскрипция инициируется в узкой области примерно в 30 п.н. ниже ТАТА-бокса на ТАТА-содержащих промоторах,[9] в то время как сайты начала транскрипции промоторов без ТАТА распределены в области 200 п.н.[10][8]
Привязка TFIID к Коробка ТАТА в промоутер область гена инициирует рекрутирование других факторов, необходимых для РНК Pol II, чтобы начать транскрипцию. Некоторые из других задействованных факторов транскрипции включают: TFIIA, TFIIB, и ТФИИФ. Каждый из этих факторов транскрипции содержит несколько белковых субъединиц.
TBP также важен для транскрипции РНК-полимераза I и РНК-полимераза III, и поэтому участвует в инициации транскрипции всеми тремя РНК-полимеразами.[11]
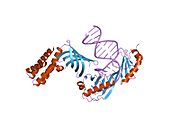
TBP участвует в Плавление ДНК (разделение двух нитей) путем сгибания ДНК на 80 ° (последовательность, богатая АТ, с которой он связывается, способствует легкому плавлению). TBP - необычный белок, который связывает малую бороздку с помощью β-листа.
Еще одна отличительная особенность ТВР - длинная цепочка глутаминов на N-конце белка. Эта область модулирует активность связывания ДНК на С-конце, а модуляция связывания ДНК влияет на скорость образования транскрипционных комплексов и инициацию транскрипции. Мутации, увеличивающие количество CAG-повторов, кодирующих этот полиглутаминовый тракт, и, таким образом, увеличивают длину полиглутаминовой нити, связаны с спиноцеребеллярная атаксия 17, а нейродегенеративное расстройство классифицируется как полиглутаминовая болезнь.[12]
ДНК-белковые взаимодействия
Когда TBP связывается с Коробка ТАТА в пределах ДНК, он искажает ДНК, вставляя боковые цепи аминокислот между парами оснований, частично раскручивая спираль и дважды изгибая ее. Искажение достигается за счет большого количества поверхностного контакта между белком и ДНК. TBP связывается с отрицательно заряженными фосфатами в основной цепи ДНК через положительно заряженные лизин и аргинин аминокислотные остатки. Резкий изгиб ДНК создается проекцией четырех громоздких фенилаланин остатки в малую бороздку. По мере изгиба ДНК ее контакт с ТВР увеличивается, тем самым усиливая взаимодействие ДНК-белок.
Напряжение, наложенное на ДНК в результате этого взаимодействия, вызывает плавление или разделение цепей. Поскольку этот участок ДНК богат аденин и тимин остатки, пары оснований которых проходят только через два водородные связи, нити ДНК легче разделяются. Разделение двух прядей обнажает основания и позволяет РНК-полимераза II начать транскрипцию ген.
C-конец TBP имеет геликоидальную форму, которая (не полностью) дополняет область T-A-T-A ДНК. Эта неполнота позволяет ДНК пассивно склоняться к связыванию.
Для получения информации об использовании TBP в клетках см .: РНК-полимераза I, РНК-полимераза II, и РНК-полимераза III.
Белковые взаимодействия
Было показано, что ТАТА-связывающий белок взаимодействовать с:
- BRF1,[13][14]
- BTAF1,[15][16]
- C-Fos,[17]
- C-июн,[18]
- EDF1,[19][20][21]
- GTF2B (TFIIB),[22][23]
- GTF2A1 (TFIIA субъединица 1),[22][24][25][26]
- GTF2F1 (ТФИИФ субъединица 1)[15][27][28]
- GTF2H4 (TFIIH субъединица 4),[15]
- Mdm2,[29][30]
- MSX1,[31][32][33]
- NFYB,[34]
- P53,[35][36]
- PAX6,[36]
- POLR2A,[15]
- POU2F1,[37]
- РЕЛА,[38][39]
- NR2B1,[40]
- TAF1,[34][41][42][43]
- TAF4,[44]
- TAF5,[34][42][45]
- TAF6,[34][42][44]
- TAF7,[34][44]
- TAF9.[34][46]
- TAF10,[34][42]
- TAF11,[34][47][48]
- TAF13,[47] и
- TAF15.[49]
Комплексная сборка
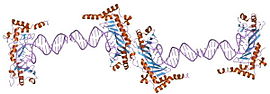
ТАТА-бокс привязка белок (TBP) требуется для инициации транскрипция РНК полимеразы I, II и III, из промоутеры с коробкой TATA или без нее.[50][51] В присутствии промотора, не содержащего TATA, TBP связывается с помощью TBP-ассоциированных факторов (TAF).[52][53] TBP ассоциируется с множеством факторов, включая общие факторы транскрипции TFIIA, -B, -D, -E и -H, чтобы сформировать огромные многосубъединичные преинициативные комплексы на ядре промоутер. Через его связь с разными транскрипция факторы, ТБП может инициировать транскрипция из разных РНК полимеразы. Есть несколько связанных TBP, в том числе TBP-подобных (TBPL) белки.[54]
Структура
С-концевое ядро ТВР (~ 180 остатков) - это очень консервативный и содержит две 88-аминокислотные повторяет которые производят седлообразную структура это охватывает ДНК; этот регион связывает в ящик ТАТА и взаимодействует с факторы транскрипции и регулирующий белки .[55] Напротив, N-концевой участок различается как по длине, так и по длине. последовательность.
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000112592 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Корнберг Р.Д. (2007). «Молекулярные основы эукариотической транскрипции». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 104 (32): 12955–61. Bibcode:2007ПНАС..10412955К. Дои:10.1073 / pnas.0704138104. ЧВК 1941834. PMID 17670940.
- ^ Ахтар В., Винстра Г.Дж. (1 января 2011 г.). «Факторы, связанные с ТВР: парадигма разнообразия в инициации транскрипции». Cell & Bioscience. 1 (1): 23. Дои:10.1186/2045-3701-1-23. ЧВК 3142196. PMID 21711503.
- ^ Ли Т.И., Янг Р.А. (2000). «Транскрипция генов, кодирующих эукариотические белки». Ежегодный обзор генетики. 34: 77–137. Дои:10.1146 / annurev.genet.34.1.77. PMID 11092823.
- ^ Лам KC, Mühlpfordt F, Vaquerizas JM, Raja SJ, Holz H, Luscombe NM, Manke T., Akhtar A (2012). «Комплекс NSL регулирует гены домашнего хозяйства у дрозофилы». PLOS Genetics. 8 (6): e1002736. Дои:10.1371 / journal.pgen.1002736. ЧВК 3375229. PMID 22723752.
- ^ а б Лам К.К., Чунг Х.Р., Семплицио Г., Айер С.С., Гауб А., Бхардвадж В., Хольц Х., Георгиев П., Ахтар А. (февраль 2019 г.). «Нуклеосомный ландшафт, опосредованный комплексом NSL, необходим для поддержания точности транскрипции и подавления транскрипционного шума». Гены и развитие. 33 (7–8): 452–465. Дои:10.1101 / gad.321489.118. ЧВК 6446542. PMID 30819819.
- ^ Карнинчи П., Санделин А., Ленхард Б., Катаяма С., Симокава К., Понявич Дж. И др. (Июнь 2006 г.). «Полногеномный анализ архитектуры и эволюции промоторов млекопитающих». Природа Генетика. 38 (6): 626–35. Дои:10.1038 / ng1789. PMID 16645617. S2CID 22205897.
- ^ Ni T, Corcoran DL, Rach EA, Song S, Spana EP, Gao Y, Ohler U, Zhu J (июль 2010 г.). «Стратегия парного секвенирования для картирования сложного ландшафта инициации транскрипции». Природные методы. 7 (7): 521–7. Дои:10.1038 / nmeth.1464. ЧВК 3197272. PMID 20495556.
- ^ Ваннини А., Крамер П. (февраль 2012 г.). «Сохранение между механизмами инициации транскрипции РНК-полимеразы I, II и III». Молекулярная клетка. 45 (4): 439–46. Дои:10.1016 / j.molcel.2012.01.023. PMID 22365827.
- ^ «Ген Entrez: TBP TATA бокс-связывающий белок».
- ^ Маккаллох В., Хардин П., Пенг В., Рупперт Дж. М., Лобо-Рупперт С. М. (август 2000 г.). «Альтернативно сплайсированные варианты hBRF функционируют на различных промоторах РНК-полимеразы III». EMBO J. 19 (15): 4134–43. Дои:10.1093 / emboj / 19.15.4134. ЧВК 306597. PMID 10921893.
- ^ Ван З., Родер Р. (июль 1995 г.). «Структура и функция субъединицы человеческого фактора транскрипции TFIIIB, которая является эволюционно консервативной и содержит домены, связанные как с TFIIB, так и с белком 2 группы высокой подвижности». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 92 (15): 7026–30. Bibcode:1995PNAS ... 92,7026 Вт. Дои:10.1073 / пнас.92.15.7026. ЧВК 41464. PMID 7624363.
- ^ а б c d Скалли Р., Андерсон С.Ф., Чао Д.М., Вей В., Е Л., Янг Р.А., Ливингстон Д.М., Парвин Д.Д. (май 1997 г.). «BRCA1 является компонентом холофермента РНК-полимеразы II». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 94 (11): 5605–10. Bibcode:1997PNAS ... 94.5605S. Дои:10.1073 / пнас.94.11.5605. ЧВК 20825. PMID 9159119.
- ^ Чикка Дж. Дж., Обле Д. Т., Пью Б. Ф. (март 1998 г.). «Клонирование и биохимическая характеристика TAF-172, человеческого гомолога дрожжевого Mot1». Мол. Клетка. Биол. 18 (3): 1701–10. Дои:10.1128 / MCB.18.3.1701. ЧВК 108885. PMID 9488487.
- ^ Мец Р., Баннистер А. Дж., Сазерленд Дж. А., Хагемайер С., О'Рурк Е. К., Кук А., Браво Р., Кузаридес Т. (сентябрь 1994 г.). «c-Fos-индуцированная активация промотора, содержащего ТАТА-бокс, включает прямой контакт со связывающим ТАТА-бокс белком». Мол. Клетка. Биол. 14 (9): 6021–9. Дои:10.1128 / MCB.14.9.6021. ЧВК 359128. PMID 8065335.
- ^ Франклин СС, Маккалок А.В., Крафт А.С. (февраль 1995 г.). «Связь in vitro между семейством белков Jun и общими факторами транскрипции, TBP и TFIIB». Biochem. J. 305 (3): 967–74. Дои:10.1042 / bj3050967. ЧВК 1136352. PMID 7848298.
- ^ Брендель С., Гельман Л., Ауверкс Дж. (Июнь 2002 г.). «Мультибелковый мостиковый фактор-1 (MBF-1) является кофактором ядерных рецепторов, регулирующих метаболизм липидов». Мол. Эндокринол. 16 (6): 1367–77. Дои:10.1210 / исправление.16.6.0843. PMID 12040021.
- ^ Мариотти М., Де Бенедиктис Л., Эйвон Е., Майер Дж. А. (август 2000 г.). «Взаимодействие между фактором-1, связанным с дифференцировкой эндотелия, и кальмодулином in vitro и in vivo». J. Biol. Chem. 275 (31): 24047–51. Дои:10.1074 / jbc.M001928200. PMID 10816571.
- ^ Кабэ Й, Гото М., Шима Д., Имаи Т., Вада Т., Морохаши Ки, Сиракава М., Хиросе С., Ханда Х (ноябрь 1999 г.). «Роль человеческого MBF1 как транскрипционного коактиватора». J. Biol. Chem. 274 (48): 34196–202. Дои:10.1074 / jbc.274.48.34196. PMID 10567391.
- ^ а б Тан Х, Сунь Х, Рейнберг Д., Ebright RH (Февраль 1996 г.). «Белковые взаимодействия в инициации эукариотической транскрипции: структура преинициативного комплекса». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 93 (3): 1119–24. Bibcode:1996PNAS ... 93.1119T. Дои:10.1073 / pnas.93.3.1119. ЧВК 40041. PMID 8577725.CS1 maint: использует параметр авторов (связь)
- ^ Бушнелл Д.А., Вестовер К.Д., Дэвис Р.Э., Корнберг Р.Д. (февраль 2004 г.). «Структурная основа транскрипции: сокристалл РНК-полимеразы II-TFIIB на 4,5 Ангстрема». Наука. 303 (5660): 983–8. Bibcode:2004Наука ... 303..983B. Дои:10.1126 / science.1090838. PMID 14963322. S2CID 36598301.
- ^ ДеДжонг Дж., Бернштейн Р., Рёдер Р.Г. (апрель 1995 г.). «Общий фактор транскрипции человека TFIIA: характеристика кДНК, кодирующей малую субъединицу, и потребность в базовой и активированной транскрипции». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 92 (8): 3313–7. Bibcode:1995PNAS ... 92.3313D. Дои:10.1073 / pnas.92.8.3313. ЧВК 42156. PMID 7724559.
- ^ Озер Дж., Мицурас К., Зерби Д., Кэри М., Либерман П.М. (июнь 1998 г.). «Фактор транскрипции IIA дерепрессирует фактор, связанный с ТАТА-связывающим белком (ТВР), ингибирование связывания ТВР-ДНК». J. Biol. Chem. 273 (23): 14293–300. Дои:10.1074 / jbc.273.23.14293. PMID 9603936.
- ^ Сан X, Ма Д., Шелдон М., Йунг К., Рейнберг Д. (октябрь 1994 г.). «Восстановление активности TFIIA человека из рекомбинантных полипептидов: роль в TFIID-опосредованной транскрипции». Genes Dev. 8 (19): 2336–48. Дои:10.1101 / gad.8.19.2336. PMID 7958900.
- ^ Ruppert S, Tjian R (ноябрь 1995 г.). «Человеческий TAFII250 взаимодействует с RAP74: последствия для инициации РНК-полимеразы II». Genes Dev. 9 (22): 2747–55. Дои:10.1101 / gad.9.22.2747. PMID 7590250.
- ^ Малик С., Гермах М., Рёдер Р.Г. (март 1998 г.). «Динамическая модель коактиваторной функции PC4 в транскрипции РНК-полимеразы II». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 95 (5): 2192–7. Bibcode:1998ПНАС ... 95.2192М. Дои:10.1073 / пнас.95.5.2192. ЧВК 19292. PMID 9482861.
- ^ Тут CJ, Goodrich JA, Tjian R (август 1997). «Репрессия р53-опосредованной транскрипции с помощью MDM2: двойной механизм». Genes Dev. 11 (15): 1974–86. Дои:10.1101 / гад.11.15.1974. ЧВК 316412. PMID 9271120.
- ^ Левейяр Т., Василик Б. (декабрь 1997 г.). «С-концевой участок MDM2 связывается с TAFII250 и необходим для регуляции MDM2 промотора циклина А». J. Biol. Chem. 272 (49): 30651–61. Дои:10.1074 / jbc.272.49.30651. PMID 9388200.
- ^ Шетти С., Такахаши Т., Мацуи Х., Айенгар Р., Рагоу Р. (май 1999 г.). «Транскрипционная авторепрессия гена Msx1 опосредуется взаимодействиями белка Msx1 с мультибелковым транскрипционным комплексом, содержащим ТАТА-связывающий белок, Sp1 и белок-связывающий белок, связывающий элемент цАМФ (CBP / p300)». Biochem. J. 339 (3): 751–8. Дои:10.1042/0264-6021:3390751. ЧВК 1220213. PMID 10215616.
- ^ Чжан Х., Ху Дж., Ван Х., Шаволино П., Илер Н., Шен М.М., Абатэ-Шен С. (май 1997 г.). «Гетеродимеризация гомеопротеинов Msx и Dlx приводит к функциональному антагонизму». Мол. Клетка. Биол. 17 (5): 2920–32. Дои:10.1128 / mcb.17.5.2920. ЧВК 232144. PMID 9111364.
- ^ Чжан Х., Катрон К.М., Абатэ-Шен С. (март 1996 г.). «Роль гомеодомена Msx-1 в регуляции транскрипции: остатки в N-концевом плече опосредуют взаимодействие связывающего ТАТА белка и репрессию транскрипции». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 93 (5): 1764–9. Bibcode:1996PNAS ... 93.1764Z. Дои:10.1073 / пнас.93.5.1764. ЧВК 39855. PMID 8700832.
- ^ а б c d е ж грамм час Беллорини М., Ли Д.К., Дантонель Дж.С., Земзуми К., Рёдер Р.Г., Тора Л., Мантовани Р. (июнь 1997 г.). «CCAAT, связывающий взаимодействия NF-Y-TBP: NF-YB и NF-YC требуют коротких доменов, соседних с их гистоновыми складчатыми мотивами для ассоциации с основными остатками TBP». Нуклеиновые кислоты Res. 25 (11): 2174–81. Дои:10.1093 / nar / 25.11.2174. ЧВК 146709. PMID 9153318.
- ^ Сето Е., Ушева А., Замбетти Г. П., Моманд Дж., Хорикоши Н., Вайнманн Р., Левин А. Дж., Шенк Т. (декабрь 1992 г.). «Р53 дикого типа связывается с ТАТА-связывающим белком и подавляет транскрипцию». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 89 (24): 12028–32. Bibcode:1992PNAS ... 8912028S. Дои:10.1073 / пнас.89.24.12028. ЧВК 50691. PMID 1465435.
- ^ а б Цвекл А, Кашанчи Ф, Брэди Дж., Пятигорский Дж. (Июнь 1999 г.). «Взаимодействие Pax-6 с ТАТА-бокс-связывающим белком и белком ретинобластомы». Вкладывать деньги. Офтальмол. Vis. Наука. 40 (7): 1343–50. PMID 10359315.
- ^ Цвиллинг С., Аннвейлер А., Вирт Т. (май 1994 г.). «Домены POU транскрипционных факторов Oct1 и Oct2 опосредуют специфическое взаимодействие с TBP». Нуклеиновые кислоты Res. 22 (9): 1655–62. Дои:10.1093 / nar / 22.9.1655. ЧВК 308045. PMID 8202368.
- ^ Гермах М., Малик С., Рёдер Р.Г. (июнь 1998 г.). «Участие компонентов TFIID и USA в транскрипционной активации промотора вируса иммунодефицита человека с помощью NF-kappaB и Sp1». Мол. Клетка. Биол. 18 (6): 3234–44. Дои:10.1128 / mcb.18.6.3234. ЧВК 108905. PMID 9584164.
- ^ Schmitz ML, Stelzer G, Altmann H, Meisterernst M, Baeuerle PA (март 1995). «Взаимодействие COOH-концевого домена трансактивации p65 NF-kappa B с TATA-связывающим белком, фактором транскрипции IIB и коактиваторами». J. Biol. Chem. 270 (13): 7219–26. Дои:10.1074 / jbc.270.13.7219. PMID 7706261.
- ^ Шульман И.Г., Чакраварти Д., Джугилон Х., Ромо А., Эванс Р.М. (август 1995 г.). «Взаимодействие между ретиноидным рецептором X и консервативной областью ТАТА-связывающего белка опосредует гормонозависимую трансактивацию». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 92 (18): 8288–92. Bibcode:1995PNAS ... 92.8288S. Дои:10.1073 / пнас.92.18.8288. ЧВК 41142. PMID 7667283.
- ^ Зигерт Дж. Л., Роббинс П. Д. (январь 1999 г.). «Rb ингибирует внутреннюю киназную активность TATA-связывающего белка фактора TAFII250». Мол. Клетка. Биол. 19 (1): 846–54. Дои:10.1128 / MCB.19.1.846. ЧВК 83941. PMID 9858607.
- ^ а б c d Ruppert S, Wang EH, Tjian R (март 1993 г.). «Клонирование и экспрессия человеческого TAFII250: TBP-ассоциированный фактор, участвующий в регуляции клеточного цикла». Природа. 362 (6416): 175–9. Bibcode:1993Натура.362..175р. Дои:10.1038 / 362175a0. PMID 7680771. S2CID 4364676.
- ^ О'Брайен Т., Тьян Р. (май 1998 г.). «Функциональный анализ N-концевого домена киназы TAFII250 человека». Мол. Клетка. 1 (6): 905–11. Дои:10.1016 / S1097-2765 (00) 80089-1. PMID 9660973.
- ^ а б c Pointud JC, Mengus G, Brancorsini S, Monaco L, Parvinen M, Sassone-Corsi P, Davidson I (май 2003 г.). «Внутриклеточная локализация TAF7L, паралогии субъединицы TAF7 фактора транскрипции TFIID, онтогенетически регулируется во время дифференцировки мужских половых клеток». J. Cell Sci. 116 (Pt 9): 1847–58. Дои:10.1242 / jcs.00391. PMID 12665565.
- ^ Тао Й, Гермах М., Мартинес Э., Ольгешлегер Т., Хасегава С., Такада Р., Ямамото Т., Хорикоши М., Рёдер Р. Г. (март 1997 г.). «Специфические взаимодействия и потенциальные функции человеческого TAFII100». J. Biol. Chem. 272 (10): 6714–21. Дои:10.1074 / jbc.272.10.6714. PMID 9045704.
- ^ Мартинес Э., Палхан В.Б., Тьернберг А., Лимар Э.С., Гампер А.М., Кунду Т.К., Чайт Б.Т., Рёдер Р.Г. (октябрь 2001 г.). «Комплекс STAGA человека представляет собой коактиватор транскрипции, ацетилирующий хроматин, который взаимодействует с факторами сплайсинга пре-мРНК и факторами связывания повреждений ДНК in vivo». Мол. Клетка. Биол. 21 (20): 6782–95. Дои:10.1128 / MCB.21.20.6782-6795.2001. ЧВК 99856. PMID 11564863.
- ^ а б Mengus G, May M, Jacq X, Staub A, Tora L, Chambon P, Davidson I. (апрель 1995 г.). «Клонирование и характеристика hTAFII18, hTAFII20 и hTAFII28: трех субъединиц человеческого фактора транскрипции TFIID». EMBO J. 14 (7): 1520–31. Дои:10.1002 / j.1460-2075.1995.tb07138.x. ЧВК 398239. PMID 7729427.
- ^ Мэй М., Менгус Дж., Лавин А.С., Шамбон П., Дэвидсон И. (июнь 1996 г.). «Человеческий TAF (II28) способствует стимуляции транскрипции за счет активации функции 2 ретиноидных рецепторов X». EMBO J. 15 (12): 3093–104. Дои:10.1002 / j.1460-2075.1996.tb00672.x. ЧВК 450252. PMID 8670810.
- ^ Хоффманн А., Рёдер Р.Г. (июль 1996 г.). «Клонирование и характеристика человеческого TAF20 / 15. Множественные взаимодействия предполагают центральную роль в образовании комплекса TFIID». J. Biol. Chem. 271 (30): 18194–202. Дои:10.1074 / jbc.271.30.18194. PMID 8663456.
- ^ Hochheimer A, Tjian R (июнь 2003 г.). «Разнообразные комплексы инициации транскрипции увеличивают селективность промотора и тканеспецифическую экспрессию генов». Гены и развитие. 17 (11): 1309–20. Дои:10.1101 / gad.1099903. PMID 12782648.
- ^ Пью Б.Ф. (сентябрь 2000 г.). «Контроль экспрессии генов посредством регуляции ТАТА-связывающего белка». Ген. 255 (1): 1–14. Дои:10.1016 / s0378-1119 (00) 00288-2. PMID 10974559.
- ^ 1942-, Уивер, Роберт Франклин (1 января 2012 г.). Молекулярная биология. Макгроу-Хилл. ISBN 9780073525327. OCLC 789601172.CS1 maint: числовые имена: список авторов (связь)
- ^ Louder RK, He Y, López-Blanco JR, Fang J, Chacón P, Nogales E (март 2016 г.). «Структура TFIID, связанного с промотором, и модель сборки преинициативного комплекса человека». Природа. 531 (7596): 604–9. Bibcode:2016Натура.531..604L. Дои:10.1038 / природа17394. ЧВК 4856295. PMID 27007846.
- ^ Дэвидсон I (июль 2003 г.). «Генетика ТВР и факторов, связанных с ТВР». Тенденции в биохимических науках. 28 (7): 391–8. Дои:10.1016 / S0968-0004 (03) 00117-8. PMID 12878007.
- ^ Николов Д.Б., Ху Ш., Лин Дж., Гаш А., Хоффманн А., Хорикоши М., Чуа Н.Х., Рёдер Р.Г., Берли С.К. (ноябрь 1992 г.). «Кристаллическая структура связывающего белка TFIID TATA-бокса». Природа. 360 (6399): 40–6. Bibcode:1992Натура.360 ... 40Н. Дои:10.1038 / 360040a0. PMID 1436073. S2CID 4307043.
внешняя ссылка
- GeneReviews / NCBI / NIH / UW запись о спиноцеребеллярной атаксии 17 типа
- Интерактивная структура TBP на massey.ac.nz
- PDB Молекула месяца ТАТА-связывающий белок
- ТАТА-бокс + связывание + белок в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- FactorBook TBP
- Обзор всей структурной информации, доступной в PDB за UniProt: P20226 (Человеческий ТАТА-бокс-связывающий белок) на PDBe-KB.