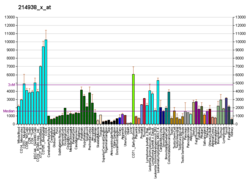
HMGB1 - HMGB1
Бокс группы высокой мобильности 1 белок, также известный как белок группы высокой подвижности 1 (HMG-1) и амфотерин, это белок что у людей кодируется HMGB1 ген.[3][4]
HMG-1 принадлежит к группа высокой мобильности и содержит HMG-коробка домен.
Функция
Словно гистоны, HMGB1 является одним из наиболее важных белков хроматина. в ядро HMGB1 взаимодействует с нуклеосомы, факторы транскрипции и гистоны.[5] Этот ядерный белок организует ДНК и регулирует транскрипцию.[6] После связывания HMGB1 гнется[7] ДНК, что облегчает связывание других белков. HMGB1 поддерживает транскрипцию многих генов во взаимодействии со многими факторами транскрипции. Он также взаимодействует с нуклеосомами, ослабляя упакованную ДНК и модифицируя хроматин. Контакт с коровыми гистонами изменяет структуру нуклеосом.
Присутствие HMGB1 в ядре зависит от посттрансляционных модификаций. Когда белок не ацетилирован, он остается в ядре, но гиперацетилирование остатков лизина заставляет его перемещаться в цитозоль.[6]
Было показано, что HMGB1 играет важную роль в помощи Эндонуклеаза RAG образуют парный комплекс во время V (D) J рекомбинация.[8]
Роль в воспалении
HMGB1 секретируется иммунными клетками (например, макрофаги, моноциты и дендритные клетки ) через секреторный путь без лидера.[6] Активированные макрофаги и моноциты секретируют HMGB1 в виде цитокин посредник Воспаление.[9] Антитела, нейтрализующие HMGB1, обеспечивают защиту от повреждения и повреждения тканей во время артрит, колит, ишемия, сепсис, эндотоксемия и системная красная волчанка.[нужна цитата ] Механизм воспаления и повреждения состоит из связывания с TLR2 и TLR4, который опосредует HMGB1-зависимую активацию высвобождения цитокинов макрофагами. Это позиционирует HMGB1 на пересечении стерильных и инфекционных воспалительных реакций.[10][11]
АДФ-рибозилирование HMGB1 по PARP1 препятствует удалению апоптотический клетки, тем самым поддерживая воспаление.[12] Связывание TLR4 с помощью HMGB1 или LPS (липополисахарид ) поддерживает ADP-рибозилирование HMGB1 с помощью PARP1, тем самым служа петлей амплификации для воспаления.[12]
HMGB1 был предложен в качестве ДНК-вакцина адъювант.[13] Было продемонстрировано, что HMGB1, высвобождаемый из опухолевых клеток, опосредует противоопухолевые иммунные ответы путем активации передачи сигналов Toll-подобного рецептора 2 (TLR2) на полученных из костного мозга GBM-инфильтрирующих DC.[14]
Взаимодействия
HMGB1 должен взаимодействовать с P53.[15][16]
HMGB1 - это ядерный белок, который связывается с ДНК и действует как архитектурный фактор связывания хроматина. Он также может высвобождаться из клеток, в внеклеточной форме которых он может связывать воспалительный рецептор. ЯРОСТЬ (Рецептор для конечных продуктов гликирования) и Toll-подобные рецепторы (TLR). Выделение из клеток, по-видимому, связано с двумя различными процессами: некрозом, когда клеточные мембраны становятся проницаемыми, и внутриклеточные компоненты могут диффундировать из клетки; и некоторая форма активной или облегченной секреции, вызванной передачей сигналов через NF-κB. HMGB1 также перемещается в цитозоль в стрессовых условиях, таких как повышенное содержание АФК внутри клеток. В таких условиях HMGB1 способствует выживанию клеток, поддерживая аутофагию за счет взаимодействия с беклином-1. Он в значительной степени считается антиапоптотическим белком.
HMGB1 может взаимодействовать с лигандами и цитокинами TLR и активирует клетки через множество поверхностных рецепторов, включая TLR2, TLR4, и RAGE.[17]
Взаимодействие через TLR4
Некоторые действия HMGB1 опосредуются через толл-подобные рецепторы (TLR).[18] Взаимодействие между HMGB1 и TLR4 приводит к усилению регуляции NF-κB, что приводит к увеличению производства и выпуска цитокины. HMGB1 также может взаимодействовать с TLR4 на нейтрофилы стимулировать производство активные формы кислорода НАДФН-оксидазой.[6][19] Комплекс HMGB1-LPS активирует TLR4 и вызывает связывание адаптерных белков (MyD88 и др.), Что приводит к преобразование сигнала и активация различных сигнальных каскадов. Последующий эффект этой передачи сигналов заключается в активации MAPK и NF-κB, и, таким образом, вызывают продукцию воспалительных молекул, таких как цитокины.[20][21]
Клиническое значение
HMGB1 был предложен в качестве мишени для лечения рака,[22] и как вектор для уменьшения воспаления от SARS-CoV-2 инфекционное заболевание. [23]
В нейродегенеративный болезнь спиноцеребеллярная атаксия 1 типа (SCA1) вызвано мутация в атаксин 1 ген. В модели SCA1 на мышах мутантный белок атаксин 1 опосредовал снижение или ингибирование HMGB1 в митохондрии из нейроны.[24] HMGB1 регулирует ДНК архитектурные изменения, необходимые для ремонта Повреждение ДНК. В модели мыши SCA1 сверхэкспрессия белка HMGB1 с помощью введенного вирусного вектора, несущего ген HMGB1, способствовала репарации повреждений митохондриальной ДНК, уменьшала невропатология и двигательные дефекты мышей SCA1, а также увеличили продолжительность их жизни.[24] Таким образом, нарушение функции HMGB1, по-видимому, играет ключевую роль в патогенезе SCA1.
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000189403 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Ferrari S, Finelli P, Rocchi M, Bianchi ME (июль 1996 г.). «Активный ген, который кодирует белок группы 1 высокой подвижности человека (HMG1), содержит интроны и отображается на хромосоме 13». Геномика. 35 (2): 367–71. Дои:10.1006 / geno.1996.0369. PMID 8661151.
- ^ Chou DK, Evans JE, Jungalwala FB (апрель 2001 г.). «Идентичность ядерного белка группы высокой подвижности, HMG-1, и сульфоглюкуронил-углевод-связывающего белка, SBP-1, в мозге». Журнал нейрохимии. 77 (1): 120–31. Дои:10.1046 / j.1471-4159.2001.t01-1-00209.x. PMID 11279268.
- ^ Bianchi ME, Agresti A (октябрь 2005 г.). «Белки HMG: динамические игроки в регуляции и дифференцировке генов». Текущее мнение в области генетики и развития. 15 (5): 496–506. Дои:10.1016 / j.gde.2005.08.007. PMID 16102963.
- ^ а б c d Klune JR, Dhupar R, Cardinal J, Billiar TR, Tsung A (2008). «HMGB1: сигнализация эндогенной опасности». Молекулярная медицина. 14 (7–8): 476–84. Дои:10.2119 / 2008-00034.Klune. ЧВК 2323334. PMID 18431461.
- ^ Murugesapillai D, McCauley MJ, Maher LJ, Williams MC (февраль 2017 г.). «Одномолекулярные исследования белков, изгибающих архитектурную ДНК группы B с высокой подвижностью». Биофизические обзоры. 9 (1): 17–40. Дои:10.1007 / s12551-016-0236-4. ЧВК 5331113. PMID 28303166.
- ^ Чуботару М., Трекслер А.Дж., Спиридон Л.Н., Surleac MD, Роадес Э., Петреску А.Дж., Шац Д.Г. (февраль 2013 г.). «RAG и HMGB1 создают большой изгиб в 23RSS в рекомбинационных синаптических комплексах V (D) J». Исследования нуклеиновых кислот. 41 (4): 2437–54. Дои:10.1093 / нар / гкс1294. ЧВК 3575807. PMID 23293004.
- ^ Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, Frazier A, Yang H, Ivanova S, Borovikova L, Manogue KR, Faist E, Abraham E, Andersson J, Andersson U, Molina PE, Abumrad NN , Сама А., Трейси К.Дж. (июль 1999 г.). «HMG-1 как поздний медиатор летальности эндотоксина у мышей». Наука. 285 (5425): 248–51. Дои:10.1126 / science.285.5425.248. PMID 10398600.
- ^ Ян Х., Хреггвидсдоттир Х.С., Палмблад К., Ван Х., Очани М., Ли Дж., Лу Б., Чаван С., Росас-Баллина М., Аль-Абед Ю., Акира С., Бирхаус А., Эрландссон-Харрис Х, Андерссон Ю., Трейси К. Дж. (Июнь 2010 г.). «Критический цистеин необходим для связывания HMGB1 с Toll-подобным рецептором 4 и активации высвобождения цитокинов макрофагами». Труды Национальной академии наук Соединенных Штатов Америки. 107 (26): 11942–7. Bibcode:2010PNAS..10711942Y. Дои:10.1073 / pnas.1003893107. ЧВК 2900689. PMID 20547845.
- ^ Ян Х, Трейси К.Дж. (2010). «Нацеливание на HMGB1 при воспалении». Biochimica et Biophysica Acta (BBA) - механизмы регуляции генов. 1799 (1–2): 149–56. Дои:10.1016 / j.bbagrm.2009.11.019. ЧВК 4533842. PMID 19948257.
- ^ а б Паццалья С, Пиоли С (2019). «Многогранная роль PARP-1 в репарации ДНК и воспалении: патологические и терапевтические последствия при раке и нераковых заболеваниях». Клетки. 9 (1): 41. Дои:10.3390 / ячейки9010041. ЧВК 7017201. PMID 31877876.
- ^ Fagone P, Shedlock DJ, Bao H, Kawalekar OU, Yan J, Gupta D, Morrow MP, Patel A, Kobinger GP, Muthumani K, Weiner DB (ноябрь 2011 г.). «Молекулярный адъювант HMGB1 усиливает противогриппозный иммунитет во время ДНК-вакцинации». Генная терапия. 18 (11): 1070–7. Дои:10.1038 / gt.2011.59. ЧВК 4141626. PMID 21544096.
- ^ Curtin JF, Liu N, Candolfi M, Xiong W, Assi H, Yagiz K, Edwards MR, Michelsen KS, Kroeger KM, Liu C, Muhammad AK, Clark MC, Arditi M, Comin-Anduix B, Ribas A, Lowenstein PR, Кастро М.Г. (январь 2009 г.). «HMGB1 опосредует активацию эндогенного TLR2 и регрессию опухоли головного мозга». PLOS Медицина. 6 (1): e10. Дои:10.1371 / journal.pmed.1000010. ЧВК 2621261. PMID 19143470.
- ^ Имамура Т., Изуми Х., Нагатани Дж., Исэ Т., Номото М., Ивамото Ю., Коно К. (март 2001 г.). «Взаимодействие с р53 усиливает связывание модифицированной цисплатином ДНК белком группы 1 с высокой подвижностью». Журнал биологической химии. 276 (10): 7534–40. Дои:10.1074 / jbc.M008143200. PMID 11106654.
- ^ Dintilhac A, Bernués J (март 2002 г.). «HMGB1 взаимодействует со многими очевидно неродственными белками, распознавая короткие аминокислотные последовательности». Журнал биологической химии. 277 (9): 7021–8. Дои:10.1074 / jbc.M108417200. PMID 11748221.
- ^ Sims GP, Rowe DC, Rietdijk ST, Herbst R, Coyle AJ (2010). «HMGB1 и RAGE при воспалении и раке». Ежегодный обзор иммунологии. 28: 367–88. Дои:10.1146 / annurev.immunol.021908.132603. PMID 20192808.
- ^ Ибрагим З.А., Armor CL, Фиппс С., Суккар МБ (декабрь 2013 г.). «RAGE и TLR: родственники, друзья или соседи?». Молекулярная иммунология. 56 (4): 739–44. Дои:10.1016 / j.molimm.2013.07.008. PMID 23954397.
- ^ Park JS, Gamboni-Robertson F, He Q, Svetkauskaite D, Kim JY, Strassheim D, Sohn JW, Yamada S, Maruyama I, Banerjee A, Ishizaka A, Abraham E (март 2006 г.). «Белок коробки 1 с высокой подвижностью взаимодействует с множеством Toll-подобных рецепторов». Американский журнал физиологии. Клеточная физиология. 290 (3): C917-24. Дои:10.1152 / ajpcell.00401.2005. PMID 16267105.
- ^ Bianchi ME (сентябрь 2009 г.). «HMGB1 любит компанию». Журнал биологии лейкоцитов. 86 (3): 573–6. Дои:10.1189 / jlb.1008585. PMID 19414536.
- ^ Hreggvidsdóttir HS, Lundberg AM, Aveberger AC, Klevenvall L, Andersson U, Harris HE (март 2012 г.). «Комплексы белок 1 группы с высокой подвижностью (HMGB1) - молекула-партнер усиливают продукцию цитокинов за счет передачи сигналов через рецептор молекулы-партнера». Молекулярная медицина. 18 (2): 224–30. Дои:10.2119 / молмед.2011.00327. ЧВК 3320135. PMID 22076468.
- ^ Лотце М.Т., ДеМарко Р.А. (декабрь 2003 г.). «Работа со смертью: HMGB1 как новая мишень для лечения рака». Текущее мнение об исследуемых лекарствах. 4 (12): 1405–9. PMID 14763124.
- ^ Андерссон Ю., Оттестад В., Трейси К. (2020). «Внеклеточный HMGB1: терапевтическая мишень при тяжелом воспалении легких, включая COVID-19?». Молекулярная медицина. 26 (1): 42. Дои:10.1186 / s10020-020-00172-4. ЧВК 7203545. PMID 32380958.
- ^ а б Ито Х, Фудзита К., Тагава К., Чен Х, Хомма Х, Сасабэ Т., Симидзу Дж., Симидзу С., Тамура Т., Мурамацу С., Окадзава Х (январь 2015 г.). «HMGB1 способствует восстановлению повреждений митохондриальной ДНК и увеличивает продолжительность жизни мышей с мутантным атаксином-1». EMBO Молекулярная медицина. 7 (1): 78–101. Дои:10.15252 / emmm.201404392. ЧВК 4309669. PMID 25510912.
дальнейшее чтение
- Томас Дж. О., Трэверс А. А. (март 2001 г.). «HMG1 и 2 и родственные« архитектурные »ДНК-связывающие белки». Тенденции в биохимических науках. 26 (3): 167–74. Дои:10.1016 / S0968-0004 (01) 01801-1. PMID 11246022.
- Андерссон У., Эрландссон-Харрис Х, Ян Х., Трейси К.Дж. (декабрь 2002 г.). «HMGB1 как ДНК-связывающий цитокин». Журнал биологии лейкоцитов. 72 (6): 1084–91. PMID 12488489.
- Wu H, Wu T, Hua W, Dong X, Gao Y, Zhao X, Chen W, Cao W, Yang Q, Qi J, Zhou J, Wang J (март 2015 г.). «Мизопростол, агонист рецептора PGE2, защищает мозг от внутримозгового кровоизлияния у мышей». Нейробиология старения. 36 (3): 1439–50. Дои:10.1016 / j.neurobiolaging.2014.12.029. ЧВК 4417504. PMID 25623334.
- Эрландссон Харрис Х, Андерссон Ю (июнь 2004 г.). «Мини-обзор: ядерный белок HMGB1 как провоспалительный медиатор». Европейский журнал иммунологии. 34 (6): 1503–12. Дои:10.1002 / eji.200424916. PMID 15162419.
- Цзян В., Писецкий Д.С. (январь 2007 г.). «Механизмы заболевания: роль белка 1 группы высокой подвижности в патогенезе воспалительного артрита». Природа Клиническая практика. Ревматология. 3 (1): 52–8. Дои:10.1038 / ncprheum0379. PMID 17203009. S2CID 428632.
- Эллерман Дж. Э., Браун С. К., де Вера М., Зе Х. Дж., Биллиар Т., Рубартелли А., Лотце М. Т. (май 2007 г.). «Маскарад: группа высокой мобильности. Коробка-1 и рак». Клинические исследования рака. 13 (10): 2836–48. Дои:10.1158 / 1078-0432.CCR-06-1953. PMID 17504981.
- Фоссати С., Кьяруги А. (2007). «Актуальность белкового бокса 1 группы высокой подвижности для нейродегенерации». Международный обзор нейробиологии. 82: 137–48. Дои:10.1016 / S0074-7742 (07) 82007-1. ISBN 9780123739896. PMID 17678959.
- Парккинен Дж, Раувала Х (сентябрь 1991 г.). «Взаимодействие плазминогена и тканевого активатора плазминогена (t-PA) с амфотерином. Усиление активации плазминогена, катализируемой t-PA, амфотерином». Журнал биологической химии. 266 (25): 16730–5. PMID 1909331.
- Вен Л., Хуанг Дж. К., Джонсон Б. Х., Рик Г. Р. (февраль 1989 г.). «Клон кДНК плаценты человека, который кодирует негистоновый хромосомный белок HMG-1». Исследования нуклеиновых кислот. 17 (3): 1197–214. Дои:10.1093 / nar / 17.3.1197. ЧВК 331735. PMID 2922262.
- Бернуес Дж., Эспель Э., Кероль Э. (май 1986 г.). «Идентификация основных связывающих гистонов доменов HMG1 и HMG2». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия гена. 866 (4): 242–51. Дои:10.1016/0167-4781(86)90049-7. PMID 3697355.
- Ge H, Roeder RG (июнь 1994 г.). «Белок группы высокой подвижности HMG1 может обратимо ингибировать транскрипцию гена класса II за счет взаимодействия с ТАТА-связывающим белком». Журнал биологической химии. 269 (25): 17136–40. PMID 8006019.
- Парккинен Дж., Рауло Э., Меренмиес Дж., Ноло Р., Каяндер Э. О., Бауманн М., Раувала Х. (сентябрь 1993 г.). «Амфотерин, белок 30 кДа в семействе полипептидов HMG1-типа. Повышенная экспрессия в трансформированных клетках, передняя локализация и взаимодействия с активацией плазминогена». Журнал биологической химии. 268 (26): 19726–38. PMID 8366113.
- Заппавинья В., Фальциола Л., Хельмер-Читтерих М., Мавилио Ф., Бьянки М.Э. (сентябрь 1996 г.). «HMG1 взаимодействует с белками HOX и усиливает их связывание с ДНК и активацию транскрипции». Журнал EMBO. 15 (18): 4981–91. Дои:10.1002 / j.1460-2075.1996.tb00878.x. ЧВК 452236. PMID 8890171.
- Xiang YY, Wang DY, Tanaka M, Suzuki M, Kiyokawa E, Igarashi H, Naito Y, Shen Q, Sugimura H (февраль 1997 г.). «Экспрессия мРНК группы 1 с высокой подвижностью в аденокарциноме желудочно-кишечного тракта человека и соответствующей незлокачественной слизистой оболочке». Международный журнал рака. 74 (1): 1–6. Дои:10.1002 / (SICI) 1097-0215 (19970220) 74: 1 <1 :: AID-IJC1> 3.0.CO; 2-6. PMID 9036861.
- Расмуссен Р.К., Джи Х., Эддес Дж.С., Мориц Р.Л., Рид Г.Е., Симпсон Р.Дж., Доров Д.С. (1997). «Двумерный электрофоретический анализ белков карциномы молочной железы человека: картирование белков, которые связываются с доменом SH3 киназы смешанного происхождения MLK2». Электрофорез. 18 (3–4): 588–98. Дои:10.1002 / elps.1150180342. PMID 9150946.
- Джаяраман Л., Мурти Н. С., Мурти К. Г., Мэнли Д. Л., Бастин М., Привес С. (февраль 1998 г.). «Белок группы высокой подвижности-1 (HMG-1) является уникальным активатором р53». Гены и развитие. 12 (4): 462–72. Дои:10.1101 / gad.12.4.462. ЧВК 316524. PMID 9472015.
- Милев П., Чиба А., Херинг М., Раувала Х., Шахнер М., Ранчт Б., Марголис Р.К., Марголис РУ (март 1998 г.). «Связывание с высоким сродством и перекрывающаяся локализация нейрокана и фосфакана / протеин-тирозинфосфатазы-дзета / бета с тенасцином-R, амфотерином и гепарин-связывающей молекулой, связанной с ростом». Журнал биологической химии. 273 (12): 6998–7005. Дои:10.1074 / jbc.273.12.6998. PMID 9507007.
- Нагаки С., Ямамото М., Юмото Ю., Сиракава Х., Йошида М., Тераока Х. (май 1998 г.). «Негистоновые хромосомные белки HMG1 и 2 усиливают реакцию лигирования двухцепочечных разрывов ДНК». Сообщения о биохимических и биофизических исследованиях. 246 (1): 137–41. Дои:10.1006 / bbrc.1998.8589. PMID 9600082.
- Клаудио Дж. О., Лью С. К., Демпси А. А., Цукерман Е., Стюарт А. К., На Е., Аткинс Г. Л., Исков Н. Н., Хоули Р. Г. (май 1998 г.). «Идентификация меченых последовательностью транскриптов, дифференциально экспрессируемых в гемопоэтической иерархии человека». Геномика. 50 (1): 44–52. Дои:10.1006 / geno.1998.5308. PMID 9628821.
- Буняратанакорнкит В., Мелвин В., Прендергаст П., Альтманн М., Ронфани Л., Бьянки М.Э., Тарасевичене Л., Нордин С.К., Аллегретто Е.А., Эдвардс Д.П. (август 1998 г.). «Белки хроматина 1 и 2 группы с высокой подвижностью функционально взаимодействуют с рецепторами стероидных гормонов для усиления их связывания с ДНК in vitro и транскрипционной активности в клетках млекопитающих». Молекулярная и клеточная биология. 18 (8): 4471–87. Дои:10.1128 / mcb.18.8.4471. ЧВК 109033. PMID 9671457.
- Wu H, Wu T, Han X, Wan J, Jiang C, Chen W, Lu H, Yang Q, Wang J (январь 2017 г.). «Церебропротекция нейрональным рецептором PGE2 EP2 после внутримозгового кровоизлияния у мышей среднего возраста». Журнал церебрального кровотока и метаболизма. 37 (1): 39–51. Дои:10.1177 / 0271678X15625351. ЧВК 5363749. PMID 26746866.
- Цзяо И, Ван ХК, Фань СДж (декабрь 2007 г.). «Подавление роста и повышение радиочувствительности с помощью HMGB1 при раке груди». Acta Pharmacologica Sinica. 28 (12): 1957–67. Дои:10.1111 / j.1745-7254.2007.00669.x. PMID 18031610.
- Андерссон Ю., Оттестад В., Трейси К.Дж. (май 2020 г.). «Внеклеточный HMGB1: терапевтическая мишень при тяжелом воспалении легких, включая COVID-19?». Мол Мед. 26 (1): 42(2020). Дои:10.1186 / с10020-020-00172-4. ЧВК 7203545. PMID 32380958.
внешняя ссылка
- HMGB1 + белок, + человеческий в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Исследование рака поджелудочной железы и сигнальный путь HMGB1
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для человеческого белка B1 группы высокой мобильности (HMGB1)
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для белка B1 группы высокой подвижности крыс (HMGB1)