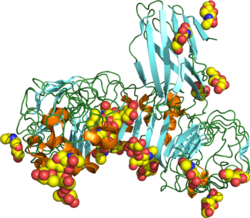
TLR4 - TLR4
Толл-подобный рецептор 4 это белок что у людей кодируется TLR4 ген. TLR4 трансмембранный белок, член толл-подобный рецептор семья, которая принадлежит рецептор распознавания образов (PRR) семья. Его активация приводит к внутриклеточному сигнальному пути. NF-κB и производство воспалительных цитокинов, которые отвечают за активацию врожденная иммунная система.[4]
Он наиболее известен тем, что распознает липополисахарид (LPS), компонент, присутствующий во многих Грамотрицательные бактерии (например. Neisseria spp.) и выберите Грамположительные бактерии. Его лиганды также включают несколько вирусных белков, полисахарид и множество эндогенных белков, таких как липопротеин низкой плотности, бета-дефенсины и белок теплового шока.[5]
TLR4 также был обозначен как CD284 (кластер дифференциации 284). Молекулярная масса TLR4 составляет примерно 95 кДа.
Функция
TLR4 является членом толл-подобный рецептор (TLR), которое играет фундаментальную роль в распознавании патогенов и активации врожденный иммунитет. Они распознают молекулярные паттерны, связанные с патогенами (PAMPs ), которые экспрессируются на инфекционных агентах и опосредуют производство цитокины необходим для выработки эффективного иммунитета. TLR высоко консервативны от растений к Дрозофила с людьми и имеют структурное и функциональное сходство.
Различные TLR демонстрируют разные паттерны экспрессии. Этот рецептор наиболее широко экспрессируется в плацента, И в миеломоноцитарный субпопуляция лейкоциты.
Сотрудничает с LY96 (также называемый MD-2) и CD14 посредничать в преобразование сигнала события, вызванные липополисахарид (LPS)[6] найдено в большинстве грамотрицательные бактерии. Мутации в этом гене были связаны с различиями в чувствительности LPS.
Передача сигналов TLR4 отвечает на сигналы, образуя комплекс с использованием внеклеточного богатый лейцином повторяющийся домен (LRR) и внутриклеточный толл / рецептор интерлейкина-1 (TIR) домен. Стимуляция LPS вызывает серию взаимодействий с несколькими дополнительными белками, которые образуют комплекс TLR4 на поверхности клетки. Распознавание LPS инициируется связыванием LPS с Белок LBP. Этот комплекс LPS-LBP передает LPS в CD14. CD14 представляет собой заякоренный гликозилфосфатидилинозитол мембранный белок, который связывает комплекс LPS-LBP и облегчает перенос LPS в Белок MD-2, который связан с внеклеточным доменом TLR4. Связывание LPS способствует димеризации TLR4 / MD-2. Конформационные изменения TLR4 вызывают рекрутирование внутриклеточных адаптерных белков, содержащих домен TIR, который необходим для активации нижестоящего сигнального пути.[7]
Было обнаружено несколько вариантов транскрипта этого гена, но потенциал большинства из них в отношении кодирования белков остается неопределенным.[8]
Большинство описанных эффектов передачи сигналов TLR4 в опухолях являются проканцерогенными, главным образом из-за вклада передачи сигналов провоспалительных цитокинов (экспрессия которых обеспечивается TLR-опосредованными сигналами) в стимулирующее опухоль микроокружение.[9]
Сигнализация
При узнавании LPS конформационные изменения в рецепторах TLR4 приводят к рекрутированию внутриклеточных TIR-доменов, содержащих адапторные молекулы. Эти адаптеры связаны с кластером TLR4 посредством гомофильных взаимодействий между доменами TIR. Четыре адапторных белка участвуют в двух основных внутриклеточных сигнальных путях.[10]

MyD88 - Зависимый путь
MyD88-зависимый путь регулируется двумя адаптор-ассоциированными белками: геном первичного ответа миелоидной дифференцировки 88 (MyD88 ) и TIR-домен-содержащий адаптерный белок (TIRAP ). TIRAP-MyD88 регулирует раннее NF-κβ активация и производство провоспалительные цитокины, например ИЛ-12.[4] Передача сигналов MyD88 включает активацию киназ, ассоциированных с рецептором IL-1 (ИРАК ) и адаптерных молекул фактора 6, ассоциированного с рецептором TNF (TRAF6 ). TRAF6 вызывает активацию TAK1 (Трансформирующая β-активированная киназа 1 фактора роста), которая приводит к активации Каскады MAPK (Митоген-активированная протеинкиназа) и ИКК (IκB киназа). Сигнальный путь IKKs приводит к индукции фактора транскрипции NF-κB, а активация каскадов MAPK приводит к активации другого фактора транскрипции АП-1. Оба они играют роль в экспрессии провоспалительных цитокинов.[7] Активация NF-κB через TAK-1 сложна и начинается со сборки белкового комплекса, называемого сигналосома, который состоит из каркасного белка, называемого НЕМО. Белковый комплекс состоит из двух разных киназ κB, называемых IKKα и IKKβ. Это вызывает добавление небольшого регуляторного белка к сигнаносому, называемого убиквитин, который действует, чтобы инициировать высвобождение белка NF-κB, который координирует транслокацию в ядре цитокинов.[11]
MyD88 - Независимый путь
Этот TRIF-зависимый путь включает рекрутирование адаптерных белков, содержащих TIR-домен, адаптер, индуцирующий интерферон-β (TRIF ) и связанной с TRIF молекулой адаптера (TRAM). Сигналы TRAM-TRIF активируют фактор транскрипции Interferon Regulatory Factor-3 (IRF3 ) через TRAF3. Активация IRF3 индуцирует продукцию интерфероны 1 типа.[10]
SARM: отрицательный регулятор пути, опосредованного TRIF
Пятый адаптерный белок, содержащий TIR-домен, названный Sterile α и HEAT (Armadillo motif) (SARM), является ингибитором сигнального пути TLR4. Активация SARM за счет связывания LPS ингибирует -TRIF-опосредованные пути, но не ингибирует MyD88-опосредованные пути. Этот механизм предотвращает чрезмерную активацию в ответ на LPS, которая может привести к повреждению, вызванному воспалением, например: сепсис.[7]
Эволюционная история
TLR4 возник, когда TLR2 и TLR4 разошлись примерно 500 миллионов лет назад, в начале эволюции позвоночных.[12] Выравнивание последовательностей экзонов TLR4 человека и человекообразных обезьян продемонстрировало, что с момента нашего расхождения с нашим последним общим предком с шимпанзе произошло не так много эволюции в TLR4 человека; Экзоны TLR4 человека и шимпанзе различаются только тремя заменами, в то время как люди и павианы на 93,5% похожи во внеклеточном домене.[13] Примечательно, что люди обладают большим количеством ранних стоп-кодонов в TLR4, чем человекообразные обезьяны; в исследовании 158 человек во всем мире 0,6% имели бессмысленные мутации.[14][15] Это говорит о том, что существует более слабое эволюционное давление на человеческий TLR4, чем на наших родственников приматов. Распределение полиморфизмов TLR4 человека соответствует миграции из Африки, и вполне вероятно, что полиморфизмы возникли в Африке до миграции на другие континенты.[15][16]
Взаимодействия
Было показано, что TLR4 взаимодействовать с:
Внутриклеточный трафик TLR4 зависит от GTPase Раб-11а, а отключение Rab-11a приводит к затрудненному привлечению TLR4 к Кишечная палочка-содержащие фагосомы и последующее снижение передачи сигнала через MyD88-независимый путь.[25]
Клиническое значение
Были идентифицированы различные однонуклеотидные полиморфизмы (SNP) TLR4 у людей.[26] и у некоторых из них связь с повышенной восприимчивостью к грамотрицательным бактериальным инфекциям. [27] сообщалось о более быстром прогрессировании и более тяжелом течении сепсиса у пациентов в критическом состоянии.[28]
При инсулинорезистентности
Фетуин-А облегчает связывание липидов с рецепторами, тем самым вызывая резистентность к инсулину.[29]
При прогрессировании рака
Экспрессия TLR4 может быть обнаружена на многих опухолевых клетках и клеточных линиях. TLR4 способен активировать MAPK и NF-κB пути, предполагающие возможную прямую роль автономной клеточно-автономной передачи сигналов TLR4 в регуляции канцерогенеза, в частности, за счет повышенной пролиферации опухолевых клеток, апоптоз торможение и метастаз. Передача сигналов TLR4 также может способствовать устойчивости к паклитаксел химиотерапия в рак яичников и миРНК терапия в рак простаты. 63% от рак молочной железы сообщалось, что пациенты экспрессировали TLR4 на опухолевых клетках, и уровень экспрессии обратно коррелировал с выживаемостью. Кроме того, низкий MyD88 экспрессия коррелировала с уменьшением метастазов в легкие и уменьшалась CCL2 и CCL5 выражение. Уровни экспрессии TLR4 были самыми высокими среди TLR в клеточной линии рака груди человека. MDA-MB-231 и нокдаун TLR4 приводил к снижению пролиферации и уменьшению Ил-6 и Ил-8 уровни. С другой стороны, передача сигналов TLR4 в иммунных и воспалительных клетках микросреда опухоли может привести к выработке провоспалительных цитокинов (TNF, ИЛ-1β, Ил-6, Ил-18 и др.), иммуносупрессивные цитокины (Ил-10, TGF-β и др.) и ангиогенных медиаторов (VEGF, EGF, TGF-β и др.).
Эти действия могут привести к дальнейшей поляризации опухолевые макрофаги, преобразование фибробласты в опухолевые фибробласты, связанные с раком, превращение дендритных клеток в опухоль-ассоциированные ДК и активация проканкогенных функций незрелых миелоидных клеток - Клетки-супрессоры миелоидного происхождения (MDSC). Передача сигналов TLR связана с накоплением и функцией MDSC в месте опухоли, а также позволяет мезенхимальным стромальным клеткам противодействовать NK клетка -опосредованный противоопухолевый иммунитет. В клетках гепатобластомы HepG2 LPS увеличивал уровни TLR4, распространение клеток и сопротивление химиотерапия, и эти явления можно было бы обратить вспять с помощью TLR4 нокдаун генов. Аналогичным образом, стимуляция LPS линии клеток рака печени человека H7402 приводила к усилению регуляции TLR4, активации NF-κB, продукции TNF, IL-6 и IL-8 и увеличению пролиферации, которая могла быть обращена преобразованием сигнала и STAT3 торможение. Помимо успешного использования Бацилла Кальметта – Герена в терапии Рак мочевого пузыря есть сообщения о лечении орального плоскоклеточная карцинома, рак желудка и рак шейки матки с лиофилизированным стрептококковым препаратом ОК-432 и использованием TLR4 /TLR2 лиганды - производные мурамиловый дипептид.[9]
При беременности
Активация TLR4 при внутриутробных инфекциях приводит к нарушению регуляции синтеза простагландинов, что приводит к сокращению гладкой мускулатуры матки.
Полиморфизм Asp299Gly
Классически TLR4 считается рецептором для LPS Однако было показано, что TLR4 активируется другими видами липидов. Плазмодий falciparum, паразит, вызывающий наиболее частую и серьезную форму малярия что в основном наблюдается в Африке, производит гликозилфосфатидилинозитол, который может активировать TLR4.[30] Два SNP в TLR4 коэкспрессируются с высоким пенетрантность в африканских популяциях (например, TLR-4-Asp299Gly и TLR-4-Thr399Ile). Эти полиморфизмы связаны с увеличением TLR4-опосредованного Ил-10 продукции - иммуномодулятора - и снижение провоспалительные цитокины.[31] Точечная мутация TLR-4-Asp299Gly сильно коррелирует с повышенным уровнем инфицирования Плазмодий falciparum. Похоже, что мутация препятствует тому, чтобы TLR4 действовал столь же энергично, по крайней мере, против некоторых плазмодийных инфекций. В малярия Уровень инфицирования и связанная с этим заболеваемость выше в группе TLR-4-Asp299Gly, но смертность, по-видимому, снижается. Это может указывать на то, что по крайней мере часть патогенеза малярия использует производство цитокинов. За счет снижения выработки цитокинов через мутацию TLR4 уровень инфицирования может увеличиваться, но количество смертей из-за инфекции, по-видимому, уменьшается.[30]
Кроме того, TLR4-D299G был связан с агрессивным колоректальным раком у людей. Было показано, что аденокарциномы толстой кишки человека от пациентов с TLR4-D299G чаще были на поздней стадии с метастазами, чем с TLR4 дикого типа. То же исследование функционально продемонстрировало, что кишечные эпителиальные клетки (Caco-2), экспрессирующие TLR4-D299G, претерпели эпителиально-мезенхимальный переход и морфологические изменения, связанные с прогрессированием опухоли, тогда как кишечные эпителиальные клетки, экспрессирующие TLR4 дикого типа, этого не сделали.[32]
полиморфизм rs7873784
Однонуклеотидный полиморфизм rs7873784, расположенный в 3'-нетранслируемая область (3'-UTR) гена TLR4 и связан с развитием нескольких патологий, таких как ревматоидный артрит и сахарный диабет 2 типа. PU.1 связывание с минорным аллелем C rs7873784 может быть ответственным за повышенную экспрессию TLR4 в моноциты пораженных людей, способствуя созданию предрасположенной к воспалению среды, которая предрасполагает носителей минорных аллелей к развитию определенных патологий с воспалительный компонент.[33] Интересно, что минорный аллель C rs7873784 был связан со снижением риска нескольких типов воспалительных заболеваний, опосредованных микробами, что согласуется с представлением о том, что TLR4 участвует в гомеостатическое поддержание из микробиота. Нарушение кровь[необходимо разрешение неоднозначности ]-предстательная железа или же кишечный барьеры из-за недостаточной передачи сигналов TLR4, по-видимому, являются одним из триггеров микробиологической туморогенез. Повышенная экспрессия TLR4, связанная с минорным аллелем rs7873784 (C), в этом контексте может быть полезной для благоприятного прогноза в соответствующих случаях. рак пациенты. Аналогичные соображения можно применить к TLR4-опосредованной регуляции микробиоты в случае хронический пародонтит где снижение риска прогрессирования также было связано с вариантом rs7873784 (C). TLR4 признание микобактериальный клеточная стенка компонентов и термолабильного растворимого микобактериального фактора, участвующих в инициации врожденные ответы против туберкулез может связывать полиморфизм TLR4 с модуляцией чувствительности к туберкулезу.[33]
Исследования на животных
Связь между рецептором TLR4 и запой было предложено. Когда гены, ответственные за экспрессию TLR4 и ГАМК рецепторами манипулируют у грызунов, которые были выращены и обучены чрезмерно пить, животные показали «глубокое снижение» питьевого поведения.[34] Кроме того, было показано, что этанол, даже в отсутствие LPS, может активировать сигнальные пути TLR4.[35]
Высокий уровень молекул TLR4 и M2 опухолевые макрофаги связаны с повышенной восприимчивостью к росту рака у лишенных сна мышей. Мыши, генетически модифицированные так, чтобы они не могли продуцировать молекулы TLR4, показали нормальный рост рака.[36]
Препараты против TLR4
Было показано, что толл-подобный рецептор 4 важен для долгосрочных побочных эффектов опиоид обезболивающее наркотики. Разные μ-опиоид рецептор лиганды были протестированы, и было обнаружено, что они также обладают действием в качестве агонистов или антагонистов TLR4 с опиоидными агонистами, такими как (+) -морфий являются агонистами TLR4, тогда как антагонисты опиоидов, такие как налоксон, оказались антагонистами TLR4. Активация TLR4 приводит к высвобождению модуляторов воспаления, включая TNF-α и Интерлейкин-1, и считается, что постоянное низкоуровневое высвобождение этих модуляторов со временем снижает эффективность лечения опиоидными препаратами и участвует как в развитии толерантность к опиоидным анальгетикам,[37][38] и при появлении таких побочных эффектов, как гипералгезия и аллодиния это может стать проблемой после длительного употребления опиоидных препаратов.[39][40] Было показано, что препараты, блокирующие действие TNF-α или IL-1β, усиливают анальгетический эффект опиоидов и снижают развитие толерантности и других побочных эффектов.[41][42] и это также было продемонстрировано с лекарствами, которые блокируют сам TLR4.
Было обнаружено, что реакция TLR4 на опиоидные препараты энантиомер -независимые, поэтому «неестественные» энантиомеры опиоидных препаратов, таких как морфин и налоксон, которые лишены сродства к опиоидным рецепторам, по-прежнему производят ту же активность в отношении TLR4, что и их «нормальные» энантиомеры.[43][44] Это означает, что неестественные энантиомеры опиоидных антагонистов, такие как (+) - налоксон, можно использовать для блокирования активности TLR4 опиоидных анальгетиков, не влияя на анальгетическую активность, опосредованную μ-опиоидными рецепторами.[45][44][46] Это также может быть механизмом положительного эффекта налтрексона в сверхмалых дозах на опиоидную анальгезию.[47]
Морфий причины воспаление путем связывания с белком лимфоцитарный антиген 96, что, в свою очередь, заставляет белок связываться с Toll-подобным рецептором 4 (TLR4).[48] Активация TLR4, индуцированная морфином, ослабляет боль подавление опиоиды и усиливает выработку опиоидов толерантность и зависимость, злоупотребление наркотиками, и другие негативные побочные эффекты, такие как угнетение дыхания и гипералгезия. Лекарства-кандидаты, нацеленные на TLR4, могут улучшить лечение опиоидов контроль над болью терапии.[49]
Агонисты
- Глюкуроноксиломаннан из Криптококк[54][55]
- Морфин-3-глюкуронид (неактивен в отношении опиоидных рецепторов, поэтому селективен для активации TLR4)[40][50]
- Тапентадол (комбинированный полный агонист μ-опиоидных рецепторов и ингибитор обратного захвата норэпинефрина)
- «Неестественные» изомеры, такие как (+) - морфин, активируют TLR4, но не обладают активностью опиоидных рецепторов,[43] хотя (+) - морфин также проявляет активность как сигма рецептор агонист.[56]
Антагонисты
- В липид А аналог эриторанец действует как антагонист TLR4. По состоянию на декабрь 2009 г.[Обновить], он разрабатывался как лекарство от тяжелых сепсис.[57] Однако в 2013 году в новостях говорилось, что результаты борьбы с сепсисом несколько разочаровывают и что его лучше использовать для лечения некоторых случаев тяжелого гриппа. Хотя он не лечит сам вирус, его можно использовать против массивной иммунной реакции, называемой цитокиновый шторм который часто возникает на поздних этапах инфекции и является основной причиной смертности от тяжелого гриппа.[58]
- Амитриптилин[51]
- Циклобензаприн[51]
- Кетотифен[51]
- Имипрамин[51]
- Миансерин[51]
- Ибудиласт[59]
- Пиноцембрин[60]
- Resatorvid[61]
- Налоксон[50]
- Налтрексон[50]
- (+) - налтрексон[50]
- ЛПС-РС[50]
- Пропентофиллин[нужна цитата ]
- Тапентадол (смешанный агонист / антагонист)
- Пальмитоилэтаноламид[62]
- (+) - налоксон («неестественный» изомер, лишенный сродства к опиоидным рецепторам, настолько селективный в отношении ингибирования TLR4)[44]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000136869 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б Вауре Ц., Лю И (10.07.2014). «Сравнительный обзор экспрессии и функциональности толл-подобного рецептора 4 у разных видов животных». Границы иммунологии. 5: 316. Дои:10.3389 / fimmu.2014.00316. ЧВК 4090903. PMID 25071777.
- ^ Брубейкер С.В., Бонэм К.С., Занони И., Каган Дж.С. (2015). «Распознавание врожденного иммунного паттерна: биологическая перспектива клетки». Ежегодный обзор иммунологии. 33: 257–90. Дои:10.1146 / аннурев-иммунол-032414-112240. ЧВК 5146691. PMID 25581309.
- ^ "O00206 (TLR4_HUMAN)". Uniprot.
- ^ а б c Лу YC, Yeh WC, Охаши PS (май 2008 г.). «Путь передачи сигнала LPS / TLR4». Цитокин. 42 (2): 145–51. Дои:10.1016 / j.cyto.2008.01.006. PMID 18304834.
- ^ «Ген энтреза: толл-подобный рецептор 4 TLR4».
- ^ а б Корнеев К.В., Атретханы К.Н., Друцкая М.С., Гривенников С.И., Купраш Д.В., Недоспасов С.А. (январь 2017). «TLR-сигнализация и провоспалительные цитокины как драйверы онкогенеза». Цитокин. 89: 127–135. Дои:10.1016 / j.cyto.2016.01.021. PMID 26854213.
- ^ а б О'Нил Л.А., Голенбок Д., Боуи АГ (июль 2013 г.). «История Toll-подобных рецепторов - новое определение врожденного иммунитета». Обзоры природы. Иммунология. 13 (6): 453–60. Дои:10.1038 / nri3446. HDL:2262/72552. PMID 23681101. S2CID 205491986.
- ^ Полссон-Макдермотт Э.М., О'Нил Л.А. (2004). «Передача сигнала липополисахаридным рецептором, Toll-подобный рецептор-4». Иммунология. 113 (2): 153–62. Дои:10.1111 / j.1365-2567.2004.01976.x. ЧВК 1782563. PMID 15379975.
- ^ Бейтлер Б, Рели М (2002). «Эволюция TIR, дорожных сборов и TLR: функциональные выводы из компьютерной биологии». Актуальные темы микробиологии и иммунологии. 270: 1–21. Дои:10.1007/978-3-642-59430-4_1. ISBN 978-3-642-63975-3. PMID 12467241.
- ^ Смирнова I, Полторак A, Чан EK, McBride C, Beutler B (2000). «Филогенетическая изменчивость и полиморфизм в локусе toll-подобного рецептора 4 (TLR4)». Геномная биология. 1 (1): ИССЛЕДОВАНИЕ002. Дои:10.1186 / gb-2000-1-1-research002. ЧВК 31919. PMID 11104518.
- ^ Quach H, Wilson D, Laval G, Patin E, Manry J, Guibert J, Barreiro LB, Nerrienet E, Verschoor E, Gessain A, Przeworski M, Quintana-Murci L (декабрь 2013 г.). «Различное давление отбора формирует эволюцию Toll-подобных рецепторов в популяциях человека и африканских обезьян». Молекулярная генетика человека. 22 (23): 4829–40. Дои:10.1093 / hmg / ddt335. ЧВК 3820138. PMID 23851028.
- ^ а б Баррейро Л. Б., Бен-Али М., Квач Х, Лаваль Дж., Патин Е., Пикрелл Дж. К., Бушье С., Тичит М., Нейроллес О., Жикель Б., Кидд Дж. Р., Кидд К. К., Алькаис А., Рагимбо Дж., Пеллегрини С., Абель Л., Казанова Дж. Л., Кинтана-Мурси Л. (июль 2009 г.). «Эволюционная динамика человеческих Toll-подобных рецепторов и их различный вклад в защиту хозяина». PLOS Genetics. 5 (7): e1000562. Дои:10.1371 / journal.pgen.1000562. ЧВК 2702086. PMID 19609346.
- ^ Плантинга Т.С., Иоана М., Алонсо С., Изагирре Н., Хервелла М., Йустен Л.А., ван дер Меер Дж.В., де ла Руа С., Нетеа М.Г. (2012). «Эволюционная история полиморфизмов TLR4 в Европе». Журнал врожденного иммунитета. 4 (2): 168–75. Дои:10.1159/000329492. ЧВК 6741577. PMID 21968286.
- ^ Re F, Strominger JL (июнь 2002 г.). «Мономерный рекомбинантный MD-2 прочно связывает толл-подобный рецептор 4 и придает липополисахаридную чувствительность». Журнал биологической химии. 277 (26): 23427–32. Дои:10.1074 / jbc.M202554200. PMID 11976338. S2CID 18706628.
- ^ Симадзу Р., Акаши С., Огата Х, Нагаи Й, Фукудомэ К., Мияке К., Кимото М. (июнь 1999 г.). «MD-2, молекула, которая придает липополисахаридную чувствительность к Toll-подобному рецептору 4». Журнал экспериментальной медицины. 189 (11): 1777–82. Дои:10.1084 / jem.189.11.1777. ЧВК 2193086. PMID 10359581.
- ^ Чжуан Т.Х., Улевич Р.Дж. (май 2004 г.). «Triad3A, убиквитин-протеинлигаза E3, регулирующая Toll-подобные рецепторы». Иммунология природы. 5 (5): 495–502. Дои:10.1038 / ni1066. PMID 15107846. S2CID 39773935.
- ^ Дойл С.Е., О'Коннелл Р., Вайдья С.А., Чоу Е.К., Йи К., Ченг Дж. (Апрель 2003 г.).«Toll-подобный рецептор 3 опосредует более мощный противовирусный ответ, чем Toll-подобный рецептор 4». Журнал иммунологии. 170 (7): 3565–71. Дои:10.4049 / jimmunol.170.7.3565. PMID 12646618. S2CID 5239330.
- ^ Ри Ш., Хван Д. (ноябрь 2000 г.). «Мышиный TOLL-подобный рецептор 4 придает липополисахаридную чувствительность, определяемую активацией NF каппа B и экспрессией индуцибельной циклооксигеназы». Журнал биологической химии. 275 (44): 34035–40. Дои:10.1074 / jbc.M007386200. PMID 10952994. S2CID 24729575.
- ^ Fitzgerald KA, Palsson-McDermott EM, Bowie AG, Jefferies CA, Mansell AS, Brady G, Brint E, Dunne A, Gray P, Harte MT, McMurray D, Smith DE, Sims JE, Bird TA, O'Neill LA (сентябрь 2001). «Mal (MyD88-подобный адаптеру) необходим для передачи сигнала Toll-подобного рецептора-4». Природа. 413 (6851): 78–83. Bibcode:2001Натура 413 ... 78F. Дои:10.1038/35092578. PMID 11544529. S2CID 4333764.
- ^ Чжан Г., Гош С. (март 2002 г.). «Отрицательная регуляция передачи сигналов, опосредованной toll-подобным рецептором, с помощью Tollip». Журнал биологической химии. 277 (9): 7059–65. Дои:10.1074 / jbc.M109537200. PMID 11751856. S2CID 30854510.
- ^ Пеана М., Здыб К., Медичи С., Пелучелли А., Симула Г., Гумиенна-Контекка Е., Зородду М.А. (2017). «Взаимодействие Ni (II) с пептидной моделью эктодомена TLR4 человека». J Trace Elem Med Biol. 44: 151–160. Дои:10.1016 / j.jtemb.2017.07.006. PMID 28965571.
- ^ Husebye H, Aune MH, Stenvik J, Samstad E, Skjeldal F, Halaas O, Nilsen NJ, Stenmark H, Latz E, Lien E, Mollnes TE, Bakke O, Espevik T. (октябрь 2010 г.). «ГТФаза Rab11a контролирует индуцированную Toll-подобным рецептором 4 активацию регуляторного фактора-3 интерферона на фагосомах». Иммунитет. 33 (4): 583–96. Дои:10.1016 / j.immuni.2010.09.010. PMID 20933442.
- ^ Шредер Н. В., Шуман Р. Р. (март 2005 г.). «Однонуклеотидные полиморфизмы Toll-подобных рецепторов и восприимчивость к инфекционным заболеваниям». Ланцет. Инфекционные заболевания. 5 (3): 156–64. Дои:10.1016 / S1473-3099 (05) 01308-3. PMID 15766650.
- ^ Лоренц Э., Мира Дж. П., Фрис К.Л., Шварц Д.А. (май 2002 г.). «Актуальность мутации рецептора TLR4 у пациентов с грамотрицательным септическим шоком». Архивы внутренней медицины. 162 (9): 1028–32. Дои:10.1001 / archinte.162.9.1028. PMID 11996613.
- ^ Нахтигалл I, Тамаркин А., Тафельски С., Вейманн А., Ротбарт А., Хайм С., Вернеке К.Д., Шпионы С. (февраль 2014 г.). «Полиморфизм генов толл-подобных рецепторов 2 и 4 связан с более быстрым прогрессированием и более тяжелым течением сепсиса у пациентов в критическом состоянии». Журнал международных медицинских исследований. 42 (1): 93–110. Дои:10.1177/0300060513504358. PMID 24366499. S2CID 25824309.
- ^ Пал Д., Дасгупта С., Кунду Р., Майтра С., Дас Дж., Мукхопадхьяй С., Рэй С., Маджумдар С.С., Бхаттачарья С. (2012). «Фетуин-A действует как эндогенный лиганд TLR4, способствуя индуцированной липидами резистентности к инсулину» (PDF). Природа Медицина. 18 (8): 1279–1285. Дои:10,1038 / нм 2851. PMID 22842477. S2CID 888828.
- ^ а б Mockenhaupt FP, Cramer JP, Hamann L, Stegemann MS, Eckert J, Oh NR, Otchwemah RN, Dietz E, Ehrhardt S, Schröder NW, Bienzle U, Schumann RR (январь 2006 г.). «Полиморфизмы Toll-подобных рецепторов (TLR) у африканских детей: общие варианты TLR-4 предрасполагают к тяжелой малярии». Труды Национальной академии наук Соединенных Штатов Америки. 103 (1): 177–82. Bibcode:2006ПНАС..103..177М. Дои:10.1073 / pnas.0506803102. ЧВК 1324982. PMID 16371473.
- ^ Ван дер Грааф CA, Netea MG, Morré SA, Den Heijer M, Verweij PE, Van der Meer JW, Kullberg BJ (март 2006 г.). «Полиморфизм Toll-подобного рецептора 4 Asp299Gly / Thr399Ile является фактором риска инфицирования кровотоком Candida». Европейская сеть цитокинов. 17 (1): 29–34. PMID 16613760.
- ^ Эйкинг А, Эй Б., Рюнци М., Ройг А.И., Рейс Х., Шмид К.В., Геркен Г., Подольский Д.К., Карио Е. (декабрь 2011 г.). «Вариант Toll-подобного рецептора 4 D299G вызывает признаки неопластического прогрессирования в клетках кишечника Caco-2 и связан с распространенным раком толстой кишки человека». Гастроэнтерология. 141 (6): 2154–65. Дои:10.1053 / j.gastro.2011.08.043. ЧВК 3268964. PMID 21920464.
- ^ а б Корнеев К.В., Свиряева Е.Н., Миткин Н.А., Горбачева А.М., Уварова А.Н., Устюгова А.С. и др. (Март 2020 г.). «Минорный аллель C SNP rs7873784, связанный с ревматоидным артритом и сахарным диабетом 2 типа, связывает PU.1 и усиливает экспрессию TLR4». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1866 (3): 165626. Дои:10.1016 / j.bbadis.2019.165626. PMID 31785408.
- ^ Лю Дж., Ян А.Р., Келли Т., Пуч А., Эсога С., Джун Х.Л., Эльнабави А., Мерченталер И., Сигарт В., Джун Х.Л., Аврелиан Л. (март 2011 г.). «Пьянство связано с экспрессией Toll-подобного рецептора 4 (TLR4), регулируемой ГАМК-альфа-2, в центральной миндалине». Труды Национальной академии наук Соединенных Штатов Америки. 108 (11): 4465–70. Bibcode:2011ПНАС..108.4465Л. Дои:10.1073 / pnas.1019020108. ЧВК 3060224. PMID 21368176. Сложить резюме – sciencedaily.com.
- ^ Blanco AM, Vallés SL, Pascual M, Guerri C (ноябрь 2005 г.). «Вовлечение передачи сигналов рецептора TLR4 / IL-1 типа I в индукцию медиаторов воспаления и гибель клеток, индуцированную этанолом в культивируемых астроцитах». Журнал иммунологии. 175 (10): 6893–9. Дои:10.4049 / jimmunol.175.10.6893. PMID 16272348. S2CID 10682750.
- ^ Hakim F, Wang Y, Zhang SX, Zheng J, Yolcu ES, Carreras A, Khalyfa A, Shirwan H, Almendros I, Gozal D (март 2014 г.). «Фрагментированный сон ускоряет рост и прогрессирование опухоли за счет привлечения связанных с опухолью макрофагов и передачи сигналов TLR4». Исследования рака. 74 (5): 1329–37. Дои:10.1158 / 0008-5472.CAN-13-3014. ЧВК 4247537. PMID 24448240.
- ^ Шавит Ю., Вольф Г., Гошен И., Лившиц Д., Йирмия Р. (май 2005 г.). «Интерлейкин-1 противодействует морфиновому обезболиванию и лежит в основе толерантности к морфину». Боль. 115 (1–2): 50–9. Дои:10.1016 / j.pain.2005.02.003. PMID 15836969. S2CID 7286123.
- ^ Мохан С., Дэвис Р.Л., ДеСилва Ю., Стивенс К.В. (октябрь 2010 г.). «Двойная регуляция мю-опиоидных рецепторов в клетках нейробластомы SK-N-SH с помощью морфина и интерлейкина-1β: свидетельство перекрестных помех между опиоидами и иммунитетом». Журнал нейроиммунологии. 227 (1–2): 26–34. Дои:10.1016 / j.jneuroim.2010.06.007. ЧВК 2942958. PMID 20615556.
- ^ Комацу Т., Сакурада С., Кацуяма С., Санаи К., Сакурада Т. (2009). Механизм аллодинии, вызванной интратекальным введением морфин-3-глюкуронида у мышей. Международный обзор нейробиологии. 85. С. 207–19. Дои:10.1016 / S0074-7742 (09) 85016-2. ISBN 9780123748935. PMID 19607972.
- ^ а б Льюис С.С., Хатчинсон М.Р., Резвани Н., Лорам Л.С., Чжан Й., Майер С.Ф., Райс К.С., Уоткинс Л.Р. (январь 2010 г.). «Доказательства того, что интратекальный морфин-3-глюкуронид может вызывать усиление боли через толл-подобный рецептор 4 / MD-2 и интерлейкин-1бета». Неврология. 165 (2): 569–83. Дои:10.1016 / j.neuroscience.2009.10.011. ЧВК 2795035. PMID 19833175.
- ^ Шен СН, Цай Р.Й., Ши М.С., Лин С.Л., Тай Й.Х., Цзянь С.К., Вонг С.С. (февраль 2011 г.). «Этанерцепт восстанавливает антиноцицептивный эффект морфина и подавляет нейровоспаление позвоночника у крыс, толерантных к морфину». Анестезия и анальгезия. 112 (2): 454–9. Дои:10.1213 / ANE.0b013e3182025b15. PMID 21081778. S2CID 12295407.
- ^ Крюк М.А., Уошберн С.Н., Морено Г., Воллер С.А., Пуга Д., Ли К.Х., Грау Дж.В. (февраль 2011 г.). «Антагонист рецептора IL-1 блокирует индуцированное морфином ослабление локомоторного восстановления после повреждения спинного мозга». Мозг, поведение и иммунитет. 25 (2): 349–59. Дои:10.1016 / j.bbi.2010.10.018. ЧВК 3025088. PMID 20974246.
- ^ а б Уоткинс Л. Р., Хатчинсон М. Р., Райс К. К., Майер С. Ф. (ноябрь 2009 г.). «Последствия» индуцированной опиоидами активации глии: повышение клинической эффективности опиоидов за счет нацеливания на глию ». Тенденции в фармакологических науках. 30 (11): 581–91. Дои:10.1016 / j.tips.2009.08.002. ЧВК 2783351. PMID 19762094.
- ^ а б c Hutchinson MR, Zhang Y, Brown K, Coats BD, Shridhar M, Sholar PW, Patel SJ, Crysdale NY, Harrison JA, Maier SF, Rice KC, Watkins LR (июль 2008 г.). «Нестереоселективное устранение нейропатической боли с помощью налоксона и налтрексона: участие толл-подобного рецептора 4 (TLR4)». Европейский журнал нейробиологии. 28 (1): 20–9. Дои:10.1111 / j.1460-9568.2008.06321.x. ЧВК 2588470. PMID 18662331.
- ^ Hutchinson MR, Coats BD, Lewis SS, Zhang Y, Sprunger DB, Rezvani N, Baker EM, Jekich BM, Wieseler JL, Somogyi AA, Martin D, Poole S, Judd CM, Maier SF, Watkins LR (ноябрь 2008 г.). «Провоспалительные цитокины противостоят острой и хронической анальгезии, вызванной опиоидами». Мозг, поведение и иммунитет. 22 (8): 1178–89. Дои:10.1016 / j.bbi.2008.05.004. ЧВК 2783238. PMID 18599265.
- ^ Хатчинсон М.Р., Льюис С.С., Коутс Б.Д., Резвани Н., Чжан И., Визелер Д.Л., Сомоги А.А., Инь Х., Майер С.Ф., Райс К.С., Уоткинс Л.Р. (май 2010 г.). «Возможное вовлечение толл-подобного рецептора 4 / фактора дифференцировки миелоида-2 в опиоидные неактивные изомеры вызывает провоспаление позвоночника и связанные с ним поведенческие последствия». Неврология. 167 (3): 880–93. Дои:10.1016 / j.neuroscience.2010.02.011. ЧВК 2854318. PMID 20178837.
- ^ Lin SL, Tsai RY, Tai YH, Cherng CH, Wu CT, Yeh CC, Wong CS (февраль 2010 г.). «Сверхмалые дозы налоксона усиливают экспрессию интерлейкина-10 и подавляют нейровоспаление в толерантном к морфину спинном мозге крыс». Поведенческие исследования мозга. 207 (1): 30–6. Дои:10.1016 / j.bbr.2009.09.034. PMID 19799935. S2CID 5128970.
- ^ «Неврология: заставить морфин работать лучше». Природа. 484 (7395): 419. 26 апреля 2012 г. Bibcode:2012 Натур.484Q.419.. Дои:10.1038 / 484419a. S2CID 52805136.
- ^ Drahl C (22 августа 2012 г.). "Маленькие молекулы нацелены на толл-подобные рецепторы". Новости химии и машиностроения.
- ^ а б c d е ж грамм час я j k л Hutchinson MR, Zhang Y, Shridhar M, Evans JH, Buchanan MM, Zhao TX, Slivka PF, Coats BD, Rezvani N, Wieseler J, Hughes TS, Landgraf KE, Chan S, Fong S, Phipps S, Falke JJ, Leinwand LA , Майер С.Ф., Инь Х, Райс К.К., Уоткинс Л.Р. (январь 2010 г.). «Доказательства того, что опиоиды могут иметь эффекты толл-подобных рецепторов 4 и MD-2». Мозг, поведение и иммунитет. 24 (1): 83–95. Дои:10.1016 / j.bbi.2009.08.004. ЧВК 2788078. PMID 19679181.
- ^ а б c d е ж грамм Hutchinson MR, Loram LC, Zhang Y, Shridhar M, Rezvani N, Berkelhammer D, Phipps S, Foster PS, Landgraf K, Falke JJ, Rice KC, Maier SF, Yin H, Watkins LR (июнь 2010 г.). «Доказательства того, что трициклические небольшие молекулы могут обладать толл-подобными рецепторами и активностью миелоидного белка 2 дифференцировки». Неврология. 168 (2): 551–63. Дои:10.1016 / j.neuroscience.2010.03.067. ЧВК 2872682. PMID 20381591.
- ^ Паскуаль М., Балиньо П., Альфонсо-Лоечес С., Арагон С.М., Герри С. (июнь 2011 г.). «Влияние TLR4 на поведенческие и когнитивные дисфункции, связанные с вызванным алкоголем нейровоспалительным повреждением». Мозг, поведение и иммунитет. 25 Дополнение 1: S80–91. Дои:10.1016 / j.bbi.2011.02.012. PMID 21352907. S2CID 205861788.
- ^ Келли К.В., Данцер Р. (июнь 2011 г.). «Алкоголизм и воспаление: нейроиммунология поведенческих и эмоциональных расстройств». Мозг, поведение и иммунитет. 25 Дополнение 1: S13–20. Дои:10.1016 / j.bbi.2010.12.013. ЧВК 4068736. PMID 21193024.
- ^ Харрис С.А., Соломон К.Р. (июль 1992 г.). «Чрескожное проникновение 2,4-дихлорфеноксиуксусной кислоты и соли 2,4-D диметиламина у людей-добровольцев». Журнал токсикологии и гигиены окружающей среды. 36 (3): 233–40. Дои:10.1080/15287399209531634. PMID 1629934.
- ^ Monari C, Bistoni F, Casadevall A, Pericolini E, Pietrella D, Kozel TR, Vecchiarelli A (январь 2005 г.). «Глюкуроноксиломаннан, микробное соединение, регулирует экспрессию костимулирующих молекул и выработку цитокинов в макрофагах». Журнал инфекционных болезней. 191 (1): 127–37. Дои:10.1086/426511. PMID 15593014.
- ^ У ХЭ, Хун Дж. С., Ценг Л. Ф. (октябрь 2007 г.). «Стереоселективное действие (+) - морфина над (-) - морфином в ослаблении антиноцицепции (-) - морфина через чувствительный к налоксону сигма-рецептор у мышей». Европейский журнал фармакологии. 571 (2–3): 145–51. Дои:10.1016 / j.ejphar.2007.06.012. ЧВК 2080825. PMID 17617400.
- ^ Тидсвелл М., Тиллис В., Лароса С.П., Линн М., Виттек А.Е., Као Р., Уиллер Дж., Гогейт Дж., Опал С.М. (январь 2010 г.). «Фаза 2 исследования эриторана тетранатрия (E5564), антагониста толл-подобного рецептора 4, у пациентов с тяжелым сепсисом». Реанимационная медицина. 38 (1): 72–83. Дои:10.1097 / CCM.0b013e3181b07b78. PMID 19661804. S2CID 19160973.
- ^ «Новый препарат предлагает новый подход к борьбе с вирусом гриппа - Vitals». NBCNews. 1 мая 2013 г.
- ^ Цзя ZJ, Wu FX, Хуан QH, Лю JM (апрель 2012 г.). «[Толл-подобный рецептор 4: потенциальная терапевтическая мишень для невропатической боли]». Чжунго И Сюэ Кэ Сюэ Юань Сюэ Бао. Acta Academiae Medicinae Sinicae. 34 (2): 168–73. Дои:10.3881 / j.issn.1000-503X.2012.02.013. PMID 22776604.
- ^ Лан Х, Хань Х, Ли Кью, Ли Кью, Гао Й, Ченг Т, Ван Дж, Чжу В., Ван Дж (март 2017 г.). «Пиноцембрин защищает геморрагический мозг, прежде всего, ингибируя толл-подобный рецептор 4 и уменьшая микроглию фенотипа M1». Мозг, поведение и иммунитет. 61: 326–339. Дои:10.1016 / j.bbi.2016.12.012. ЧВК 5453178. PMID 28007523.
- ^ Кайеда А., Такахаши М., Фукуда Х., Окамото Р., Моримото С., Гото М. и др. (Декабрь 2019 г.). «Структурный дизайн, синтез и биологическая оценка имидазо [4,5-b] пиридин-2-она на основе ингибиторов киназы p38 MAP: Часть 2». ChemMedChem. 14 (24): 2093–2101. Дои:10.1002 / cmdc.201900373. PMID 31697454. S2CID 207951964.
- ^ Импеллизцери Д., Камполо М., Ди Паола Р., Брускетта Дж., Де Стефано Д., Эспозито Э, Cuzzocrea S (2015). «Ультрамикронизированный пальмитоилэтаноламид уменьшает воспаление на Th1-опосредованной модели колита». Европейский журнал воспаления. 13: 14–31. Дои:10.1177 / 1721727X15575869. S2CID 79398556.
внешняя ссылка
- Toll-Like + Рецептор + 4 в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Обзор всей структурной информации, доступной в PDB за UniProt: O00206 (Toll-подобный рецептор 4) на PDBe-KB.