Плазмодий falciparum - Plasmodium falciparum
| Плазмодий falciparum | |
|---|---|
 | |
| Макрогаметоцит (слева) и микрогаметоцит (справа) P. falciparum | |
| Научная классификация | |
| (без рейтинга): | Потогонные |
| Clade: | ЦАРЬ |
| Clade: | SAR |
| Infrakingdom: | Альвеолаты |
| Тип: | Apicomplexa |
| Учебный класс: | Aconoidasida |
| Заказ: | Гемоспориды |
| Семья: | Plasmodiidae |
| Род: | Плазмодий |
| Разновидность: | P. falciparum |
| Биномиальное имя | |
| Плазмодий falciparum Уэлч, 1897 | |
| Синонимы[1] | |
| |
Плазмодий falciparum это одноклеточный простейшие паразит из люди, и самые смертоносные виды Плазмодий что вызывает малярия в людях.[2] Паразит передается через укус самки. Анофелес комар и вызывает наиболее опасную форму заболевания - малярию falciparum. На его долю приходится около 50% всех случаев малярии.[3][4] P. falciparum поэтому считается самым смертоносным паразитом у людей, от которого в 2018 году погибло 405000 человек. Он также связан с развитием рака крови (Лимфома Беркитта ) и классифицируется как Канцероген группы 2А.
Вид произошел от малярийного паразита. Лаверания нашел в гориллы около 10 000 лет назад.[5] Альфонс Лаверан первым идентифицировал паразита в 1880 году и назвал его Осциллярия малярия. Рональд Росс обнаружил его передачу комарами в 1897 году. Джованни Баттиста Грасси выяснил полную передачу от женщины анофелиновый комар людям в 1898 году. В 1897 году Уильям Х. Уэлч создал имя Плазмодий falciparum, который ICZN официально принят в 1954 г. P. falciparum принимает несколько различных форм в течение своего жизненного цикла. Стадия заражения человека: спорозоиты от слюнная железа комара. Спорозоиты растут и размножаются в печень стать мерозоитами. Эти мерозоиты вторгаются в эритроциты (Эритроциты) с образованием трофозоитов, шизонтов и гаметоцитов, во время которых возникают симптомы малярии. В комаре гаметоциты подвергнуться половому размножению зигота, который превращается в оокинете. Формы оокинете ооциты из которых образуются спорозоиты.
По состоянию на Всемирная организация здоровья Всемирный доклад о малярии, 2019 г.в 2018 году во всем мире было зарегистрировано 228 миллионов случаев малярии, в результате которых, по оценкам, погибло 405 000 человек. Почти все случаи смерти от малярии вызваны P. falciparum, причем 94% таких случаев приходится на Африка.[6] Больше всего страдают дети в возрасте до пяти лет, на долю которых приходится 61% от общего числа смертей.[7] В Африке к югу от Сахары более 75% случаев были вызваны P. falciparum, тогда как в большинстве других малярийных стран преобладают другие, менее вирулентные виды плазмодий.[8]
История

Малярия Falciparum была знакома древние греки, давший общее название πυρετός Pyretós "высокая температура".[9] Гиппократ (ок. 460–370 до н. э.) дал несколько описаний третичная лихорадка и четверная лихорадка.[10] Он был распространен во всей древнеегипетской и римской цивилизациях.[11] Именно римляне назвали болезнь «малярией» -мала плохо, и ария для воздуха, поскольку они считали, что болезнь распространяется через загрязненный воздух, или миазмы.
Открытие
Немецкий врач, Иоганн Фридрих Меккель, должно быть, был первым, кто увидел P. falciparum но не зная, что это было. В 1847 году он сообщил о наличии гранул черного пигмента в крови и селезенке пациента, умершего от малярии. Врач французской армии Шарль Луи Альфонс Лаверан, работая в больнице Бон (сейчас Аннаба в Алжире), правильно определил паразита как возбудителя малярии в 1880 году. Он представил свое открытие до Французская Медицинская Академия в Париже и опубликовал в Ланцет, в 1881 году. Он дал научное название Осциллярия малярия.[12] Но его открытие было воспринято скептически главным образом потому, что к тому времени ведущие врачи, такие как Теодор Альбрехт Эдвин Клебс и Коррадо Томмази-Крудели заявили, что они обнаружили бактерию (которую они назвали Bacillus malariae) как возбудитель малярии. Открытие Лаверан получило широкое признание только через пять лет, когда Камилло Гольджи подтвердили паразита с помощью лучшего микроскопа и техники окрашивания. Лаверан был удостоен Нобелевской премии по физиологии и медицине в 1907 году за свою работу. В 1900 г. итальянский зоолог Джованни Баттиста Грасси категоризированы Плазмодий виды, основанные на сроках лихорадки у пациента; злокачественная третичная малярия была вызвана Laverania malariae (сейчас же P. falciparum), доброкачественной третичной малярии Haemamoeba vivax (сейчас же P. vivax ) и четверной малярии Haemamoeba malariae (сейчас же P. malariae ).[13]
Британский врач Патрик Мэнсон сформулировал теория комаров и малярии в 1894 г .; до этого времени считалось, что малярийные паразиты распространяются в воздухе как миазмы, греческое слово, обозначающее загрязнение.[12] Его коллега Рональд Росс Хирург из британской армии отправился в Индию, чтобы проверить свою теорию. В 1897 году Росс обнаружил, что малярийные паразиты обитают у некоторых комаров. В следующем году он продемонстрировал, что малярийный паразит птиц может передаваться москитами от одной птицы к другой. Примерно в то же время Грасси продемонстрировал, что P. falciparum передавался людям только самками анофелинового комара (в его случае Anopheles claviger ).[14] Росс, Мэнсон и Грасси были номинированы на Нобелевскую премию по физиологии и медицине в 1902 году. При спорных обстоятельствах для награждения был выбран только Рональд Росс.[15]
По таксономии велись долгие дебаты. И только в 1954 г. Международная комиссия по зоологической номенклатуре официально утвержденный биноминальный Плазмодий falciparum.[16] Действительный род Плазмодий был создан двумя итальянскими врачами Этторе Маркиафава и Анджело Челли в 1885 г. Название вида ввел американский врач. Уильям Генри Велч в 1897 г.[17] Оно происходит от латинского серп, что означает "серп" и parum что означает «подобный или равный другому».[16]
Происхождение и эволюция
P. falciparum в настоящее время принято считать, что произошел от Лаверания (подрод Плазмодий найдены у обезьян) виды, присутствующие у горилл в Западной Африке.[18][19] Генетическое разнообразие указывает на то, что человеческие простейшие появились около 10 000 лет назад.[5] Ближайший родственник P. falciparum является P. praefalciparum, паразит гориллы при поддержке митохондриальный, апикопластический и ядерная ДНК последовательности.[20][21][22] Эти два вида тесно связаны с шимпанзе паразит P. reichenowi, который ранее считался ближайшим родственником P. falciparum. P. falciparum также когда-то считалось, что он произошел от паразита птиц.[23]
Уровни генетического полиморфизм чрезвычайно низки в пределах P. falciparum геном по сравнению с геномом близкородственных, заражающих обезьяны видов Плазмодий (включая P. praefalciparum).[24][20] Это говорит о том, что происхождение P. falciparum у людей появился недавно, как единичный P. praefalciparum штамм стал способен инфицировать людей.[20] Генетическая информация о Плазмодий falciparum сигнализирует о недавнем расширении, совпадающем с аграрной революцией. Вероятно, что развитие экстенсивного земледелия увеличило плотность популяции комаров за счет увеличения количества мест размножения, что могло спровоцировать эволюцию и распространение Плазмодий falciparum.[25]
Структура

P. falciparum не имеет фиксированной структуры, но претерпевает постоянные изменения в течение своего жизненного цикла. Спорозоит имеет веретеновидную форму, длину 10–15 мкм. В печени он вырастает в яйцевидный шизонт диаметром 30–70 мкм. Каждый шизонт производит мерозоиты, каждый из которых составляет примерно 1,5 мкм в длину и 1 мкм в диаметре. В эритроците мерозоит образует кольцевидную структуру, превращаясь в трофозоит. Трофозоиты питаются гемоглобином и образуют гранулированный пигмент, называемый гемозоин. В отличие от других Плазмодий виды, гаметоциты P. falciparum имеют продолговатую форму и форму полумесяца, по которой их иногда идентифицируют. Зрелый гаметоцит имеет длину 8–12 мкм и ширину 3–6 мкм. Оокинета также имеет удлиненную форму, ее размер составляет около 18–24 мкм. Ооциста имеет округлую форму и может достигать 80 мкм в диаметре.[26] При микроскопическом исследовании мазка крови выявляются только ранние (кольцевые) трофозоиты и гаметоциты, находящиеся в периферической крови. Зрелые трофозоиты или шизонты в мазках периферической крови, поскольку они обычно секвестрируются в тканях. Иногда на поверхности эритроцитов видны нечеткие красные точки в форме запятой. Эти точки Расщелина Маурера и представляют собой секреторные органеллы, вырабатывающие белки и ферменты, необходимые для усвоения питательных веществ и процессов иммунного уклонения.[27]
Апикальный комплекс, который на самом деле представляет собой комбинацию органелл, является важной структурой. Он содержит секреторные органеллы, называемые роттриями и микронемами, которые жизненно важны для подвижности, адгезии, инвазии клеток-хозяев и образования паразитофорных вакуолей.[28] Как апикомплекс, содержит пластиду, апикопласт, похожий на растение хлоропласты, которые они, вероятно, приобрели в результате поглощения (или вторжения) эукариотический водоросль и сохраняя пластиду водорослей как отличительную органелла заключен в четыре мембраны. Апикопласт участвует в синтезе липиды и несколько других соединений и обеспечивает привлекательную лекарственную мишень. На стадии инфекции, связанной с бесполым кровообращением, важной функцией апикопласта является производство предшественников изопреноидов. изопентенилпирофосфат (IPP) и диметилаллил пирофосфат (DMAPP) через MEP (немевалонатный) путь .[29]
Геном
В 1995 году малярия Геном Был создан проект по секвенированию генома P. falciparum. Геном его митохондрия сообщалось в 1995 г., о нефотосинтетических пластида известный как апикопласт в 1996 году,[30] и последовательность первых ядерных хромосома (хромосома 2) в 1998 году. Последовательность хромосомы 3 была представлена в 1999 году, а полный геном - 3 октября 2002 года.[31] Геном размером примерно 24 мегабаза чрезвычайно богат AT (около 80%) и организован в 14 хромосом. Было описано чуть более 5300 генов. Многие гены, участвующие в антигенных вариациях, расположены в субтеломерных областях хромосом. Они делятся на вар, винтовка, и стевор семьи. В геноме существует 59 вар, 149 винтовка, и 28 стевор гены, а также множественные псевдогены и усечения. По оценкам, 551 человек, или примерно 10% предсказанных ядерно-кодированных белки нацелены на апикопласт, а 4,7% протеом нацелен на митохондрии.[31]
Жизненный цикл
Люди являются промежуточными хозяевами, в которых происходит бесполое размножение, а самки комаров-анофелинов - окончательные хозяева, обеспечивающие стадию полового размножения.
В людях
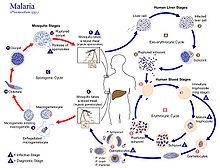
Заражение человека начинается с укуса инфицированной самки Анофелес комар. Из примерно 460 видов Анофелес комар малярию falciparum переносят более 70 видов.[32] Anopheles gambiae является одним из самых известных и распространенных переносчиков инфекции, особенно в Африке.[33]
Инфекционная стадия называется спорозоиты выделяется из слюнных желез через хоботок комара и попадает в кровоток во время кормления. Слюна комара содержит антигемостатические и противовоспалительные ферменты, которые нарушают свертываемость крови и подавляют болевую реакцию. Обычно в каждом инфицированном укусе содержится 20–200 спорозоитов.[28] Иммунная система выводит спорозоиты из кровотока в течение 30 минут. Но некоторые убегают и быстро вторгаются в клетки печени (гепатоциты ).[34] Спорозоиты движутся в кровотоке за счет скольжения, которое приводится в действие двигателем, состоящим из белков актина и миозина под их плазматической мембраной.[35]
Печеночная стадия или экзоэритроцитарная шизогония
Попадая в гепатоциты, паразит теряет апикальный комплекс и поверхностное покрытие, и превращается в трофозоит. В рамках паразитофорная вакуоль гепатоцита он проходит 13–14 раундов митоза и мейоза, в результате которых образуется синцитиальная клетка (ценоцит ) назвал шизонтом. Этот процесс называется шизогонией. Шизонт состоит из десятков тысяч ядер. С поверхности шизонта появляются десятки тысяч гаплоидных (1n) дочерних клеток, называемых мерозоитами. На стадии печени может образовываться до 90000 мерозоитов,[36] которые в конечном итоге попадают в кровоток в заполненных паразитами пузырьках, называемых меросомами.[37]
Стадия крови или эритроцитарная шизогония
Мерозоиты использовать апикомплекс органеллы инвазии (апикальный комплекс, пленка и поверхностная оболочка) для распознавания и проникновения в эритроцит хозяина (красные кровяные тельца). Паразит сначала связывается с эритроцитом в случайной ориентации. Затем он переориентируется таким образом, что апикальный комплекс находится вблизи мембраны эритроцита. Паразит образует паразитофорную вакуоль, позволяющую ему развиваться внутри эритроцит.[38] Этот цикл заражения происходит очень синхронно, когда примерно все паразиты в крови находятся на одной и той же стадии развития. Было показано, что этот точный механизм синхронизации зависит от собственного человеческого хозяина. циркадный ритм.[39]
Внутри эритроцита метаболизм паразита зависит от переваривания гемоглобин. Клинические симптомы малярии, такие как лихорадка, анемия и неврологические расстройства, возникают на стадии крови.[34]
Паразит также может изменять морфологию эритроцита, вызывая выступы на мембране эритроцита. Инфицированные эритроциты часто секвестрируются в различных тканях или органах человека, таких как сердце, печень и мозг. Это вызвано присутствием на мембране эритроцитов белков клеточной поверхности, полученных из паразитов, и именно эти белки связываются с рецепторами на клетках человека. Секвестрация в головном мозге вызывает церебральную малярию, очень тяжелую форму заболевания, которая увеличивает вероятность смерти жертвы.
Трофозоит
После вторжения в эритроцит паразит теряет свои специфические органеллы инвазии (апикальный комплекс и поверхностная оболочка) и де-дифференцируется в круглый трофозоит, расположенный в паразитофорной вакуоли. Молодой трофозоит (или стадия «кольца» из-за его морфологии на окрашенных мазках крови) существенно вырастает до того, как подвергнется шизогонии.[40]
Шизонт
На стадии шизонта паразит многократно реплицирует свою ДНК, и несколько митотических делений происходят асинхронно.[41][42] Каждый шизонт образует 16-18 мерозоитов.[40] Эритроциты разрушаются мерозоитами. Освободившиеся мерозоиты проникают в свежие эритроциты. Свободный мерозоит находится в кровотоке примерно 60 секунд, прежде чем попадет в другой эритроцит.[38]
Продолжительность каждой стадии крови составляет примерно 48 часов. Это вызывает характерные клинические проявления малярии falciparum, такие как лихорадка и озноб, соответствующие синхронному разрыву инфицированных эритроцитов.[43]
Гаметоцит
Некоторые мерозоиты различаются на половые формы, мужские и женские. гаметоциты. Этим гаметоцитам требуется примерно 7–15 дней для достижения полной зрелости в ходе процесса, называемого гаметоцитогенезом. Затем их принимает женщина Анофелес комар во время еды кровью.[44]
Период инкубации
Время появления симптомов заражения (т.н. период инкубации ) является самым коротким для P. falciparum среди Плазмодий разновидность. Инкубационный период в среднем составляет 11 дней,[43] но может составлять от 9 до 30 дней. В единичных случаях регистрировались продолжительные инкубационные периоды до 2, 3 или даже 8 лет.[45] Беременность и коинфекция ВИЧ - важные условия для отсроченных симптомов.[46] Паразиты могут быть обнаружены в образцах крови к 10-му дню после заражения (предпатентный период).[43]
В комарах
В средней кишке комара процесс созревания женской гаметы влечет за собой небольшие морфологические изменения, становясь более увеличенными и сферическими. Мужской гаметоцит подвергается быстрому ядерному делению в течение 15 минут, производя восемь бичеванный микрогаметы с помощью процесса, называемого эксфлагелляцией.[47] Жгутиковые микрогаметы оплодотворяют самку макрогамета произвести диплоид ячейка называется зигота. Затем зигота превращается в оокинете. Оокинета - подвижная клетка, способная проникать в другие органы комара. Он пересекает перитрофическая мембрана средней кишки комара и проникает через эпителий средней кишки. Пройдя через эпителий, оокинета попадает в базальная пластинка, и останавливается на неподвижном ооциста. В течение нескольких дней ооциста подвергается от 10 до 11 раундов деления клеток, чтобы создать синцитиальный клетка (споробласт ), содержащий тысячи ядер. Мейоз происходит внутри споробласта с образованием более 3000 гаплоидных дочерних клеток, называемых спорозоитами, на поверхности материнской клетки.[48] Незрелые спорозоиты прорывают стенку ооцисты в гемолимфа. Они мигрируют в слюнные железы комаров, где подвергаются дальнейшему развитию и становятся инфекционными для человека.[34]
Взаимодействие с иммунной системой человека
Иммунная реакция
Один комар-анофелин может передавать сотни P. falciparum спорозоитов за один укус в условиях эксперимента. Но в природе их обычно меньше 80.[49] Спорозоиты не попадают в кровоток напрямую и остаются в тканях кожи в течение 2–3 часов. Около 15–20% спорозоитов попадают в лимфатическую систему, где активируются. дендритные клетки, которые отправляют их на разрушение Т-лимфоцитами (CD8 + Т-клетки ). Через 48 часов после заражения Плазмодий-специфические CD8 + Т-клетки могут быть обнаружены в лимфатический узел связаны с клетками кожи.[50] Большинство спорозитов, оставшихся в кожной ткани, впоследствии погибает врожденная иммунная система. Гликопротеин спорозоитов специфически активирует тучные клетки. Затем тучные клетки производят сигнальные молекулы Такие как TNFα и MIP-2, которые активируют пожиратели клеток (профессиональные фагоциты), такие как нейтрофилы и макрофаги.[51]
Лишь небольшое количество (0,5-5%) спорозоитов попадает с током крови в печень. В печени активированные CD8 + T-клетки из лимфы связывают спорозоиты через белок циркумспорозоит (CSP).[50] Презентация антигена дендритными клетками в ткани кожи к Т-клеткам также является важным процессом. Начиная с этой стадии паразиты производят различные белки, которые помогают подавлять коммуникацию иммунных клеток.[52] Даже на пике инфекции, когда эритроциты разрываются, иммунные сигналы недостаточно сильны, чтобы активировать макрофаги или естественные клетки-киллеры.[53]
Уклонение от иммунной системы
Несмотря на то что P. falciparum легко распознается иммунной системой человека, находясь в кровотоке, ускользает от иммунитета, производя более 2000 антигенов клеточных мембран[54] На начальной стадии заражения спорозоиты продуцируют белок циркумспорозоит (CSP), который связывается с гепатоцитами.[55] Связыванию с гепатоцитами и проникновению в них способствует другой белок, анонимный белок, связанный с тромбоспондином (TRAP).[56] TRAP и другие секреторные белки (включая белок микронемы спорозоитов, необходимый для прохождения клеток 1, SPECT1 и SPECT2) из микронемы позволяют спорозоитам перемещаться по крови, избегая иммунных клеток и проникая в гепатоциты.[57]
Во время инвазии эритроцитов мерозоиты выделяют белок-шапочку мерозоитов-1 (MCP1), антиген апикальной мембраны 1 (AMA1), антигены, связывающие эритроциты (EBA), белок, взаимодействующий с хвостовым доменом миозина A (MTIP), и поверхностные белки мерозоитов (MSP).[54] Из этих MSP, MSP1 и MSP2 в первую очередь отвечают за избегание иммунных клеток.[58] Вирулентность P. falciparum опосредуется белками мембран эритроцитов, которые продуцируются шизонтами и трофозоитами внутри эритроцитов и отображаются на мембране эритроцитов. PfEMP1 является наиболее важным, способным действовать как антиген и как молекула адгезии.[59]
Патогенез
Клинические симптомы малярии falciparum возникают в результате разрыва шизонта и разрушения эритроцитов. Большинство пациентов испытывают высокая температура (> 92% случаев), озноб (79%), головные боли (70%), и потливость (64%). Головокружение, недомогание, боли в мышцах, боль в животе, тошнота, рвота, незначительный понос, и сухой кашель также обычно связаны. Высокая частота сердечных сокращений, желтуха, бледность, ортостатическая гипотензия, увеличенная печень, и увеличенная селезенка также диагностированы.[43]
P. falciparum работает через секвестр, отличительное свойство, не разделяемое некоторыми другими Плазмодии.[требуется разъяснение ] Зрелые шизонты изменяют поверхностные свойства инфицированных эритроцитов, заставляя их прилипать к стенкам кровеносных сосудов (цитоадгезия). Это приводит к нарушению микроциркуляции и нарушению функции многих органов, например головного мозга. церебральная малярия.[60]
P. falciparum несет ответственность (почти) за все тяжелые человеческие заболевания и смерти в результате малярии в состоянии, которое называется сложной или тяжелой малярией. Осложненная малярия чаще встречается у детей в возрасте до 5 лет.[43] а иногда и у беременных (состояние, которое называется малярия, связанная с беременностью ).[61] Женщины становятся восприимчивыми к тяжелой малярии во время первой беременности. Восприимчивость к тяжелой малярии снижается при последующих беременностях из-за повышенного уровня антител против варианта поверхности. антигены которые появляются на инфицированных эритроцитах.[62] Но повышенный иммунитет матери увеличивает восприимчивость к малярии у новорожденных.[61]
Распространение и эпидемиология
P. falciparum встречается на всех континентах, кроме Европы. Согласно ВОЗ Всемирный доклад о малярии, 2019 г., 228 миллионов человек пострадали от малярии в 2018 году, что немного меньше 231 миллиона в 2017 году. 405 000 человек умерли от нее.[6] Инфекция наиболее распространена в Африке, где происходит 94% случаев смерти от малярии. Больше всего страдают дети в возрасте до пяти лет, и 61% случаев смерти от малярии приходится на эту возрастную группу. 80% инфекции обнаруживается в Африке к югу от Сахары, 7% в Юго-Восточной Азии и 2% в Восточном Средиземноморье. Нигерия имеет самый высокий уровень заболеваемости - 27% от общего числа случаев в мире. За пределами Африки самый высокий уровень заболеваемости наблюдается в Индии, на которую приходится 4,5% глобального бремени. Европа считается регионом, свободным от малярии. Исторически паразит и его болезнь были наиболее известны в Европе. Но медицинские программы, такие как распыление инсектицидов, лекарственная терапия и экологическая инженерия с начала 20 века, привели к полному искоренению в 1970-х годах.[63] По оценкам, постоянному риску заражения подвержены около 2,4 миллиарда человек.[64]
Уход
История
В 1640 году Хуан дель Вего впервые применил настойка из хинное дерево кора для лечения малярии; коренные индейцы Перу и Эквадор использовал его еще раньше для лечения лихорадки. Томпсон (1650) представил это "Иезуиты лаять на Англия. Его первое зарегистрированное использование там было Джоном Метфордом из Нортгемптон в 1656 г. Мортон (1696) представил первое подробное описание клинической картины малярии и ее лечения хиной. Gize (1816) изучал извлечение кристаллических хинин из коры хинного дерева и Пеллетье и Caventou (1820) в Франция экстрагированный чистый хинин алкалоиды, который они назвали хинином и цинхонин.[65][66] Полный синтез хинина был осуществлен американскими химиками Р. Б. Вудвордом и У. Деринг в 1944 году. Вудворд получил Нобелевскую премию по химии в 1965 году.[67]
Попытки создать синтетические противомалярийные препараты начались в 1891 году. Атабрин, разработанный в 1933 году, широко использовался в Тихом океане во время Второй мировой войны, но был непопулярным из-за своих неблагоприятных последствий.[68] В конце 1930-х годов немцы разработали хлорохин, который использовался в кампаниях в Северной Африке. Создание секретного военного проекта под названием Проект 523, Мао Зедун призвал китайских ученых найти новые противомалярийные препараты, увидев жертвы во Вьетнамской войне. Ту Youyou обнаруженный артемизинин в 1970-х из полыни душистой (Полынь однолетняя ). Этот препарат стал известен западным ученым в конце 1980-х - начале 1990-х годов и сейчас является стандартным средством лечения. Ту получил Нобелевскую премию по физиологии и медицине в 2015 году.[69]
Неосложненная малярия
Согласно рекомендациям ВОЗ 2010 г.,[70] Комбинированная терапия на основе артемизинина (ACT) рекомендуются первая линия противомалярийный лечения неосложненной малярии, вызванной P. falciparum. ВОЗ рекомендует такие комбинации, как артеметер / люмефантрин, артесунат / амодиахин, артесунат / мефлохин, артесунат / сульфадоксин-пириметамин, и дигидроартемизинин / пиперахин.[70]
Выбор ACT основан на уровне устойчивости к составляющим в комбинации. Артемизинин и его производные не подходят для монотерапии. В качестве противомалярийного лечения второго ряда, когда начальное лечение не работает, рекомендуется альтернативная АКТ, которая, как известно, эффективна в данном регионе, например, артесунат плюс тетрациклин или доксициклин или же клиндамицин, и хинин плюс тетрациклин, доксициклин или клиндамицин. Любую из этих комбинаций следует применять в течение 7 дней. Для беременных рекомендуется лечение первой линии во время первый триместр хинин плюс клиндамицин в течение 7 дней.[70] Артесунат плюс клиндамицин в течение 7 дней показан, если это лечение не дает результатов. Для путешественников, возвращающихся в неэндемичные страны, атоваквон /прогуанил рекомендуются артеметер / люмефантринани и хинин плюс доксициклин или клиндамицин.[70]
Тяжелая малярия
Для взрослых, внутривенный (IV) или внутримышечный (IM) рекомендуется артесунат.[70] Хинин - приемлемая альтернатива, если парентеральный артесунат недоступен.[70]
Для детей, особенно в эндемичных по малярии районах Африки, рекомендуются артесунат внутривенно или внутримышечно, хинин (внутривенная инфузия или разделенная внутримышечная инъекция) и артеметер внутримышечно.[70]
Парентеральные противомалярийные препараты следует вводить в течение минимум 24 часов, независимо от способности пациента переносить пероральные препараты раньше.[70] После этого рекомендуется полное лечение, включая полный курс АКТ или хинина плюс клиндамицин или доксициклин.[70]
Вакцинация
РТС, S является единственным кандидатом в качестве вакцины против малярии, прошедшим клинические испытания.[71] Анализ результатов испытания фазы III (проведенного в период с 2011 по 2016 год) выявил довольно низкую эффективность (20-39% в зависимости от возраста, до 50% у детей в возрасте 5-17 месяцев), что указывает на то, что вакцина будет не приводит к полной защите и искоренению.[72]
Рак
В Международное агентство по изучению рака (МАИР) классифицировал малярию из-за P. falciparum как канцероген группы 2А, что означает, что паразит, вероятно, является канцерогеном у людей.[73] Его связь с клеткой крови (лимфоцит ) рак называется Лимфома Беркитта Установлено. Лимфома Беркита была обнаружена Денис Беркитт в 1958 году от африканских детей, и позже он предположил, что рак, вероятно, был вызван некоторыми инфекционными заболеваниями. В 1964 году вирус, позже названный Вирус Эпштейна-Барра (EBV) после первооткрывателей, был идентифицирован из раковых клеток. Впоследствии было доказано, что вирус является прямым возбудителем рака, и теперь он классифицируется как Канцероген группы 1.[74] В 1989 году стало понятно, что для ВЭБ необходимы другие инфекции, такие как малярия, чтобы вызвать трансформацию лимфоцитов. Сообщалось, что заболеваемость лимфомой Беркитта снизилась благодаря эффективному лечению малярии в течение нескольких лет.[75] Фактическая роль, которую играет P. falciparum оставалось неясным в течение следующих двух с половиной десятилетий. Известно, что ВЭБ заставляет лимфоциты становиться злокачественными, используя свои вирусные белки (такие антигены, как EBNA-1, EBNA-2, LMP-1, и LMP2A ).[76][77] С 2014 года стало ясно, что P. falciparum способствует развитию лимфомы. P. falciparum-инфицированные эритроциты напрямую связываются с В-лимфоциты через домен CIDR1α PfEMP1. Эта привязка активирует толл-подобные рецепторы (TLR7 и TLR10 ) вызывая непрерывную активацию лимфоцитов, которые подвергаются пролиферации и дифференцировке в плазматические клетки, тем самым увеличивая секрецию IgM и цитокины.[78] Это, в свою очередь, активирует фермент, называемый цитидин дезаминаза, индуцированная активацией (AID), который имеет тенденцию вызывать мутации в ДНК (путем двухниточный разрыв ) лимфоцитов, инфицированных EBV. Поврежденная ДНК подвергается неконтролируемой репликация, делая клетку злокачественной.[79]
Влияние на геном человека
Высота смертность и болезненность вызванный P. falciparum разместил большой селективное давление на человеческий геном. Несколько генетических факторов обеспечивают некоторое сопротивление Плазмодий инфекционное заболевание, включая серповидноклеточная черта, талассемия черты, дефицит глюкозо-6-фосфатдегидрогеназы, а отсутствие Антигены Даффи на эритроциты.[80][81] Свекла Э.А., врач, работающий в г. Южная Родезия (сейчас же Зимбабве ) заметил в 1948 г., что серповидноклеточная анемия было связано с более низким уровнем заражения малярией.[82] Это предложение было подтверждено Дж. Б. С. Холдейн в 1948 году, который предположил, что талассемия может обеспечить аналогичную защиту.[83] Эта гипотеза с тех пор была подтверждена и распространена на гемоглобин E,[84] гемоглобин С и Гемоглобин С.[85]
Смотрите также
Рекомендации
- ^ Коатни Г.Р., Коллинз В.Е., Уоррен М., Контакос П.Г. (1971). "22 Плазмодий falciparum (Уэлч, 1897 г.) ". Малярии приматов. Отделение паразитарных заболеваний, CDC. п. 263.
- ^ Rich, S.M .; Leendertz, F. H .; Xu, G .; Lebreton, M .; Джоко, К. Ф .; Aminake, M.N .; Takang, E. E .; Diffo, J.L.D .; Pike, B.L .; Rosenthal, B.M .; Форменти, П .; Boesch, C .; Ayala, F.J .; Вулф, Н. Д. (2009). «Происхождение злокачественной малярии». Труды Национальной академии наук. 106 (35): 14902–14907. Bibcode:2009PNAS..10614902R. Дои:10.1073 / pnas.0907740106. ЧВК 2720412. PMID 19666593.
- ^ Perkins, D. J .; Были, Т .; Davenport, G.C .; Kempaiah, P .; Hittner, J. B .; Онг'Эча, Дж. М. (2011). «Тяжелая малярийная анемия: врожденный иммунитет и патогенез». Международный журнал биологических наук. 7 (9): 1427–1442. Дои:10.7150 / ijbs.7.1427. ЧВК 3221949. PMID 22110393.
- ^ Perlmann, P; Трой-Бломберг, М. (2000). «Малярия на стадии крови и борьба с ней иммунной системой». Folia Biologica. 46 (6): 210–8. PMID 11140853.
- ^ а б Лой, Дороти Э .; Лю, Вэйминь; Ли, Иньин; Учись, Джеральд Х .; Plenderleith, Lindsey J .; Sundararaman, Sesh A .; Шарп, Пол М .; Хан, Беатрис Х. (2017). "За пределами Африки: происхождение и эволюция паразитов малярии человека" Плазмодий falciparum и Плазмодий вивакс". Международный журнал паразитологии. 47 (2–3): 87–97. Дои:10.1016 / j.ijpara.2016.05.008. ЧВК 5205579. PMID 27381764.
- ^ а б ВОЗ (2019). Всемирный доклад о малярии, 2019 г.. Швейцария: Всемирная организация здравоохранения. С. xii – xiii, 4–10. ISBN 978-92-4-156572-1.
- ^ «Всемирный доклад о малярии 2018». ВОЗ. Получено 2 декабря 2018.
- ^ «Всемирный доклад о малярии, 2008 г.» (PDF). Всемирная организация здравоохранения. 2008. с. 10. Получено 2009-08-17.
- ^ Барон, Кристофер; Хэмлин, Кристофер (2015). «Малярия и упадок Древней Греции: пересмотр гипотезы Джонса в эпоху междисциплинарности». Минерва. 53 (4): 327–358. Дои:10.1007 / s11024-015-9280-7.
- ^ Хемпельманн, Эрнст; Крафтс, Кристина (2013). «Плохой воздух, амулеты и комары: 2000? Лет изменения взглядов на малярию». Журнал Малярии. 12 (1): 232. Дои:10.1186/1475-2875-12-232. ЧВК 3723432. PMID 23835014.
- ^ Нерлих, А (2016). Палеопатология и палеомикробиология малярии. Микробиологический спектр. 4. С. 155–160. Дои:10.1128 / microbiolspec.PoH-0006-2015. ISBN 9781555819163. PMID 27837743.
- ^ а б Лалчхандама, К. (2014). «Становление современной маляриологии: от миазмов до теории комаров и малярии» (PDF). Научное видение. 14 (1): 3–17. Архивировано из оригинал (PDF) на 2014-04-27.
- ^ Кокс, Фрэнсис Э. Г. (2010). «История открытия малярийных паразитов и их переносчиков». Паразиты и векторы. 3 (1): 5. Дои:10.1186/1756-3305-3-5. ЧВК 2825508. PMID 20205846.

- ^ Баччетти, Б. (2008). "История ранней систематики двукрылых в Италии: от Линцея до Баттисты Грасси". Параситология. 50 (3–4): 167–172. PMID 20055226.
- ^ Капанна, Э (2006). «Грасси против Росс: кто разгадал загадку малярии?». Международная микробиология. 9 (1): 69–74. PMID 16636993.
- ^ а б Брюс-Чватт, Л. Дж. (1987). «Номенклатура Falciparum». Паразитология сегодня. 3 (8): 252. Дои:10.1016/0169-4758(87)90153-0.
- ^ Christophers, R; Синтон, Дж. А. (1938). "Правильное название злокачественного терцианского паразита". Британский медицинский журнал. 2 (4065): 1130–1134. Дои:10.1136 / bmj.2.4065.1130. ЧВК 2211005. PMID 20781927.
- ^ Лю, Вт; Ли, У; Узнай, GH; Rudicell, RS; Робертсон, JD; Кил, BF; Нджанго, JB; Sanz, CM; и другие. (2010). "Происхождение паразита малярии человека Плазмодий falciparum в горилл ". Природа. 467 (7314): 420–5. Bibcode:2010Натура.467..420л. Дои:10.1038 / природа09442. ЧВК 2997044. PMID 20864995.
- ^ Холмс, Эдвард С. (2010). «Малярия: связь горилл». Природа. 467 (7314): 404–405. Bibcode:2010Натура.467..404H. Дои:10.1038 / 467404a. PMID 20864986.
- ^ а б c Лю, Вт; Ю. Ли, Г. Х. Жизни, Р. С. Рудичелл, Дж. Д. Робертсон, Б. Ф. Кил, Дж. Н. Нджанго, С. М. Санс, Д. Б. Морган, С. Локателли, М. К. Гондер, П. Дж. Кранзуш, П. Д. Уолш, Э. Делапорте, Э. Мпоуди-Нголе, А. В. Георгиев, М. Н. Мюллер, Г. М. Шоу, М. Петерс, П. М. Шарп, Дж. К. Рейнер, Б. Х. Хан (2010). "Происхождение паразита малярии человека Плазмодий falciparum в горилл ". Природа. 467 (7314): 420–5. Bibcode:2010 Натур.467..420л. Дои:10.1038 / природа09442. ЧВК 2997044. PMID 20864995.CS1 maint: несколько имен: список авторов (связь)
- ^ Дюваль, L; M Fourment, E Nerrienet, D Rousset, SA Sadeuh, SM Goodman, NV Andriaholinirina, M Randrianarivelojosia, RE Paul, V Robert, FJ Ayala, F Ariey (2010). «Африканские обезьяны как резервуары Плазмодий falciparum и происхождение и разнообразие подрода Laverania ". Труды Национальной академии наук Соединенных Штатов Америки. 107 (23): 10561–6. Bibcode:2010PNAS..10710561D. Дои:10.1073 / pnas.1005435107. ЧВК 2890828. PMID 20498054.CS1 maint: несколько имен: список авторов (связь)
- ^ Райнер, Дж; В. М. Лю, М. Петерс, П. М. Шарп, Б. Х. Хан (2011). "Множество Плазмодий вид диких обезьян: источник заражения человека? ". Тенденции в паразитологии. 27 (5): 222–229. Дои:10.1016 / J.Pt.2011.01.006. ЧВК 3087880. PMID 21354860.CS1 maint: несколько имен: список авторов (связь)
- ^ Rathore, D; Уол А.М., Салливан М., Маккатчан Т.Ф. (25 апреля 2001 г.). "Филогенетическое сравнение деревьев генов, построенных из пластидных, митохондриальных и геномных ДНК Плазмодий разновидность". Молекулярная и биохимическая паразитология. 114 (1): 89–94. Дои:10.1016 / S0166-6851 (01) 00241-9. PMID 11356517.CS1 maint: несколько имен: список авторов (связь)
- ^ Хартл, Д.Х. (январь 2004 г.). «Происхождение малярии: смешанные сообщения из генетического разнообразия». Обзоры природы Микробиология. 2 (1): 15–22. Дои:10.1038 / nrmicro795. PMID 15035005.
- ^ Hume, J.C .; Lyons, E.J .; Дэй, К. (2003). "Миграция людей, комары и эволюция Плазмодий falciparum". Тенденции Паразитол. 19 (3): 144–9. Дои:10.1016 / с 1471-4922 (03) 00008-4. PMID 12643998.
- ^ Lucius, R .; Робертс, Ч.В. (2017). «Биология паразитических простейших». В Lucius, R .; Лоос-Франк, В .; Lane, R.P .; Poulin, R .; Roberts, C.W .; Гренцис, Р. (ред.). Биология паразитов. Джон Вили и сыновья. С. 190–198. ISBN 978-3-527-32848-2.
- ^ Ланцер, Майкл; Викерт, Ханнес; Кроне, Георг; Винченсини, Летиция; Браун Бретон, Кэтрин (2006). "Расщелина Маурера: новая многофункциональная органелла в цитоплазме Плазмодий falciparum-инфицированные эритроциты ». Международный журнал паразитологии. 36 (1): 23–36. Дои:10.1016 / j.ijpara.2005.10.001. PMID 16337634.
- ^ а б Garcia, J. E .; Puentes, A .; Патарройо, М. Э. (2006). "Биология развития взаимодействий спорозоит-хозяин в Плазмодий falciparum Малярия: значение для разработки вакцины ». Обзоры клинической микробиологии. 19 (4): 686–707. Дои:10.1128 / CMR.00063-05. ЧВК 1592691. PMID 17041140.
- ^ Ага, Эллен; ДеРизи, Джозеф Л. (30 августа 2011 г.). «Химическое спасение малярийных паразитов, лишенных апикопласта, определяет функцию органелл в стадии крови» Плазмодий falciparum". ПЛОС Биол. 9 (8): e1001138. Дои:10.1371 / journal.pbio.1001138. ISSN 1545-7885. ЧВК 3166167. PMID 21912516.
- ^ Wilson RJ; Denny PW; Preiser PR; и другие. (Август 1996 г.). "Полная генная карта пластидоподобной ДНК малярийного паразита. Плазмодий falciparum". Журнал молекулярной биологии. 261 (2): 155–72. Дои:10.1006 / jmbi.1996.0449. PMID 8757284.
- ^ а б Гарднер MJ; Зал N; Fung E; и другие. (Октябрь 2002 г.). "Последовательность генома малярийного паразита человека Плазмодий falciparum". Природа. 419 (6906): 498–511. Bibcode:2002Натура.419..498Г. Дои:10.1038 / природа01097. ЧВК 3836256. PMID 12368864.
- ^ Молина-Крус, Альваро; Зильверсмит, Мартина М .; Neafsey, Daniel E .; Hartl, Daniel L .; Барильяс-Мьюри, Каролина (2016). "Переносчики комаров и глобализация Плазмодий falciparum Малярия ». Ежегодный обзор генетики. 50 (1): 447–465. Дои:10.1146 / annurev-genet-120215-035211. PMID 27732796.
- ^ Sinka, Marianne E; Челка, Майкл Дж; Мангин, Сильви; Кутзи, Морин; Мбого, Чарльз М; Хемингуэй, Джанет; Патил, Ананд П.; Темперли, Уилл Н; Гетинг, Питер У; Кабария, Кэролайн В.; Окара, Роби М; Ван Бекель, Томас; Годфрей, Х. Чарльз Дж; Harbach, Ralph E; Хэй, Саймон I (2010). "Доминирующая Анофелес переносчики малярии человека в Африке, Европе и на Ближнем Востоке: данные о встречаемости, карты распространения и биономические данные ». Паразиты и векторы. 3 (1): 117. Дои:10.1186/1756-3305-3-117. ЧВК 3016360. PMID 21129198.
- ^ а б c Джеральд, Н .; Mahajan, B .; Кумар, С. (2011). "Митоз малярийного паразита человека Плазмодий falciparum". Эукариотическая клетка. 10 (4): 474–482. Дои:10.1128 / EC.00314-10. ЧВК 3127633. PMID 21317311.
- ^ Каппе, SH; Бускалья, Калифорния; Бергман, LW; Коппенс, я; Нуссенцвейг, V (2004). «Apicomplexan скользящая подвижность и вторжение клеток-хозяев: пересмотр моторной модели». Тенденции в паразитологии. 20 (1): 13–16. CiteSeerX 10.1.1.458.5746. Дои:10.1016 / j.pt.2003.10.011. PMID 14700584.
- ^ Vaughan, Ashley M .; Каппе, Стефан Х. (2017). «Малярийная паразитарная инфекция печени и биология экзоэритроцитов». Перспективы Колд-Спринг-Харбор в медицине. 7 (6): a025486. Дои:10.1101 / cshperspect.a025486. ЧВК 5453383. PMID 28242785.
- ^ Штурм, А. (2006). «Манипулирование гепатоцитами хозяина малярийным паразитом для доставки в синусоиды печени». Наука. 313 (5791): 1287–1290. Bibcode:2006Научный ... 313.1287S. Дои:10.1126 / science.1129720. PMID 16888102.
- ^ а б Cowman, Алан Ф .; Крабб, Брендан С. (2006). «Вторжение малярийных паразитов в красные кровяные тельца». Клетка. 124 (4): 755–766. Дои:10.1016 / j.cell.2006.02.006. PMID 16497586.
- ^ «Электронный модуль против малярии - СИНХРОНИЧНОСТЬ».
- ^ а б «Электронный модуль от малярии - АСЕКСУАЛЬНЫЕ ЭРИТРОЦИТИЧЕСКИЕ СТАДИИ».
- ^ Читать, М .; Sherwin, T .; Holloway, S.P .; Gull, K .; Хайд, Дж. Э. (1993). «Организация микротрубочек, визуализированная с помощью иммунофлуоресцентной микроскопии во время эритроцитарной шизогонии в Плазмодий falciparum и исследование посттрансляционных модификаций тубулина паразита ». Паразитология. 106 (3): 223–232. Дои:10,1017 / с0031182000075041.
- ^ Arnot, D.E .; Ronander, E .; Бенгтссон, Д. К. (2011). "Развитие внутриэритроцитарного клеточного цикла Плазмодий falciparum и роль центриолярных бляшек в асинхронном митотическом делении во время шизогонии ". Int. J. Parasitol. 41 (1): 71–80. Дои:10.1016 / j.ijpara.2010.07.012. PMID 20816844.
- ^ а б c d е Трампуз, Андрей; Jereb, Matjaz; Музлович, Игорь; Прабху, Раджеш М. (2003). «Клинический обзор: тяжелая форма малярии». Критический уход. 7 (4): 315–23. Дои:10.1186 / cc2183. ЧВК 270697. PMID 12930555.
- ^ Талман, Артур М; Домарль, Оливье; Маккензи, Ф; Арье, Фредерик; Роберт, Винсент (2004). «Гаметоцитогенез: половое созревание Плазмодий falciparum". Журнал Малярии. 3 (1): 24. Дои:10.1186/1475-2875-3-24. ЧВК 497046. PMID 15253774.
- ^ Бартолони, А; Заммарчи, L (2012). «Клинические аспекты неосложненной и тяжелой малярии». Средиземноморский журнал гематологии и инфекционных заболеваний. 4 (1): e2012026. Дои:10.4084 / MJHID.2012.026. ЧВК 3375727. PMID 22708041.
- ^ Д'Ортенцио, E; Годино, N; Фонтане, А; Houze, S; Бушо, О; Матерон, S; Ле Бра, Дж (2008). "Продолжительный Плазмодий falciparum инфекция у иммигрантов, Париж ". Возникающие инфекционные заболевания. 14 (2): 323–326. Дои:10.3201 / eid1402.061475. ЧВК 2600192. PMID 18258132.
- ^ Sinden, R.E .; Canning, E. U .; Bray, R. S .; Смолли, М. Э. (1978). «Развитие гаметоцитов и гамет в Плазмодий falciparum". Труды Королевского общества B: биологические науки. 201 (1145): 375–399. Bibcode:1978RSPSB.201..375S. Дои:10.1098 / rspb.1978.0051. PMID 27809.
- ^ Рунгсивонгсе, Джараспорн; Розенберг, Рональд (1991). «Число спорозоитов, продуцируемых отдельными ооцистами малярии». Американский журнал тропической медицины и гигиены. 45 (5): 574–577. Дои:10.4269 / ajtmh.1991.45.574. PMID 1951866.
- ^ Байер, JC; Onyango, FK; Корос, JK; Рамадан, М; Ogwang, R; Wirtz, RA; Koech, DK; Робертс, CR (1991). «Количественное определение спорозоитов малярии, передаваемых in vitro во время слюноотделения дикими афротропическими анофелесами». Медицинская и ветеринарная энтомология. 5 (1): 71–9. Дои:10.1111 / j.1365-2915.1991.tb00523.x. PMID 1768903.
- ^ а б Чакраварти, Сумана; Кокберн, Ян А; Кук, Салих; Оверстрит, Майкл Джи; Саччи, Джон Б. Завала, Фидель (2007). «CD8 + Т-лимфоциты, защищающие от малярии на стадии печени, размещаются в лимфатических узлах, дренирующих кожу». Природа Медицина. 13 (9): 1035–1041. Дои:10,1038 / нм 1628. PMID 17704784.
- ^ Хопп, Кристина С .; Синнис, Фотини (2015). «Врожденная и адаптивная реакция на слюну комаров и спорозоиты Plasmodium в коже». Летопись Нью-Йоркской академии наук. 1342 (1): 37–43. Bibcode:2015НЯСА1342 ... 37Ч. Дои:10.1111 / nyas.12661. ЧВК 4405444. PMID 25694058.
- ^ Gomes, Pollyanna S .; Бхардвадж, Джйоти; Ривера-Корреа, Хуан; Фрейре-де-Лима, Селио Дж .; Морро, Александр (2016). «Стратегии иммунного побега от малярийных паразитов». Границы микробиологии. 7: e1617. Дои:10.3389 / fmicb.2016.01617. ЧВК 5066453. PMID 27799922.
- ^ Артаванис-Цаконас, К; Тонгрен, JE; Райли, EM (август 2003 г.). «Война между малярийным паразитом и иммунной системой: иммунитет, иммунорегуляция и иммунопатология». Клиническая и экспериментальная иммунология. 133 (2): 145–152. Дои:10.1046 / j.1365-2249.2003.02174.x. ЧВК 1808775. PMID 12869017.

- ^ а б Флоренс, Лоуренс; Уошберн, Майкл П .; Рейн, Дж. Дейл; Энтони, Роберт М .; Грейнджер, Мунира; Хейнс, Дж. Дэвид; Мох, Дж. Кэтлин; Muster, Nemone; и другие. (3 октября 2002 г.). "Протеомный взгляд на Плазмодий falciparum жизненный цикл". Природа. 419 (6906): 520–526. Bibcode:2002Натура.419..520F. Дои:10.1038 / природа01107. PMID 12368866.
- ^ Керами, Карла; Фреверт, Юте; Синнис, Фотини; Такач, Бела; Клавихо, Педро; Сантос, Мануэль Дж .; Нуссенцвейг, Виктор (1992). "Базолатеральный домен плазматической мембраны гепатоцита несет рецепторы для белка циркумспорозоита Плазмодий falciparum спорозоиты ». Клетка. 70 (6): 1021–1033. Дои:10.1016/0092-8674(92)90251-7. PMID 1326407.
- ^ Балдаччи, Патриция; Менар, Роберт (2004). «Неуловимый спорозоит малярии у млекопитающего-хозяина». Молекулярная микробиология. 54 (2): 298–306. Дои:10.1111 / j.1365-2958.2004.04275.x. PMID 15469504.
- ^ Vaughan, Ashley M .; Aly, Ahmed S.I .; Каппе, Стефан Х. (2008). «Инфекция на преэритроцитарной стадии малярийных паразитов: скольжение и сокрытие». Клеточный хозяин и микроб. 4 (3): 209–218. Дои:10.1016 / j.chom.2008.08.010. ЧВК 2610487. PMID 18779047.
- ^ Сатчвелл, Т. Дж. (2016). "Рецепторы инвазии эритроцитов для Плазмодий falciparum: новое и старое ". Трансфузионная медицина. 26 (2): 77–88. Дои:10.1111 / tme.12280. HDL:1983 / 2945cc98-49e8-4c37-a392-88e35fab588c. PMID 26862042.
- ^ Лалчхандама, Холринг (2017). "Плазмодий falciparum белок мембраны эритроцита 1 ". WikiJournal of Медицина. 4 (1): 1–8. Дои:10.15347 / wjm / 2017.004.
- ^ Дондорп AM, Понгпонратн Э., Белый Нью-Джерси (февраль 2004 г.). «Снижение микроциркуляторного кровотока при тяжелой форме малярии, вызванной falciparum: патофизиология и электронно-микроскопическая патология». Acta Trop. 89 (3): 309–17. Дои:10.1016 / j.actatropica.2003.10.004. PMID 14744557.
- ^ а б Моя-Альварес, Виолетта; Абеллана, Роза; Раскладушка, Мишель (2014). «Малярия, связанная с беременностью, и малярия у младенцев: старая проблема с нынешними последствиями». Журнал Малярии. 13 (1): 271. Дои:10.1186/1475-2875-13-271. ЧВК 4113781. PMID 25015559.
- ^ Куртис, Афина П .; Прочтите, Дженнифер С .; Джеймисон, Дениз Дж. (2014). «Беременность и инфекции». Медицинский журнал Новой Англии. 370 (23): 2211–2218. Дои:10.1056 / NEJMra1213566. ЧВК 4459512. PMID 24897084.
- ^ Пипераки, E.T .; Дайкос, Г.Л. (2016). «Малярия в Европе: новая угроза или незначительная неприятность?». Клиническая микробиология и инфекции. 22 (6): 487–493. Дои:10.1016 / j.cmi.2016.04.023. PMID 27172807.
- ^ Bousema, T .; Дракли, К. (2011). «Эпидемиология и инфекционность Плазмодий falciparum и Плазмодий вивакс Гаметоциты в отношении борьбы с малярией и ее ликвидации ». Обзоры клинической микробиологии. 24 (2): 377–410. Дои:10.1128 / CMR.00051-10. ЧВК 3122489. PMID 21482730.
- ^ Гринвуд, Дэвид (1992). «Хининовое соединение». Журнал антимикробной химиотерапии. 30 (4): 417–427. Дои:10.1093 / jac / 30.4.417. PMID 1490916.
- ^ Кауфман, Теодоро С .; Руведа, Эдмундо А. (28 января 2005 г.). «В поисках хинина: те, кто выиграл битвы, и те, кто выиграл войну». Angewandte Chemie International Edition. 44 (6): 854–885. Дои:10.1002 / anie.200400663. PMID 15669029.
- ^ Тодд, Л .; Корнфорт, Дж .; Т., А. Р .; С., Дж. У. (1981). "Роберт Бернс Вудворд. 10 апреля 1917-8 июля 1979". Биографические воспоминания членов Королевского общества. 27: 628–695. Дои:10.1098 / rsbm.1981.0025.
- ^ Бисфэм, В. Н. (1941). «Токсические реакции после использования атабрина при малярии 1». Американский журнал тропической медицины и гигиены. s1-21 (3): 455–459. Дои:10.4269 / ajtmh.1941.s1-21.455.
- ^ Су, Синь-Чжуань; Миллер, Луи Х. (2015). «Открытие артемизинина и Нобелевская премия по физиологии и медицине». Наука Китай Науки о жизни. 58 (11): 1175–1179. Дои:10.1007 / s11427-015-4948-7. ЧВК 4966551. PMID 26481135.
- ^ а б c d е ж грамм час я Руководство по лечению малярии, второе издание Авторы: ВОЗ. Количество страниц: 194. Дата публикации: 2010. Языки: английский. ISBN 978-92-4-154792-5
- ^ Матущевский, Кай (2017). «Вакцины против малярии - еще долгий путь». Журнал FEBS. Онлайн (16): S0264–410X (16) 30982–3. Дои:10.1111 / фев.14107. PMID 28500775.
- ^ Махмуди, Шима; Кешаварц, Хоссейн (2017). «Эффективность испытания вакцины против малярии RTS, S / AS01 фазы 3: необходимость альтернативного плана развития». Человеческие вакцины и иммунотерапевтические препараты. 13 (9): 2098–2101. Дои:10.1080/21645515.2017.1295906. ЧВК 5612527. PMID 28272979.
- ^ Де Флора, S; Ла Маэстра, S (2015). «Эпидемиология рака инфекционного происхождения и стратегии профилактики». Журнал профилактической медицины и гигиены. 56 (1): E15–20. Дои:10.15167 / 2421-4248 / jpmh2015.56.1.470. ЧВК 4718340. PMID 26789827.

- ^ Бувар, Вероник; Баан, Роберт; Straif, Курт; Гроссе, Янн; Секретан, Беатрис; Гиссасси, Фатиха Эль; Бенбрахим-Таллаа, Ламия; Гуха, Нила; и другие. (2009). «Обзор канцерогенов человека - Часть B: биологические агенты». Ланцет онкологии. 10 (4): 321–322. Дои:10.1016 / S1470-2045 (09) 70096-8. PMID 19350698.
- ^ Гесер, А .; Brubaker, G .; Дрейпер, К. (1989). «Влияние программы подавления малярии на заболеваемость африканской лимфомой Беркитта». Американский журнал эпидемиологии. 129 (4): 740–752. Дои:10.1093 / oxfordjournals.aje.a115189. PMID 2923122.
- ^ Райчани, Юлий; Szenthe, Kalman; Банати, Ференц; Сзатмари, Сьюзен (2014). "Обзор иммуногенных белков вируса Эпштейна-Барра (EBV) и их эпитопов: значение для подготовки вакцины". Последние патенты на открытие противоинфекционных препаратов. 9 (1): 62–76. Дои:10.2174 / 1574891X09666140828114812. PMID 25164057.
- ^ Ван, Юянь; Банерджи, Шувомой; Дин, Линь; Цай, Чанкун; Вэй, Фанг; Цай, Цилян (2017). «Регуляторная роль фосфорилирования белков в раковых заболеваниях, связанных с гаммагерпесвирусом человека». Virologica Sinica. 32 (5): 357–368. Дои:10.1007 / s12250-017-4081-9. PMID 29116588.
- ^ ван Тонг, Хоанг; Бриндли, Пол Дж .; Мейер, Кристиан Г .; Велаван, Тирумалайсами П. (2017). «Паразитарная инфекция, канцерогенез и злокачественные новообразования человека». EBioMedicine. 15: 12–23. Дои:10.1016 / j.ebiom.2016.11.034. ЧВК 5233816. PMID 27956028.

- ^ Торли-Лоусон, Дэвид; Deitsch, Kirk W .; Duca, Karen A .; Торгбор, Чарльз; Нолл, Лаура Дж (2016). "Связь между Плазмодий falciparum Малярия и эндемическая лимфома Беркитта - новый взгляд на загадку 50-летней давности ». Патогены PLOS. 12 (1): e1005331. Дои:10.1371 / journal.ppat.1005331. ЧВК 4721646. PMID 26794909.

- ^ Квятковский Д.П. (2005). «Как малярия повлияла на геном человека и чему человеческая генетика может научить нас о малярии». Американский журнал генетики человека. 77 (2): 171–92. Дои:10.1086/432519. ЧВК 1224522. PMID 16001361.

- ^ Хедрик П.В. (2011). «Популяционная генетика устойчивости к малярии у людей». Наследственность. 107 (4): 283–304. Дои:10.1038 / hdy.2011.16. ЧВК 3182497. PMID 21427751.

- ^ Свекла, EA (1946). «Серповидно-клеточная анемия в районе Баловале в Северной Родезии». Восточноафриканский медицинский журнал. 23: 75–86. PMID 21027890.
- ^ Хедрик, П. В. (2011). «Популяционная генетика устойчивости к малярии у людей». Наследственность. 107 (4): 283–304. Дои:10.1038 / hdy.2011.16. ЧВК 3182497. PMID 21427751.
- ^ Хотиванич, К; Удомсангпетч, R; Паттанапаньясат, К. Чиеракул, З; Симпсон, Дж; Looareesuwan, S; Белый, N (2002). «Гемоглобин E: сбалансированный полиморфизм, защищающий от высоких паразитемий и, следовательно, от тяжелой малярии, вызванной P. falciparum». Кровь. 100 (4): 1172–6. Дои:10.1182 / blood.V100.4.1172.h81602001172_1172_1176. PMID 12149194.
- ^ Верра, Федерика; Симпор, Жак; Warimwe, George M .; Tetteh, Kevin K .; Ховард, Тевис; Osier, Faith H.A .; Bancone, Germana; Авеллино, Памела; и другие. (3 октября 2007 г.). «Роль гемоглобина C и S в приобретенном иммунитете против Плазмодий falciparum Малярия ». PLoS ONE. 2 (10): e978. Bibcode:2007PLoSO ... 2..978V. Дои:10.1371 / journal.pone.0000978. ЧВК 1991593. PMID 17912355.
дальнейшее чтение
- Колумбийские ученые разрабатывают вычислительный инструмент для обнаружения Плазмодий falciparum (на испанском)
- Эллисон, A.C. (февраль 1954 г.). «Защита, обеспечиваемая серповидно-клеточной характеристикой против субтертийной малярийной инфекции». Br Med J. 1 (4857): 290–4. Дои:10.1136 / bmj.1.4857.290. ЧВК 2093356. PMID 13115700.
- Эллисон, AC (1964). «Полиморфизм и естественный отбор в человеческих популяциях». Холодная весна Харб. Symp. Quant. Биол. 29: 137–49. Дои:10.1101 / sqb.1964.029.01.018. PMID 14278460.
- Холера, Р; Бриттен Нью-Джерси; Gillrie MR; и другие. (Январь 2008 г.). «Нарушение цитоадгезии эритроцитов, инфицированных Plasmodium falciparum, содержащих серповидный гемоглобин». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 105 (3): 991–6. Bibcode:2008PNAS..105..991C. Дои:10.1073 / pnas.0711401105. ЧВК 2242681. PMID 18192399.
- Mockenhaupt, FP; Ehrhardt, S; Otchwemah, R; и другие. (Май 2004 г.). «Ограниченное влияние вариантов гемоглобина на аллели msp1 и msp2 Plasmodium falciparum при симптоматической малярии». Пер. R. Soc. Троп. Med. Hyg. 98 (5): 302–10. Дои:10.1016 / j.trstmh.2003.10.001. PMID 15109555.
- Робертс, Ларри С .; Яновы, Джон (2005). Основы паразитологии (7-е изд.). McGraw-Hill Education (выпуски ISE). ISBN 978-0-07-111271-0.
внешняя ссылка
| Scholia имеет тема профиль для Плазмодий falciparum. |
- Информация о видах малярии в CDC
- Интернет-атлас медицинской паразитологии
- Профиль вида в Энциклопедии жизни
- Таксономия в UniProt
- Профиль ученых против малярии
- Случай клинической идентификации 1
- Случай клинической идентификации 2
- Информация о геноме в институте Wellcome Trust Sanger
- PlasmoDB: Ресурс генома плазмодия
- GeneDB Информация о гене Plasmodium falciparum
- Геном
- Браузер UCSC Plasmodium Falciparum
- Информация о генах в Киотском университете