MyoD - MyoD
MyoD, также известный как белок для определения миобластов 1[5], это белок у животных, который играет важную роль в регулировании дифференциация мышц. MyoD, обнаруженный в лаборатории Гарольд М. Вайнтрауб,[6] принадлежит к семейству белков, известных как миогенные регуляторные факторы (MRF).[7] Эти bHLH (основная спираль петля спираль) факторы транскрипции действуют последовательно в миогенной дифференцировке. Члены семейства MRF позвоночных включают MyoD1, Myf5, миогенин, и MRF4 (Myf6). В беспозвоночные животные, обычно обнаруживается единственный белок MyoD.
MyoD - один из самых ранних маркеров миогенной приверженности. MyoD выражается на крайне низких и практически неопределяемых уровнях в состоянии покоя. спутниковые ячейки, но экспрессия MyoD активируется в ответ на физическую нагрузку или повреждение мышечной ткани. Действие MyoD на сателлитные клетки зависит от дозы; высокая экспрессия MyoD подавляет обновление клеток, способствует терминальной дифференцировке и может вызывать апоптоз. Хотя MyoD свидетельствует о приверженности миобластов, развитие мышц не происходит резко у мутантов мышей, лишенных гена MyoD. Вероятно, это связано с функциональной избыточностью Myf5 и / или Mrf4. Тем не менее, комбинация MyoD и Myf5 жизненно важна для успеха миогенез.[8][9]
История
MyoD был клонирован с помощью функционального анализа формирования мышц, описанного в Cell в 1987 году Дэвисом, Вайнтраубом и Лассаром. Впервые он был описан как ядерный фосфопротеин в 1988 г. Тапскоттом, Дэвисом, Тайером, Ченгом, Вайнтраубом и Лассаром в Наука. Исследователи экспрессировали комплементарную ДНК (кДНК) мышиного белка MyoD в разных клеточных линиях (фибробласт и адипобласт ) и обнаружил, что MyoD преобразовал их в миогенные клетки.[6][10] В следующем году та же исследовательская группа провела несколько тестов, чтобы определить структуру и функцию белка, подтвердив их первоначальное предположение, что активный центр белка состоит из спирали петли спирали (теперь называемой основная спираль петля спираль ) для димеризации, а основной сайт выше этого участка bHLH способствовал связыванию ДНК только после того, как он стал димер белка.[11] MyoD с тех пор является активной областью исследований, поскольку о многих аспектах его функции известно относительно мало.
Функция
Функция MyoD в разработке - совершать мезодерма клетки к клону скелетных миобластов, а затем регулировать это постоянное состояние. MyoD также может регулировать восстановление мышц. MyoD мРНК уровни также повышаются в стареющих скелетных мышцах.
Одним из основных действий MyoD является удаление клеток из клеточный цикл (остановка распространение для остановки терминального клеточного цикла в дифференцированных миоцитах) за счет усиления транскрипции стр.21 и миогенин. MyoD ингибируется циклинзависимыми киназами (CDK ). CDK, в свою очередь, ингибируются p21. Таким образом, MyoD усиливает свою активность в клетке прямым образом.
Устойчивая экспрессия MyoD необходима для сохранения экспрессии генов, связанных с мышцами.[12]
MyoD также является важным эффектором для фенотипа быстро сокращающихся мышечных волокон (типы IIA, IIX и IIB).[13][14]
Механизмы
MyoD - это фактор транскрипции а также может направлять хроматин ремоделирование путем связывания с мотивом ДНК, известным как Электронная коробка. MyoD, как известно, взаимодействует с сотнями мышечных генов. промоутеры и разрешить миобласт распространение. Хотя это не совсем понятно, сейчас считается, что MyoD функционирует как главный регулятор миогенеза в ассоциации включения / выключения, опосредованной KAP1 (KRAB [Krüppel-like associated box] -associated protein 1). фосфорилирование.[15] KAP1 локализован в генах, связанных с мышцами, в миобластах наряду с MyoD и Mef2 (фактор усилителя транскрипции миоцитов). Здесь он служит каркасом и набирает коактиваторы. p300 и LSD1, в дополнение к нескольким корепрессорам, которые включают G9a и Гистоновая деацетилаза HDAC1. Следствием этого привлечения коактиватора / корепрессора является подавление промотирования участков мышечных генов. Когда киназа MSK1 фосфорилирует KAP1, корепрессоры, ранее связанные с каркасом, высвобождаются, позволяя MyoD и Mef2 активировать транскрипцию.[16]
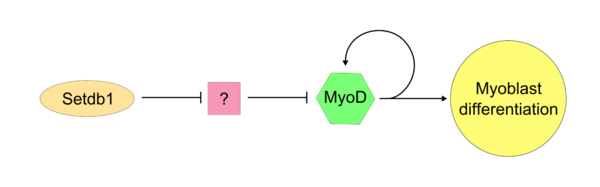
Как только «главный контроллер» MyoD станет активным, SETDB1 требуется для поддержания экспрессии MyoD в клетке. Setdb1, по-видимому, необходим для поддержания как экспрессии MyoD, так и генов, специфичных для мышечных тканей, поскольку снижение экспрессии Setdb1 приводит к серьезной задержке дифференцировки и детерминации миобластов.[17] В истощенных Setdb1 миобластах, которые лечат экзогенным MyoD, миобластическая дифференцировка успешно восстанавливается. В одной модели действия Setdb1 на MyoD Setdb1 репрессирует ингибитор MyoD. Этот неидентифицированный ингибитор, вероятно, действует конкурентно против MyoD во время типичной клеточной пролиферации. Доказательством этой модели является то, что уменьшение Setdb1 приводит к прямому ингибированию дифференцировки миобластов, которая может быть вызвана высвобождением неизвестного ингибитора MyoD.
Также было показано, что MyoD функционирует совместно с ген-супрессор опухоли, Ретинобластома (pRb), чтобы вызвать остановку клеточного цикла в окончательно дифференцированных миобластах.[18] Это достигается за счет регулирования Циклин, Циклин D1. Остановка клеточного цикла (при которой миобласты будут указывать на завершение миогенеза) зависит от непрерывной и стабильной репрессии циклина D1. Как MyoD, так и pRb необходимы для репрессии циклина D1, но вместо того, чтобы действовать непосредственно на циклин D1, они действуют на Fra-1, который непосредственно предшествует циклину D1. MyoD и pRb необходимы для репрессии Fra-1 (и, следовательно, циклина D1), поскольку одного MyoD или pRb недостаточно для индукции репрессии циклина D1 и, следовательно, остановки клеточного цикла. В интронике усилитель Fra-1 было обнаружено два консервативных сайта связывания MyoD. Существует совместное действие MyoD и pRb на интронный энхансер Fra-1, который подавляет энхансер, тем самым подавляя циклин D1 и, в конечном итоге, приводя к остановке клеточного цикла для терминально дифференцированных миобластов.[19]
Передача сигналов Wnt может влиять на MyoD
Было показано, что передача сигналов Wnt из соседних тканей индуцирует клетки в сомитах, которые получают эти сигналы Wnt, для экспрессии Pax3 и Pax7 в добавление к миогенные регуляторные факторы, включая Myf5 и MyoD. Конкретно, Wnt3a может напрямую вызывать экспрессию MyoD через цис-элемент взаимодействия с дистальным энхансером и ответным элементом Wnt.[20]. Wnt1 от дорсальной нервной трубки и Wnt6 /Wnt7a с поверхности эктодерма также участвовали в продвижении миогенеза в сомите; последние сигналы могут действовать в первую очередь через Myod.
В типичных мышцах взрослого человека в состоянии покоя (отсутствие физиологического стресса) экспрессируются специфические белки семейства Wnt: Wnt5a, Wnt5b, Wnt7a и Wnt4. Когда мышца повреждается (что требует регенерации), экспрессия Wnt5a, Wnt5b и Wnt7a увеличивается. Когда мышца завершает восстановление, Wnt7b и Wnt3a также увеличиваются. Это формирование паттерна экспрессии передачи сигналов Wnt при восстановлении мышечных клеток индуцирует дифференцировку клеток-предшественников, что снижает количество доступных сателлитных клеток. Wnt играет решающую роль в регуляции сателлитных клеток и старении скелетных мышц, а также регенерации. Известно, что Wnts активизируют экспрессию Myf5 и MyoD с помощью Wnt1 и Wnt7a. Wnt4, Wnt5 и Wnt6 увеличивают экспрессию обоих регуляторных факторов, но на более тонком уровне. Кроме того, MyoD увеличивает Wnt3a, когда миобласты подвергаются дифференцировке. Активируется ли MyoD с помощью Wnt посредством прямого нацеливания на цис-регуляцию или посредством непрямых физиологических путей, еще предстоит выяснить.[21]
Коактиваторы и репрессоры
IFRD1 является положительным кофактором MyoD, поскольку он взаимодействует с MyoD в индукции транскрипционной активности MEF2C (вытесняя HDAC4 из MEF2C); кроме того, IFRD1 также подавляет транскрипционную активность NF-κB, который, как известно, ингибирует накопление мРНК MyoD.[22][23]
NFATc1 представляет собой фактор транскрипции, который регулирует состав волокон, и переход от быстрых сокращений к медленным в результате аэробных упражнений требует экспрессии NFATc1. Экспрессия MyoD является ключевым фактором транскрипции в быстро сокращающихся волокнах, который ингибируется NFATc1 в окислительных типах волокон. NFATc1 действует, чтобы ингибировать MyoD посредством физического взаимодействия с N-концевым доменом активации MyoD, что приводит к ингибированию рекрутирования необходимого коактиватора транскрипции. p300. NFATc1 физически нарушает взаимодействие между MyoD и p300. Это устанавливает молекулярный механизм, с помощью которого типы волокон переходят in vivo посредством упражнений с противоположными ролями для NFATc1 и MyoD. NFATc1 контролирует этот баланс путем физического ингибирования MyoD в медленно сокращающихся мышечных волокнах.[24]

Гистондеацетилтрансфераза p300 функционирует с MyoD во взаимодействии, которое важно для образования мышечной трубки из фибробластов, которое опосредуется MyoD. Рекрутинг p300 - это процесс, ограничивающий скорость превращения фибробластов в мышечные трубки.[25] В дополнение к p300 MyoD, как известно, рекрутирует Set7, H3K4me1, H3K27ac, и RNAP II к энхансеру, с которым связан, и это позволяет активировать мышечный ген, который является специфическим для состояния и устанавливается путем набора MyoD. Однако эндогенный p300 необходим для функционирования MyoD, действуя как важный коактиватор. MyoD ассоциативно связывается с энхансерной областью в сочетании с «предполагаемым пионерским фактором», который помогает установить и поддерживать их обоих в определенной и неактивной конформации. После удаления или инактивации белка-заполнителя, связанного с энхансером, допускается привлечение дополнительной группы факторов транскрипции, которые помогают положительно регулировать активность энхансера, и это приводит к тому, что комплекс MyoD-фактор транскрипции-энхансер принимает транскрипционно активное состояние. .
Взаимодействия
MyoD было показано взаимодействовать с:
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000129152 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000009471 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "P15172 (MYOD1_HUMAN)". UniProtKB. Получено 17 июля 2019.
- ^ а б Дэвис Р.Л., Вайнтрауб Х., Лассар А.Б. (декабрь 1987 г.). «Экспрессия одной трансфицированной кДНК превращает фибробласты в миобласты». Клетка. 51 (6): 987–1000. Дои:10.1016 / 0092-8674 (87) 90585-Х. PMID 3690668. S2CID 37741454.
- ^ «Ген Entrez: миогенная дифференцировка MYOD1 1».
- ^ Рудницки М.А., Шнегельсберг П.Н., Стед Р.Х., Браун Т., Арнольд Г.Х., Яениш Р. (декабрь 1993 г.). «MyoD или Myf-5 необходимы для формирования скелетных мышц». Клетка. 75 (7): 1351–1359. Дои:10.1016 / 0092-8674 (93) 90621-В. PMID 8269513. S2CID 27322641.
- ^ Hinits Y, Williams VC, Sweetman D, Donn, TM, Ma TP, Moens CB, Hughes SM (октябрь 2011 г.). «Нарушение развития черепного скелета, летальность личинок и гаплонедостаточность у мутантных рыбок данио Myod». Dev. Биол. 358 (1): 102–112. Дои:10.1016 / j.ydbio.2011.07.015. ЧВК 3360969. PMID 21798255.
- ^ Тапскотт С.Дж., Дэвис Р.Л., Тайер М.Дж., Ченг П.Ф., Вайнтрауб Х., Лассар А.Б. (октябрь 1988 г.). «MyoD1: ядерный фосфопротеин, требующий области гомологии Myc для преобразования фибробластов в миобласты». Наука. 242 (4877): 405–511. Bibcode:1988Научный ... 242..405Т. Дои:10.1126 / science.3175662. PMID 3175662.
- ^ Дэвис Р.Л., Ченг П.Ф., Лассар А.Б., Тайер М., Тапскотт С., Вайнтрауб Н. (1989). «MyoD и achaete-scute: 4-5 аминокислот отличает миогенез от нейрогенеза». Симпозиумы принцессы Такамацу. 20: 267–278. PMID 2562185.
- ^ Фонг, А; Тапскотт, S (октябрь 2014 г.). «Программирование и перепрограммирование скелетных мышц». Текущее мнение в области генетики и развития. 23 (5): 568–573. Дои:10.1016 / j.gde.2013.05.002. ЧВК 3775946. PMID 23756045.
- ^ Хьюз С.М., Койши К., Рудницки М., Мэггс А.М. (январь 1997 г.). «Белок MyoD по-разному накапливается в быстрых и медленных волокнах скелетных мышц и необходим для нормального баланса типов волокон у грызунов». Мех Дев. 61 (1–2): 151–163. Дои:10.1016 / S0925-4773 (96) 00631-4. PMID 9076685. S2CID 17769090.
- ^ Ehlers ML, Celona B, Black BL (сентябрь 2014 г.). «NFATc1 контролирует тип волокон скелетных мышц и является негативным регулятором активности MyoD». Отчеты по ячейкам. 8 (6): 1639–1648. Дои:10.1016 / j.celrep.2014.08.035. ЧВК 4180018. PMID 25242327.
- ^ Сингх К., Кассано М., Планета E, Себастьян С., Джанг С.М., Сохи Дж., Фаралли Х, Чой Дж., Юн HD, Дилворт Ф.Дж., Троно Д. (март 2015 г.). «Переключатель фосфорилирования KAP1 контролирует функцию MyoD во время дифференцировки скелетных мышц». Гены и развитие. 29 (5): 513–525. Дои:10.1101 / gad.254532.114. ЧВК 4358404. PMID 25737281.
- ^ Букингем, М. Ригби, П. (февраль 2014 г.). «Сети регуляции генов и механизмы транскрипции, которые контролируют миогенез». Клетка развития. 28 (3): 225–238. Дои:10.1016 / j.devcel.2013.12.020. PMID 24525185.
- ^ Сон YJ, Цой JH, Ли H (февраль 2015 г.). «Setdb1 необходим для миогенной дифференциации клеток миобластов C2C12 посредством поддержания экспрессии MyoD». Молекулы и клетки. 38 (4): 362–372. Дои:10.14348 / molcells.2015.2291. ЧВК 4400312. PMID 25715926.
- ^ Раджаби Х.Н., Такахаши С., Юэн М.Э. (август 2014 г.). «Белок ретинобластомы и MyoD действуют вместе, чтобы влиять на репрессию Fra-1 и, в свою очередь, циклина D1 во время остановки терминального клеточного цикла, связанного с миогенезом». Журнал биологической химии. 289 (34): 23417–23427. Дои:10.1074 / jbc.M113.532572. ЧВК 4156083. PMID 25006242.
- ^ Милевская, М; Грабец, К; Grzelkowska-Kowalczyk, K (май 2014 г.). «[Взаимодействие сигнальных путей пролиферации и дифференцировки в миогенезе]». Postepy Hig Med Dosw. 68: 516–526. Дои:10.5604/17322693.1101617. PMID 24864103.
- ^ Pan YC, Wang XW, Teng HF, Wu YJ, Chang HC, Chen SL (февраль 2015 г.). «Сигнальные пути Wnt3a активируют экспрессию MyoD, воздействуя на цис-элементы внутри и снаружи его дистального энхансера». Отчеты по бионауке. 35 (2): 1–12. Дои:10.1042 / BSR20140177. ЧВК 4370097. PMID 25651906.
- ^ Motohashi, N .; Асакура, Ацуши (январь 2014 г.). «Неоднородность и самообновление мышечных сателлитных клеток». Границы клеточной биологии и биологии развития. 2 (1): 1. Дои:10.3389 / fcell.2014.00001. ЧВК 4206996. PMID 25364710.
- ^ Микели Л., Леонарди Л., Конти Ф, Буанне П., Кану Н., Карузо М., Тироне Ф. (март 2005 г.). «PC4 коактивирует MyoD, снимая опосредованное гистондеацетилазой 4 ингибирование фактора усиления миоцитов 2C». Мол. Клетка. Биол. 25 (6): 2242–59. Дои:10.1128 / MCB.25.6.2242-2259.2005. ЧВК 1061592. PMID 15743821.
- ^ Микели Л., Леонарди Л., Конти Ф, Мареска Дж., Колизингари С., Маттей Е., Лира С. А., Фариоли-Веккиоли С., Карузо М., Тироне Ф. (февраль 2011 г.). «PC4 / Tis7 / IFRD1 стимулирует регенерацию скелетных мышц и участвует в дифференцировке миобластов в качестве регулятора MyoD и NF-kappaB». J. Biol. Chem. 286 (7): 5691–707. Дои:10.1074 / jbc.M110.162842. ЧВК 3037682. PMID 21127072.
- ^ Федерация, А; Брэднер, Дж; Мейснер, А (март 2014 г.). «Использование малых молекул в репрограммировании соматических клеток». Тенденции в клеточной биологии. 24 (3): 179–187. Дои:10.1016 / j.tcb.2013.09.011. ЧВК 3943685. PMID 24183602.
- ^ Сарторелли, V; Хуанг, Дж; Хамамори, Y; Кедес, Л. (февраль 1997 г.). «Молекулярные механизмы миогенной коактивации p300: прямое взаимодействие с доменом активации MyoD и с MADS-боксом MEF2C». Молекулярная клеточная биология. 17 (2): 1010–1026. Дои:10.1128 / mcb.17.2.1010. ЧВК 231826. PMID 9001254.
- ^ Бенгал Э., Рансоне Л., Шарфманн Р., Дварки В.Дж., Тапскотт С.Дж., Вайнтрауб Х., Верма И.М. (февраль 1992 г.). «Функциональный антагонизм между белками c-Jun и MyoD: прямая физическая ассоциация». Клетка. 68 (3): 507–19. Дои:10.1016 / 0092-8674 (92) 90187-ч. PMID 1310896. S2CID 44966899.
- ^ Полесская А., Нагибнева И., Дюке А., Бенгалия Е, Робин П., Харель-Беллан А. (август 2001 г.). «Взаимодействие между ацетилированным MyoD и бромодоменом CBP и / или p300». Мол. Клетка. Биол. 21 (16): 5312–20. Дои:10.1128 / MCB.21.16.5312-5320.2001. ЧВК 87255. PMID 11463815.
- ^ а б Сарторелли В., Хуанг Дж., Хамамори Ю., Кедес Л. (февраль 1997 г.). «Молекулярные механизмы миогенной коактивации p300: прямое взаимодействие с доменом активации MyoD и с MADS-боксом MEF2C». Мол. Клетка. Биол. 17 (2): 1010–26. Дои:10.1128 / mcb.17.2.1010. ЧВК 231826. PMID 9001254.
- ^ Kong Y, Flick MJ, Kudla AJ, Konieczny SF (август 1997 г.). «Мышечный протеин LIM способствует миогенезу за счет усиления активности MyoD». Мол. Клетка. Биол. 17 (8): 4750–60. Дои:10.1128 / mcb.17.8.4750. ЧВК 232327. PMID 9234731.
- ^ Чжан Дж. М., Чжао X, Вэй К., Патерсон Б. М. (декабрь 1999 г.). «Прямое ингибирование активности киназы G (1) cdk с помощью MyoD способствует прерыванию клеточного цикла миобластов и терминальной дифференцировке». EMBO J. 18 (24): 6983–93. Дои:10.1093 / emboj / 18.24.6983. ЧВК 1171761. PMID 10601020.
- ^ Чжан Дж. М., Вэй К., Чжао Х, Патерсон Б. М. (февраль 1999 г.). «Сцепление клеточного цикла и миогенеза через циклин D1-зависимое взаимодействие MyoD с cdk4». EMBO J. 18 (4): 926–33. Дои:10.1093 / emboj / 18.4.926. ЧВК 1171185. PMID 10022835.
- ^ Рейно Э. Г., Лейбович М. П., Тинтиньяк Л. А., Пельпель К., Гийе М., Лейбович С. А. (июнь 2000 г.). «Стабилизация MyoD путем прямого связывания с p57 (Kip2)». J. Biol. Chem. 275 (25): 18767–76. Дои:10.1074 / jbc.M907412199. PMID 10764802.
- ^ Лау П., Бейли П., Даухан Д.Х., Маскат Дж. Э. (январь 1999 г.). «Экзогенная экспрессия доминантно-негативного вектора RORalpha1 в мышечных клетках нарушает дифференцировку: RORalpha1 напрямую взаимодействует с p300 и myoD». Нуклеиновые кислоты Res. 27 (2): 411–20. Дои:10.1093 / nar / 27.2.411. ЧВК 148194. PMID 9862959.
- ^ Puri PL, Iezzi S, Stiegler P, Chen TT, Schiltz RL, Muscat GE, Giordano A, Kedes L, Wang JY, Sartorelli V (октябрь 2001 г.). «Гистоновые деацетилазы I класса последовательно взаимодействуют с MyoD и pRb во время скелетного миогенеза». Мол. Клетка. 8 (4): 885–97. Дои:10.1016 / с1097-2765 (01) 00373-2. PMID 11684023.
- ^ а б Mal A, Sturniolo M, Schiltz RL, Ghosh MK, Harter ML (апрель 2001 г.). «Роль гистондеацетилазы HDAC1 в модулировании транскрипционной активности MyoD: ингибирование миогенной программы». EMBO J. 20 (7): 1739–53. Дои:10.1093 / emboj / 20.7.1739. ЧВК 145490. PMID 11285237.
- ^ Гаркавцев И., Козин С.В., Чернова О., Сюй Л., Винклер Ф., Браун Э., Барнетт Г.Х., Джайн Р.К. (март 2004 г.). «Предполагаемый белок-супрессор опухоли ING4 регулирует рост опухоли мозга и ангиогенез». Природа. 428 (6980): 328–32. Bibcode:2004Натура.428..328Г. Дои:10.1038 / природа02329. PMID 15029197. S2CID 4427531.
- ^ а б c Langlands K, Yin X, Anand G, Prochownik EV (август 1997). «Дифференциальные взаимодействия белков Id с факторами транскрипции основной спирали, петли, спирали». J. Biol. Chem. 272 (32): 19785–93. Дои:10.1074 / jbc.272.32.19785. PMID 9242638.
- ^ Финкель Т., Дык Дж., Ферон ER, Данг CV, Томаселли Г.Ф. (январь 1993 г.). «Обнаружение и модуляция in vivo белок-белковых взаимодействий спираль-петля-спираль». J. Biol. Chem. 268 (1): 5–8. PMID 8380166.
- ^ Гупта К., Ананд Г., Инь Икс, Роща Л., Проховник Е.В. (март 1998 г.). «Mmip1: новый белок лейциновой молнии, который отменяет подавляющее действие членов семьи Mad на c-myc». Онкоген. 16 (9): 1149–59. Дои:10.1038 / sj.onc.1201634. PMID 9528857.
- ^ McLoughlin P, Ehler E, Carlile G, Licht JD, Schäfer BW (октябрь 2002 г.). «Только LIM-белок DRAL / FHL2 взаимодействует с белком цинковых пальцев при промиелоцитарном лейкозе и является корепрессором». J. Biol. Chem. 277 (40): 37045–53. Дои:10.1074 / jbc.M203336200. PMID 12145280.
- ^ Ling MT, Chiu YT, Lee TK, Leung SC, Fung MK, Wang X, Wong KF, Wong YC (сентябрь 2008 г.). «Id-1 индуцирует протеасомозависимую деградацию белка HBX». J. Mol. Биол. 382 (1): 34–43. Дои:10.1016 / j.jmb.2007.06.020. PMID 18674781.
- ^ Чен С.М., Краут Н., Гроудин М., Вайнтрауб Н. (сентябрь 1996 г.). «I-mf, новый миогенный репрессор, взаимодействует с членами семьи MyoD». Клетка. 86 (5): 731–41. Дои:10.1016 / s0092-8674 (00) 80148-8. PMID 8797820. S2CID 16252710.
- ^ Ленорман Дж. Л., Бенаюн Б., Гийе М., Вандромм М., Лейбович М. П., Лейбович С. А. (февраль 1997 г.). «Mos активирует миогенную дифференцировку, способствуя гетеродимеризации белков MyoD и E12». Мол. Клетка. Биол. 17 (2): 584–93. Дои:10.1128 / mcb.17.2.584. ЧВК 231783. PMID 9001211.
- ^ Гу В., Шнайдер Дж., Кондорелли Дж., Каушал С., Махдави В., Надаль-Жинард Б. (февраль 1993 г.). «Взаимодействие миогенных факторов и белка ретинобластомы опосредует обязательство и дифференцировку мышечных клеток». Клетка. 72 (3): 309–24. Дои:10.1016 / 0092-8674 (93) 90110-с. PMID 8381715. S2CID 21581966.
- ^ Froeschlé A, Alric S, Kitzmann M, Carnac G, Auradé F, Rochette-Egly C, Bonnieu A (июль 1998 г.). "Рецепторы ретиноевой кислоты и мышечные белки b-HLH: партнеры в миогенезе, индуцированном ретиноидами". Онкоген. 16 (26): 3369–78. Дои:10.1038 / sj.onc.1201894. PMID 9692544.
- ^ Катаока Ю., Мацумура И., Эдзоэ С., Наката С., Такигава Е., Сато Ю., Кавасаки А., Йокота Т., Накадзима К., Фелсани А., Канакура И. (ноябрь 2003 г.). «Взаимное ингибирование между MyoD и STAT3 в регуляции роста и дифференцировки миобластов». J. Biol. Chem. 278 (45): 44178–87. Дои:10.1074 / jbc.M304884200. PMID 12947115.
- ^ Maleki SJ, Royer CA, Hurlburt BK (июнь 1997 г.). «Гетеродимеры MyoD-E12 и гомодимеры MyoD-MyoD одинаково стабильны». Биохимия. 36 (22): 6762–7. Дои:10.1021 / bi970262m. PMID 9184158.
внешняя ссылка
- MyoD + белок в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Обзор всей структурной информации, доступной в PDB за UniProt: P10085 (Белок определения миобластов мыши 1) на PDBe-KB.