Клеточный цикл - Cell cycle

В клеточный цикл, или же цикл клеточного деления, - это серия событий, происходящих в клетка которые заставляют его делиться на две дочерние клетки. Эти события включают дублирование его ДНК (Репликация ДНК ) и некоторые из его органеллы, а затем разделение его цитоплазмы и других компонентов на две дочерние клетки в процессе, называемом деление клеток.
В клетках с ядрами (эукариоты ), (т.е. животное, растение, грибковый, и протист клеток) клеточный цикл делится на два основных этапа: межфазный и митотический (M) фаза (включая митоз и цитокинез ). Во время интерфазы клетка растет, накапливая питательные вещества, необходимые для митоза, и реплицирует свою ДНК и некоторые из своих органелл. Во время митотической фазы реплицированные хромосомы, органеллы и цитоплазма разделяются на две новые дочерние клетки. Чтобы обеспечить правильную репликацию клеточных компонентов и деления, существуют механизмы контроля, известные как контрольные точки клеточного цикла после каждого из ключевых шагов цикла, которые определяют, может ли клетка перейти к следующей фазе.
В клетках без ядер (прокариоты ), (т.е. бактерии и археи ), клеточный цикл делится на периоды B, C и D. Период B длится от конца деления клетки до начала репликации ДНК. Репликация ДНК происходит в период C. Период D относится к стадии между окончанием репликации ДНК и расщеплением бактериальной клетки на две дочерние клетки.[1]
Цикл клеточного деления - это жизненно важный процесс, с помощью которого одноклеточные оплодотворенная яйцеклетка развивается в зрелый организм, а также в процессе волосы, кожа, кровяные клетки, и немного внутренние органы обновляются. После деления клетки каждая из дочерних клеток начинает свое межфазный нового цикла. Хотя различные стадии интерфазы обычно морфологически не различимы, каждая фаза клеточного цикла имеет отдельный набор специализированных биохимических процессов, которые подготавливают клетку к инициации клеточного деления.
Фазы
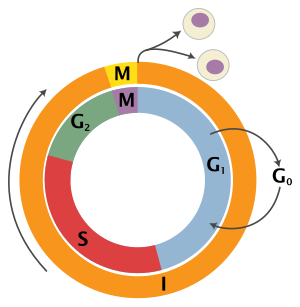
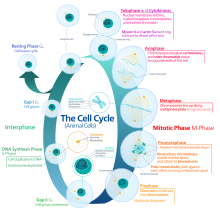
Цикл эукариотических клеток состоит из четырех различных фаз: грамм1 фаза, S фаза (синтез), грамм2 фаза (вместе известные как межфазный ) и Фаза M (митоз и цитокинез). М-фаза сама по себе состоит из двух тесно связанных процессов: митоза, в котором ядро клетки делится, и цитокинез, в котором клетки цитоплазма делится, образуя две дочерние клетки. Активация каждой фазы зависит от правильного развития и завершения предыдущей. Считается, что клетки, которые временно или обратимо прекратили делиться, вошли в состояние покоя, называемое грамм0 фаза.
| Состояние | Фаза | Сокращение | Описание |
|---|---|---|---|
| Отдыхает | Разрыв 0 | грамм0 | Фаза, когда клетка вышла из цикла и перестала делиться. |
| Межфазный | Разрыв 1 | грамм1 | Ячейки увеличиваются в размере в промежутке 1. грамм1 пропускной пункт механизм управления гарантирует, что все готово к ДНК синтез. |
| Синтез | S | Репликация ДНК происходит во время этой фазы. | |
| Разрыв 2 | грамм2 | Во время разрыва между синтезом ДНК и митозом клетка будет продолжать расти. В грамм2 пропускной пункт Механизм управления гарантирует, что все готово к переходу в фазу М (митоз) и делению. | |
| Деление клеток | Митоз | M | На этом этапе рост клеток останавливается, и клеточная энергия сосредотачивается на упорядоченном делении на две дочерние клетки. КПП в середине митоза (Контрольная точка метафазы ) гарантирует, что клетка готова к полному делению клетки. |
После деления клетки каждая из дочерних клеток начинает свое межфазный нового цикла. Хотя различные стадии интерфазы обычно морфологически не различимы, каждая фаза клеточного цикла имеет отдельный набор специализированных биохимических процессов, которые подготавливают клетку к инициации клеточного деления.
грамм0 фаза (покой)
грамм0 это фаза покоя, когда клетка вышла из цикла и перестала делиться. Клеточный цикл начинается с этой фазы. Непролиферативные (неделящиеся) клетки в многоклеточных эукариоты обычно входят в покоящуюся G0 состояние от G1 и может оставаться в покое в течение долгих периодов времени, возможно, бесконечно (как это часто бывает для нейроны ). Это очень характерно для клеток, которые полностью дифференцированный. Некоторые клетки входят в G0 фаза полупостоянно и считается постмитотической, например, некоторые клетки печени, почек и желудка. Многие клетки не попадают в G0 и продолжают делиться на протяжении всей жизни организма, например эпителиальными клетками.
Слово «постмитотический» иногда используется для обозначения обоих неподвижный и дряхлый клетки. Клеточное старение происходит в ответ на повреждение ДНК и внешний стресс и обычно представляет собой остановку в G1. Клеточное старение может сделать потомство клетки нежизнеспособным; часто это биохимическая альтернатива самоуничтожению такой поврежденной клетки путем апоптоз.
Межфазный
Интерфаза - это серия изменений, которые происходят во вновь образованной клетке и ее ядре, прежде чем она снова станет способной к делению. Его также называют подготовительной фазой или интермитозом. Обычно интерфаза длится не менее 91% от общего времени, необходимого для клеточного цикла.
Интерфаза протекает в три этапа, G1, S и G2, за которым следует цикл митоза и цитокинеза. Содержимое ядерной ДНК клетки дублируется во время S-фазы.
грамм1 фаза (первая фаза роста или фаза постмитотического разрыва)
Первая фаза в интерфазе, от конца предыдущей фазы M до начала синтеза ДНК, называется грамм1 (G указывает зазор). Ее еще называют фазой роста. Во время этой фазы биосинтетическая активность клетки, которая значительно замедляется во время фазы M, возобновляется с высокой скоростью. Продолжительность G1 сильно варьирует даже среди разных клеток одного и того же вида.[3] На этой фазе клетка увеличивает запас белков, увеличивает количество органелл (таких как митохондрии, рибосомы) и увеличивается в размерах. В G1 фаза, ячейка имеет три варианта.
- Чтобы продолжить клеточный цикл и войти S фаза
- Остановите клеточный цикл и введите грамм0 этап прохождения дифференциация.
- Стать арестованным в G1 фаза, следовательно, он может войти в G0 фазы или повторно войти в клеточный цикл.
Решающая точка называется пропускной пункт (Точка ограничения ). Этот пропускной пункт называется точкой ограничения или СТАРТ и регулируется G1/ S циклины, вызывающие переход от G1 к фазе S. Прохождение через G1 checkpoint фиксирует ячейку на деление.
S-фаза (репликация ДНК)
Последующий S фаза начинается когда Синтез ДНК начинается; когда он будет завершен, все хромосомы реплицированы, т.е. каждая хромосома состоит из двух сестринских хроматиды. Таким образом, во время этой фазы количество ДНК в клетке удвоилось, хотя плоидность и количество хромосом не изменилось. Нормы РНК транскрипция и синтез белка очень низкие на этом этапе. Исключением является гистон производство, большая часть которого происходит в фазе S.[4][5][6]
грамм2 фаза (рост)
грамм2 фаза происходит после репликации ДНК и представляет собой период синтеза белка и быстрого роста клеток для подготовки клетки к митозу. В этой фазе микротрубочки начинают реорганизовываться, образуя веретено (препрофаза). Прежде чем перейти к митотическая фаза, ячейки должны быть проверены на G2контрольная точка на предмет повреждений ДНК в хромосомах. G2 контрольная точка в основном регулируется опухолевым белком p53. Если ДНК повреждена, p53 либо восстанавливает ДНК, либо запускает апоптоз клетки. Если p53 дисфункциональный или мутировавший, клетки с поврежденной ДНК могут продолжать клеточный цикл, что приводит к развитию рака.
Митотическая фаза (разделение хромосом)
Относительно краткий Фаза M состоит из ядерного подразделения (кариокинез ). Это относительно короткий период клеточного цикла. М-фаза сложна и строго регулируется. Последовательность событий разделена на фазы, соответствующие завершению одного набора действий и началу следующего. Эти фазы последовательно называются:
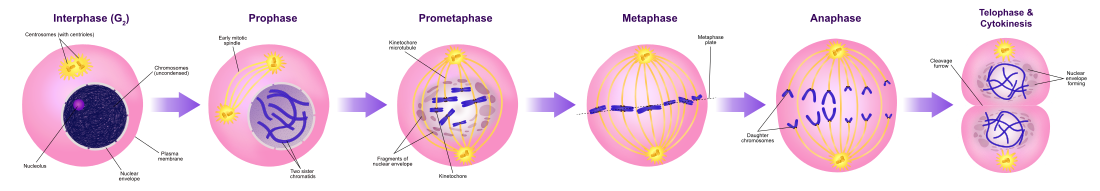
Митоз - это процесс, при котором эукариотический ячейка отделяет хромосомы в его ядро клетки на два одинаковых набора в двух ядрах.[7] В процессе митоза пары хромосомы конденсироваться и прикрепляться к микротрубочки которые тянут сестринские хроматиды к противоположным сторонам клетки.[8]
Митоз возникает исключительно в эукариотический клеток, но происходит по-разному у разных видов. Например, клетки животных проходят «открытый» митоз, когда ядерная оболочка распадается до разделения хромосом, а грибы Такие как Aspergillus nidulans и Saccharomyces cerevisiae (дрожжи ) проходят «закрытый» митоз, при котором хромосомы делятся внутри неповрежденного ядро клетки.[9]
Фаза цитокинеза (разделение всех компонентов клетки)
Сразу за митозом следует цитокинез, разделяющий ядра, цитоплазма, органеллы и клеточная мембрана на две клетки, содержащие примерно равные доли этих клеточных компонентов. Митоз и цитокинез вместе определяют разделение материнской клетки на две дочерние клетки, генетически идентичные друг другу и своей родительской клетке. Это составляет примерно 10% клеточного цикла.
Поскольку цитокинез обычно происходит в сочетании с митозом, «митоз» часто используется взаимозаменяемо с «фазой М». Однако есть много клеток, в которых митоз и цитокинез протекают отдельно, образуя отдельные клетки с множеством ядер в процессе, называемом эндорепликация. Это особенно заметно среди грибы и слизевые формы, но встречается в разных группах. Даже у животных цитокинез и митоз могут происходить независимо, например, на определенных этапах плодовая муха эмбриональное развитие.[10] Ошибки в митозе могут привести к гибели клеток из-за апоптоз или вызвать мутации это может привести к рак.
Регуляция эукариотического клеточного цикла

Регуляция клеточного цикла включает процессы, имеющие решающее значение для выживания клетки, включая обнаружение и восстановление генетических повреждений, а также предотвращение неконтролируемого деления клеток. Молекулярные события, которые контролируют клеточный цикл, упорядочены и направлены; то есть каждый процесс происходит последовательно, и невозможно «повернуть вспять» цикл.
Роль циклинов и CDK
 Нобелевский лауреат Пол Медсестра |  Нобелевский лауреат Тим Хант |
Два ключевых класса регуляторных молекул, циклины и циклин-зависимые киназы (CDK), определяют продвижение клетки через клеточный цикл.[11] Лиланд Х. Хартвелл, Р. Тимоти Хант, и Пол М. Медсестра выиграл 2001 Нобелевская премия по физиологии и медицине за открытие этих центральных молекул.[12] Многие из генов, кодирующих циклины и CDK, являются консервированный среди всех эукариот, но в целом более сложные организмы имеют более сложные системы контроля клеточного цикла, которые включают больше отдельных компонентов. Многие из соответствующих генов были впервые идентифицированы при изучении дрожжей, особенно Saccharomyces cerevisiae;[13] генетическая номенклатура дрожжей дублирует многие из этих генов CDC (для «цикла деления клетки»), за которым следует идентификационный номер, например cdc25 или же cdc20.
Циклины образуют регуляторные субъединицы, а CDK - каталитические субъединицы активированного гетеродимер; циклины не обладают каталитической активностью, а CDK неактивны в отсутствие циклина-партнера. При активации связанным циклином CDK выполняют общую биохимическую реакцию, называемую фосфорилирование который активирует или инактивирует белки-мишени для организации скоординированного входа в следующую фазу клеточного цикла. Различные комбинации циклин-CDK определяют следующие белки-мишени. CDK конститутивно экспрессируются в клетках, тогда как циклины синтезируются на определенных стадиях клеточного цикла в ответ на различные молекулярные сигналы.[14]
Общий механизм взаимодействия циклин-CDK
Получив промитотический внеклеточный сигнал, G1 циклин-CDK комплексы становятся активными для подготовки клетки к S-фазе, способствуя экспрессии факторы транскрипции которые, в свою очередь, способствуют экспрессии S-циклинов и ферментов, необходимых для Репликация ДНК. G1 Комплексы циклин-CDK также способствуют деградации молекул, которые действуют как ингибиторы S-фазы, направляя их на убиквитинирование. После того, как белок убиквитинирован, он подвергается протеолитической деградации с помощью протеасома. Однако результаты недавнего исследования динамики транскрипции E2F на уровне отдельных клеток показывают, что роль активностей G1 циклин-CDK, в частности циклина D-CDK4 / 6, заключается в настройке времени, а не в обязательстве входа в клеточный цикл. .[15]
Активные комплексы S-циклин-CDK фосфорилируют белки, составляющие пререпликационные комплексы собран во время G1 фаза на ДНК источники репликации. Фосфорилирование служит двум целям: для активации каждого уже собранного пререпликационного комплекса и для предотвращения образования новых комплексов. Это гарантирует, что каждая часть клетки геном будет воспроизведен один раз и только один раз. Причина предотвращения пробелов в репликации довольно ясна, потому что дочерние клетки, в которых отсутствуют все или часть важных генов, погибнут. Однако по причинам, связанным с число копий гена эффекты, наличие дополнительных копий определенных генов также вредно для дочерних клеток.
Митотические комплексы циклин-CDK, которые синтезируются, но инактивируются во время S и G2 фазы, способствуют инициированию митоз за счет стимуляции нижестоящих белков, участвующих в конденсации хромосом и митотическое веретено сборка. Критический комплекс, активируемый при этом процессе, - это убиквитинлигаза известный как комплекс, способствующий анафазе (APC), который способствует деградации структурных белков, связанных с хромосомным кинетохора. APC также нацеливается на митотические циклины для деградации, обеспечивая протекание телофазы и цитокинеза.[16]
Специфическое действие комплексов циклин-CDK
Циклин D представляет собой первый циклин, продуцируемый клетками, которые входят в клеточный цикл, в ответ на внеклеточные сигналы (например, факторы роста ). Уровни циклина D остаются низкими в покоящихся клетках, которые не размножаются. Кроме того, CDK4 / 6 и CDK2 также неактивны, потому что CDK4 / 6 связаны INK4 члены семьи (например, p16), ограничивающие активность киназы. Между тем, комплексы CDK2 ингибируются белками CIP / KIP, такими как p21 и p27,[17] Когда клетке пора войти в клеточный цикл, который запускается митогенными стимулами, уровни циклина D повышаются. В ответ на этот триггер циклин D связывается с существующими CDK4 / 6, образуя активный комплекс циклин D-CDK4 / 6. Комплексы циклин D-CDK4 / 6, в свою очередь, монофосфорилируют ретинобластома протеин восприимчивости (Руб. ) в pRb. Нефосфорилированный Rb-опухолевый супрессор индуцирует выход из клеточного цикла и поддерживает остановку G0 (старение).[18]
В последние несколько десятилетий получила широкое распространение модель, согласно которой белки pRB инактивируются с помощью фосфорилирования, опосредованного циклином D-Cdk4 / 6. Rb имеет 14+ потенциальных сайтов фосфорилирования. Циклин D-Cdk 4/6 прогрессивно фосфорилирует Rb до гиперфосфорилированного состояния, что запускает диссоциацию pRB–E2F комплексы, тем самым вызывая экспрессию гена клеточного цикла G1 / S и переход в S-фазу.[19]
Однако научные наблюдения из недавнего исследования показывают, что Rb присутствует в трех типах изоформ: (1) нефосфорилированный Rb в состоянии G0; (2) монофосфорилированный Rb, также называемый «гипофосфорилированным» или «частично» фосфорилированным Rb в раннем состоянии G1; и (3) неактивный гиперфосфорилированный Rb в позднем состоянии G1.[20][21][22] В ранних клетках G1 монофосфорилированный Rb выходит в виде 14 различных изоформ, каждая из которых имеет различные изоформы. E2F сродство связывания.[22] Было обнаружено, что Rb связан с сотнями различных белков.[23] и идея о том, что разные монофосфорилированные изоформы Rb имеют разных белковых партнеров, была очень привлекательной.[24] Недавнее сообщение подтвердило, что монофосфорилирование контролирует ассоциацию Rb с другими белками и генерирует различные функциональные формы Rb.[25] Все различные монофосфорилированные изоформы Rb ингибируют программу транскрипции E2F и способны останавливать клетки в G1-фазе. Важно, что разные монофосфорилированные формы RB обладают разными транскрипционными выходами, которые выходят за пределы регуляции E2F.[25]
В общем, связывание pRb с E2F ингибирует экспрессию гена-мишени E2F некоторых переходных генов G1 / S и S, включая Велосипеды E-типа. Частичное фосфорилирование RB дерепрессирует Rb-опосредованное подавление экспрессии гена-мишени E2F, начинает экспрессию циклина E. Молекулярный механизм, который вызывает переключение клетки на активацию циклина E, в настоящее время неизвестен, но поскольку уровни циклина E повышаются, образуется активный комплекс циклин E-CDK2, в результате чего Rb инактивируется гиперфосфорилированием.[22] Гиперфосфорилированный Rb полностью диссоциирует от E2F, обеспечивая дальнейшую экспрессию широкого диапазона генов-мишеней E2F, необходимых для перехода клеток в S-фазу [1]. Недавно было идентифицировано, что циклин D-Cdk4 / 6 связывается с С-концевой альфа-спиральной областью Rb, которая отличается только от циклина D, а не с другими циклинами, циклин E, А и B.[26] Это наблюдение, основанное на структурном анализе фосфорилирования Rb, подтверждает, что Rb фосфорилируется на другом уровне посредством множественных комплексов Cyclin-Cdk. Это также делает возможной текущую модель одновременной инактивации, подобной переключателю, всех монофосфорилированных изоформ Rb посредством одного типа механизма гиперфосфорилирования Rb. Кроме того, мутационный анализ специфической Rb C-концевой спирали циклина D-Cdk 4/6 показывает, что нарушение связывания циклина D-Cdk 4/6 с Rb предотвращает фосфорилирование Rb, задерживает клетки в G1 и поддерживает функции Rb в супрессоре опухолей. .[26] Этот управляемый циклин-Cdk переходный механизм клеточного цикла управляет клеткой, зафиксированной в клеточном цикле, что делает возможной пролиферацию клеток. Рост раковых клеток часто сопровождается нарушением регуляции активности Cyclin D-Cdk 4/6.
Гиперфосфорилированный Rb диссоциирует от комплекса E2F / DP1 / Rb (который был связан с E2F чувствительные гены, эффективно «блокируя» их от транскрипции), активируя E2F. Активация E2F приводит к транскрипции различных генов, таких как циклин E, циклин А, ДНК-полимераза, тимидинкиназа и др. Полученный таким образом циклин E связывается с CDK2, образуя комплекс циклин E-CDK2, который выталкивает клетку из G1 в фазу S (G1/ S, который инициирует G2/ M переход).[27] Циклин Б -cdk1 активация комплекса вызывает поломку ядерная оболочка и начало профаза, и впоследствии его дезактивация заставляет клетку выходить из митоза.[14] Количественное исследование динамики транскрипции E2F на уровне отдельной клетки с использованием сконструированных флуоресцентных репортерных клеток обеспечило количественную основу для понимания логики управления входом в клеточный цикл, бросив вызов канонической модели из учебников. Гены, которые регулируют амплитуду накопления E2F, такие как Myc, определяют обязательность клеточного цикла и вступление в S-фазу. Активность G1 cyclin-CDK не является движущей силой входа в клеточный цикл. Вместо этого они в первую очередь настраивают время увеличения E2F, тем самым модулируя скорость прогрессирования клеточного цикла.[15]
Ингибиторы
Эндогенный

Два семейства генов, cip / kip (Белок, взаимодействующий с CDK / белок, ингибирующий киназу) семейство INK4a / ARF (Впогонщик Kinase 4 /Аальтернатива ридущий Frame), предотвращают развитие клеточного цикла. Поскольку эти гены играют важную роль в предотвращении опухоль формация, они известны как опухолевые супрессоры.
В cip / kip семья включает гены стр.21, стр. 27 и стр. 57. Они останавливают клеточный цикл в G1 фаза путем связывания и инактивации комплексов циклин-CDK. p21 активируется p53 (что, в свою очередь, вызвано повреждением ДНК, например, радиацией). p27 активируется трансформирующим фактором роста β (TGF β ), ингибитор роста.
В Семья INK4a / ARF включает p16INK4a, который связывается с CDK4 и останавливает клеточный цикл в G1 фаза и стр. 14АРФ который предотвращает деградацию p53.
Синтетический
Синтетические ингибиторы Cdc25 также могут быть полезны для остановки клеточного цикла и, следовательно, могут использоваться в качестве противоопухолевых и противораковых агентов.[28]
Многие раковые опухоли человека обладают гиперактивированной активностью Cdk 4/6.[29] Учитывая наблюдения за функциями циклина D-Cdk 4/6, ингибирование Cdk 4/6 должно приводить к предотвращению пролиферации злокачественной опухоли. Следовательно, ученые попытались изобрести синтетический ингибитор Cdk4 / 6, поскольку Cdk4 / 6 был охарактеризован как терапевтическая мишень для противоопухолевой эффективности. Три ингибитора Cdk4 / 6 - палбоциклиб, рибоциклиб, и абемациклиб - в настоящее время получено одобрение FDA для клинического использования для лечения запущенных или метастатический, гормон-рецептор-положительный (ЧСС-положительный, ЧСС +), HER2-отрицательный (HER2-) рак груди.[30][31] Например, палбоциклиб является перорально активным ингибитором CDK4 / 6, который продемонстрировал улучшенные результаты при ER-положительном / HER2-отрицательном распространенном раке молочной железы. Основной побочный эффект: нейтропения что можно контролировать, уменьшая дозу.[32]
Таргетная терапия Cdk4 / 6 будет лечить только типы рака, в которых экспрессируется Rb. Раковые клетки с потерей Rb обладают первичной резистентностью к ингибиторам Cdk4 / 6.
Сеть регуляции транскрипции
Текущие данные подтверждают, что полуавтономная транскрипционная сеть действует согласованно с аппаратом CDK-cyclin, чтобы регулировать клеточный цикл. Несколько исследований экспрессии генов в Saccharomyces cerevisiae идентифицировали 800–1200 генов, которые изменяют экспрессию в течение клеточного цикла.[13][33][34] Они транскрибируются на высоких уровнях в определенных точках клеточного цикла и остаются на более низких уровнях в течение остальной части цикла. Хотя набор идентифицированных генов различается между исследованиями из-за вычислительных методов и критериев, используемых для их идентификации, каждое исследование показывает, что большая часть генов дрожжей регулируется во времени.[35]
Многие периодически экспрессируемые гены управляются факторы транскрипции которые также периодически выражаются. Один скрининг нокаутов одного гена выявил 48 факторов транскрипции (около 20% всех несущественных факторов транскрипции), которые показывают дефекты прогрессирования клеточного цикла.[36] Полногеномные исследования с использованием высокопроизводительных технологий идентифицировали факторы транскрипции, которые связываются с промоторами дрожжевых генов, и сопоставление этих результатов с временными паттернами экспрессии позволило идентифицировать факторы транскрипции, которые управляют фазовой экспрессией генов.[33][37] Профили экспрессии этих факторов транскрипции управляются факторами транскрипции, пик которых наблюдается на предыдущей фазе, и вычислительные модели показали, что CDK-автономная сеть этих факторов транскрипции достаточна для создания устойчивых колебаний экспрессии генов).[34][38]
Экспериментальные данные также предполагают, что экспрессия генов может колебаться с периодом, наблюдаемым при делении клеток дикого типа, независимо от аппарата CDK. Орландо и другие. использовал микрочипы для измерения экспрессии набора из 1271 гена, который они определили как периодические, как в клетках дикого типа, так и в клетках, лишенных всех S-фаз и митотических циклинов (clb1,2,3,4,5,6). Из 1271 проанализированных генов 882 продолжали экспрессироваться в клетках с дефицитом циклина в то же время, что и в клетках дикого типа, несмотря на тот факт, что клетки с дефицитом циклина задерживаются на границе между грамм1 и S фаза. Однако 833 из исследованных генов изменили поведение между клетками дикого типа и мутантными клетками, что указывает на то, что эти гены, вероятно, прямо или косвенно регулируются механизмом CDK-циклин. Некоторые гены, которые продолжали вовремя экспрессироваться в мутантных клетках, также экспрессировались на разных уровнях в мутантных клетках и клетках дикого типа. Эти находки предполагают, что хотя транскрипционная сеть может колебаться независимо от осциллятора CDK-cyclin, они связаны способом, который требует обоих, чтобы гарантировать правильное время событий клеточного цикла.[34] Другая работа показывает, что фосфорилирование посттрансляционная модификация факторов транскрипции клеточного цикла посредством Cdk1 может изменять локализацию или активность факторов транскрипции, чтобы строго контролировать время действия генов-мишеней.[36][39][40]
В то время как осцилляторная транскрипция играет ключевую роль в прогрессировании клеточного цикла дрожжей, механизм CDK-cyclin работает независимо в раннем эмбриональном клеточном цикле. Перед переход средней бластулы, зиготическая транскрипция не происходит, и все необходимые белки, такие как циклины B-типа, транслируются с материнской нагрузки мРНК.[41]
Репликация ДНК и активность ориджина репликации ДНК
Анализ синхронизированных культур Saccharomyces cerevisiae в условиях, которые предотвращают инициацию репликации ДНК без задержки прогрессирования клеточного цикла, показали, что лицензирование ориджина снижает экспрессию генов с ориджином вблизи их 3'-концов, показывая, что нижележащие ориджины могут регулировать экспрессию вышестоящих генов.[42] Это подтверждает предыдущие прогнозы математического моделирования глобальной причинной координации между активностью источника репликации ДНК и экспрессией мРНК.[43][44][45] и показывает, что математическое моделирование данных микроматрицы ДНК можно использовать для правильного прогнозирования ранее неизвестных биологических способов регуляции.
Контрольно-пропускные пункты
Контрольные точки клеточного цикла используются клеткой для контроля и регулирования клеточного цикла.[46] Контрольные точки предотвращают развитие клеточного цикла в определенных точках, позволяя проверить необходимые фазовые процессы и восстановить Повреждение ДНК. Ячейка не может перейти к следующему этапу, пока не будут выполнены требования контрольной точки. Контрольные точки обычно состоят из сети регуляторных белков, которые контролируют и определяют продвижение клетки через различные стадии клеточного цикла.
Есть несколько контрольных точек, чтобы гарантировать, что поврежденная или неполная ДНК не передается дочерним клеткам. Существуют три основных контрольно-пропускных пункта: G1/ S КПП, G2Контрольная точка / M и контрольная точка метафазы (митоза). Еще одна контрольная точка - это контрольная точка Go, в которой ячейки проверяются на зрелость. Если клетки не смогут пройти эту контрольную точку, будучи еще не готовыми, они будут исключены из деления.
грамм1Переход / S является этапом, ограничивающим скорость в клеточном цикле, и также известен как точка ограничения.[14] Здесь клетка проверяет, достаточно ли у нее сырья для полной репликации ДНК (нуклеотидные основания, ДНК-синтаза, хроматин и т. Д.). Нездоровая или недоедающая клетка застрянет на этой контрольной точке.
G2Контрольная точка / M - это место, где клетка гарантирует, что у нее достаточно цитоплазмы и фосфолипидов для двух дочерних клеток. Но иногда, что более важно, он проверяет, подходящее ли время для репликации. Бывают ситуации, когда многие клетки должны реплицироваться одновременно (например, растущий эмбрион должен иметь симметричное распределение клеток, пока не достигнет перехода в середину бластулы). Это делается путем управления G2/ М КПП.
Контрольная точка метафазы - довольно незначительная контрольная точка, поскольку, когда клетка находится в метафазе, она совершает митоз. Однако это не значит, что это не важно. В этой контрольной точке клетка проверяет, сформировалось ли веретено и что все хромосомы выровнены по экватору веретена перед началом анафазы.[47]
Хотя это три «основных» контрольных точки, не все ячейки должны проходить через каждую из этих контрольных точек в указанном порядке для репликации. Многие виды рака вызваны мутациями, которые позволяют клеткам быстро проходить через различные контрольные точки или даже полностью пропускать их. Переход от S к M к S фазе почти последовательно. Поскольку эти клетки потеряли свои контрольные точки, любые мутации ДНК, которые могли произойти, игнорируются и передаются дочерним клеткам. Это одна из причин, по которой раковые клетки имеют тенденцию к экспоненциальному нарастанию мутаций. Помимо раковых клеток, многие полностью дифференцированные типы клеток больше не реплицируются, поэтому они покидают клеточный цикл и остаются в G0 до самой смерти. Таким образом устраняется необходимость в контрольно-пропускных пунктах сотовой связи. Также была предложена альтернативная модель ответа клеточного цикла на повреждение ДНК, известная как пострепликационная контрольная точка.
Регулирование контрольных точек играет важную роль в развитии организма. При половом размножении, когда происходит оплодотворение яйцеклетки, когда сперма связывается с яйцеклеткой, она высвобождает сигнальные факторы, которые уведомляют яйцеклетку о том, что она оплодотворена. Среди прочего, это побуждает оплодотворенный ооцит возвращаться из ранее спящего, G0, состояние обратно в клеточный цикл и на митотическую репликацию и деление.
p53 играет важную роль в запуске механизмов управления как на G1/ S и G2/ М КПП. В дополнение к p53, регуляторы контрольных точек активно исследуются на предмет их роли в росте и распространении рака.
Флуоресцентная визуализация клеточного цикла

Новаторская работа Ацуши Мияваки и его сотрудников разработала флуоресцентный индикатор клеточного цикла на основе убиквитинирования (FUCCI ), что позволяет флуоресценция визуализация клеточного цикла. Первоначально зеленый флуоресцентный белок, mAG, был слит с hGem (1/110) и оранжевым флуоресцентный белок (mKO2) был слит с hCdt1 (30/120). Обратите внимание, что эти слияния представляют собой фрагменты, содержащие сигнал ядерной локализации и убиквитинирование сайты для деградация, но не являются функциональными белками. В зеленый флуоресцентный белок производится во время S, G2, или фаза M и деградировала во время G0 или G1 фаза, а оранжевый флуоресцентный белок сделано во время G0 или G1 фазе и разрушается во время S, G2, или фаза М.[48] FUCCI в дальнем красном и ближнем инфракрасном диапазоне был разработан с использованием цианобактерии -полученный флуоресцентный белок (smURFP ) и бактериофитохром -полученный флуоресцентный белок (фильм найден по этой ссылке ).[49]
Роль в образовании опухоли
Нарушение регуляции компонентов клеточного цикла может привести к опухоль формирование.[50] Как упоминалось выше, когда некоторые гены, такие как ингибиторы клеточного цикла, РБ, p53 и др. мутируют, они могут вызвать неконтролируемое размножение клетки, образуя опухоль. Хотя продолжительность клеточного цикла в опухолевых клетках равна или превышает продолжительность нормального клеточного цикла, доля клеток, которые находятся в активном делении клеток (по сравнению с покоящимися клетками в G0 фаза) в опухолях намного выше, чем в нормальной ткани.[нужна цитата ] Таким образом, наблюдается чистое увеличение количества клеток, поскольку количество клеток, погибших в результате апоптоза или старения, остается неизменным.
Клетки, которые активно подвергаются клеточному циклу, являются мишенями для лечения рака, поскольку ДНК относительно экспонируется во время деления клеток и, следовательно, подвержена повреждению наркотики или же радиация. Этот факт используется при лечении рака; с помощью процесса, известного как разрушение удаляется значительная масса опухоли, которая вытесняет значительное количество оставшихся опухолевых клеток из G0 к G1 фаза (из-за повышенной доступности питательных веществ, кислорода, факторов роста и т. д.). Лучевая или химиотерапия после процедуры удаления массы убивает эти клетки, которые только что вошли в клеточный цикл.[14]
Клетки млекопитающих с самым быстрым циклом в культуре, клетки крипт в кишечном эпителии, имеют время цикла от 9 до 10 часов. Стволовые клетки в коже покоящихся мышей могут иметь время цикла более 200 часов. Большая часть этой разницы связана с разной длиной G1, наиболее изменчивая фаза цикла. M и S не сильно различаются.
В целом клетки наиболее радиочувствительны в поздних M и G.2 фазы и наиболее устойчивы в поздней S фазе.
Для клеток с более длительным временем клеточного цикла и значительно большим G1 фазе, в конце G есть второй пик сопротивления.1.
Характер устойчивости и чувствительности коррелирует с уровнем сульфгидрильных соединений в клетке. Сульфгидрилы - это природные вещества, которые защищают клетки от радиационного повреждения, и, как правило, имеют самый высокий уровень S и самый низкий уровень около митоза.
Гомологичная рекомбинация (HR) - точный процесс для восстановление ДНК двухниточные разрывы. ЧСС практически отсутствует в Фаза G1, наиболее активен в S фаза, и снижается в G2/ М.[51] Негомологичное соединение концов, менее точный и более мутагенный процесс восстановления двухцепочечных разрывов, активен на протяжении всего клеточного цикла.
Смотрите также
- Сотовая модель
- Репликация эукариотической ДНК
- Комплекс распознавания происхождения
- Белок ретинобластомы
- Синхронная культура - синхронизация культур клеток
- Wee1
Рекомендации
- ^ Ван Дж. Д., Левин П. А. (ноябрь 2009 г.). «Метаболизм, рост клеток и цикл бактериальных клеток». Обзоры природы. Микробиология. 7 (11): 822–7. Дои:10.1038/nrmicro2202. ЧВК 2887316. PMID 19806155.
- ^ Купер GM (2000). "Chapter 14: The Eukaryotic Cell Cycle". Клетка: молекулярный подход (2-е изд.). Washington, D.C: ASM Press. ISBN 978-0-87893-106-4.
- ^ Smith JA, Martin L (April 1973). "Do cells cycle?". Труды Национальной академии наук Соединенных Штатов Америки. 70 (4): 1263–7. Bibcode:1973PNAS...70.1263S. Дои:10.1073/pnas.70.4.1263. ЧВК 433472. PMID 4515625.
- ^ Wu RS, Bonner WM (December 1981). "Separation of basal histone synthesis from S-phase histone synthesis in dividing cells". Клетка. 27 (2 Pt 1): 321–30. Дои:10.1016/0092-8674(81)90415-3. PMID 7199388. S2CID 12215040.
- ^ Nelson DM, Ye X, Hall C, Santos H, Ma T, Kao GD, et al. (Ноябрь 2002 г.). "Coupling of DNA synthesis and histone synthesis in S phase independent of cyclin/cdk2 activity". Молекулярная и клеточная биология. 22 (21): 7459–72. Дои:10.1128/MCB.22.21.7459-7472.2002. ЧВК 135676. PMID 12370293.
- ^ Cameron IL, Greulich RC (July 1963). "Evidence for an essentially constant duration of DNA synthesis in renewing epithelia of the adult mouse". Журнал клеточной биологии. 18: 31–40. Дои:10.1083/jcb.18.1.31. ЧВК 2106275. PMID 14018040.
- ^ Rubenstein, Irwin, and Susan M. Wick. "Cell." Справочный центр World Book Online. 2008. 12 January 2008 <«Архивная копия». Архивировано из оригинал 30 мая 2011 г.. Получено 10 июля 2009.CS1 maint: заархивированная копия как заголовок (связь)>
- ^ Maton A, Lahart D, Hopkins J, Warner MQ, Johnson S, Wright JD (1997). Клетки: строительные блоки жизни. Нью-Джерси: Прентис-Холл. стр.70–4. ISBN 978-0-13-423476-2.
- ^ Де Соуза С.П., Османи С.А. (сентябрь 2007 г.). «Митоз, не только открытый или закрытый». Эукариотическая клетка. 6 (9): 1521–7. Дои:10.1128 / EC.00178-07. ЧВК 2043359. PMID 17660363.
- ^ Лилли М.А., Дуронио Р.Дж. (апрель 2005 г.). «Новые данные о контроле клеточного цикла с помощью эндоцикла дрозофилы». Онкоген. 24 (17): 2765–75. Дои:10.1038 / sj.onc.1208610. PMID 15838513.
- ^ Nigg EA (June 1995). "Cyclin-dependent protein kinases: key regulators of the eukaryotic cell cycle". BioEssays. 17 (6): 471–80. Дои:10.1002/bies.950170603. PMID 7575488. S2CID 44307473.
- ^ "Пресс-релиз". Nobelprize.org.
- ^ а б Spellman PT, Sherlock G, Zhang MQ, Iyer VR, Anders K, Eisen MB, et al. (Декабрь 1998 г.). "Comprehensive identification of cell cycle-regulated genes of the yeast Saccharomyces cerevisiae by microarray hybridization". Молекулярная биология клетки. 9 (12): 3273–97. Дои:10.1091/mbc.9.12.3273. ЧВК 25624. PMID 9843569.
- ^ а б c d Robbins SL, Cotran RS (2004). Kumar V, Abbas AK, Fausto N (eds.). Pathological Basis of Disease. Эльзевир. ISBN 978-81-8147-528-2.
- ^ а б Dong P, Maddali MV, Srimani JK, Thélot F, Nevins JR, Mathey-Prevot B, You L (September 2014). "Division of labour between Myc and G1 cyclins in cell cycle commitment and pace control". Nature Communications. 5: 4750. Bibcode:2014NatCo...5.4750D. Дои:10.1038/ncomms5750. ЧВК 4164785. PMID 25175461.
- ^ Mahmoudi M, Azadmanesh K, Shokrgozar MA, Journeay WS, Laurent S (May 2011). "Effect of nanoparticles on the cell life cycle". Химические обзоры. 111 (5): 3407–32. Дои:10.1021/cr1003166. PMID 21401073.
- ^ Goel S, DeCristo MJ, McAllister SS, Zhao JJ (November 2018). "CDK4/6 Inhibition in Cancer: Beyond Cell Cycle Arrest". Тенденции в клеточной биологии. 28 (11): 911–925. Дои:10.1016/j.tcb.2018.07.002. ЧВК 6689321. PMID 30061045.
- ^ Burkhart DL, Sage J (September 2008). "Cellular mechanisms of tumour suppression by the retinoblastoma gene". Обзоры природы. Рак. 8 (9): 671–82. Дои:10.1038/nrc2399. ЧВК 6996492. PMID 18650841.
- ^ Морган Д.О. (2007). Клеточный цикл: принципы контроля. Лондон: New Science Press. ISBN 978-0-19-920610-0. OCLC 70173205.
- ^ Paternot S, Bockstaele L, Bisteau X, Kooken H, Coulonval K, Roger PP (February 2010). "Rb inactivation in cell cycle and cancer: the puzzle of highly regulated activating phosphorylation of CDK4 versus constitutively active CDK-activating kinase". Клеточный цикл. 9 (4): 689–99. Дои:10.4161/cc.9.4.10611. PMID 20107323.
- ^ Henley SA, Dick FA (March 2012). "The retinoblastoma family of proteins and their regulatory functions in the mammalian cell division cycle". Отделение клеток. 7 (1): 10. Дои:10.1186/1747-1028-7-10. ЧВК 3325851. PMID 22417103.
- ^ а б c Нарасимха AM, Каулич М., Шапиро Г.С., Чой Ю.Дж., Сицински П., Дауди С.Ф. (июнь 2014 г.). «Циклин D активирует опухолевый супрессор Rb путем монофосфорилирования». eLife. 3: e02872. Дои:10.7554 / eLife.02872. ЧВК 4076869. PMID 24876129.
- ^ Morris EJ, Dyson NJ (1 January 2001). Retinoblastoma protein partners. Достижения в исследованиях рака. 82. Академическая пресса. стр.1–54. Дои:10.1016/s0065-230x(01)82001-7. ISBN 9780120066827. PMID 11447760.
- ^ Dyson NJ (July 2016). "RB1: a prototype tumor suppressor and an enigma". Гены и развитие. 30 (13): 1492–502. Дои:10.1101/gad.282145.116. ЧВК 4949322. PMID 27401552.
- ^ а б Sanidas I, Morris R, Fella KA, Rumde PH, Boukhali M, Tai EC, et al. (Март 2019 г.). "A Code of Mono-phosphorylation Modulates the Function of RB". Молекулярная клетка. 73 (5): 985–1000.e6. Дои:10.1016/j.molcel.2019.01.004. ЧВК 6424368. PMID 30711375.
- ^ а б Topacio BR, Zatulovskiy E, Cristea S, Xie S, Tambo CS, Rubin SM, et al. (Май 2019). «Циклин D-Cdk4,6 управляет прогрессией клеточного цикла через C-концевую спираль белка ретинобластомы». Молекулярная клетка. 74 (4): 758–770.e4. Дои:10.1016 / j.molcel.2019.03.020. ЧВК 6800134. PMID 30982746.
- ^ Norbury C (1995). "Cdk2 protein kinase (vertebrates)". In Hardie DG, Hanks S (eds.). Protein kinase factsBook. Бостон: Academic Press. стр.184. ISBN 978-0-12-324719-3.
- ^ "Presentation on CDC25 PHOSPHATASES: A Potential Target for Novel Anticancer Agents". Архивировано из оригинал 3 марта 2016 г.. Получено 11 марта 2010.
- ^ Sherr CJ, Beach D, Shapiro GI (April 2016). "Targeting CDK4 and CDK6: From Discovery to Therapy". Открытие рака. 6 (4): 353–67. Дои:10.1158/2159-8290.cd-15-0894. ЧВК 4821753. PMID 26658964.
- ^ O'Leary B, Finn RS, Turner NC (July 2016). "Treating cancer with selective CDK4/6 inhibitors". Обзоры природы. Клиническая онкология. 13 (7): 417–30. Дои:10.1038/nrclinonc.2016.26. PMID 27030077. S2CID 23646632.
- ^ Bilgin B, Sendur MA, Şener Dede D, Akıncı MB, Yalçın B (September 2017). "A current and comprehensive review of cyclin-dependent kinase inhibitors for the treatment of metastatic breast cancer". Current Medical Research and Opinion. 33 (9): 1559–1569. Дои:10.1080/03007995.2017.1348344. PMID 28657360. S2CID 205542255.
- ^ Schmidt M, Sebastian M (August 2018). "Palbociclib-The First of a New Class of Cell Cycle Inhibitors". Последние результаты исследований рака. Fortschritte der Krebsforschung. Progres dans les Recherches Sur le Cancer. Последние результаты исследований рака. 211: 153–175. Дои:10.1007/978-3-319-91442-8_11. ISBN 978-3-319-91441-1. PMID 30069766.
- ^ а б Pramila T, Wu W, Miles S, Noble WS, Breeden LL (August 2006). "The Forkhead transcription factor Hcm1 regulates chromosome segregation genes and fills the S-phase gap in the transcriptional circuitry of the cell cycle". Гены и развитие. 20 (16): 2266–78. Дои:10.1101/gad.1450606. ЧВК 1553209. PMID 16912276.
- ^ а б c Orlando DA, Lin CY, Bernard A, Wang JY, Socolar JE, Iversen ES, et al. (Июнь 2008 г.). "Global control of cell-cycle transcription by coupled CDK and network oscillators". Природа. 453 (7197): 944–7. Bibcode:2008Natur.453..944O. Дои:10.1038/nature06955. ЧВК 2736871. PMID 18463633.
- ^ de Lichtenberg U, Jensen LJ, Fausbøll A, Jensen TS, Bork P, Brunak S (April 2005). "Comparison of computational methods for the identification of cell cycle-regulated genes". Биоинформатика. 21 (7): 1164–71. Дои:10.1093/bioinformatics/bti093. PMID 15513999.
- ^ а б White MA, Riles L, Cohen BA (February 2009). "A systematic screen for transcriptional regulators of the yeast cell cycle". Генетика. 181 (2): 435–46. Дои:10.1534/genetics.108.098145. ЧВК 2644938. PMID 19033152.
- ^ Lee TI, Rinaldi NJ, Robert F, Odom DT, Bar-Joseph Z, Gerber GK, et al. (Октябрь 2002 г.). "Transcriptional regulatory networks in Saccharomyces cerevisiae". Наука. 298 (5594): 799–804. Дои:10.1126/science.1075090. PMID 12399584. S2CID 4841222.
- ^ Simon I, Barnett J, Hannett N, Harbison CT, Rinaldi NJ, Volkert TL, et al. (September 2001). "Serial regulation of transcriptional regulators in the yeast cell cycle". Клетка. 106 (6): 697–708. Дои:10.1016/S0092-8674(01)00494-9. PMID 11572776. S2CID 9308235.
- ^ Sidorova JM, Mikesell GE, Breeden LL (December 1995). "Cell cycle-regulated phosphorylation of Swi6 controls its nuclear localization". Молекулярная биология клетки. 6 (12): 1641–58. Дои:10.1091/mbc.6.12.1641. ЧВК 301322. PMID 8590795.
- ^ Ubersax JA, Woodbury EL, Quang PN, Paraz M, Blethrow JD, Shah K, et al. (Октябрь 2003 г.). "Targets of the cyclin-dependent kinase Cdk1". Природа. 425 (6960): 859–64. Bibcode:2003Natur.425..859U. Дои:10.1038/nature02062. PMID 14574415. S2CID 4391711.
- ^ Морган Д.О. (2007). "2–3". Клеточный цикл: принципы контроля. Лондон: New Science Press. п. 18. ISBN 978-0-9539181-2-6.
- ^ Omberg L, Meyerson JR, Kobayashi K, Drury LS, Diffley JF, Alter O (October 2009). "Global effects of DNA replication and DNA replication origin activity on eukaryotic gene expression". Молекулярная системная биология. 5: 312. Дои:10.1038/msb.2009.70. ЧВК 2779084. PMID 19888207.
- ^ Alter O, Golub GH, Brown PO, Botstein D (2004). Deutscher MP, Black S, Boehmer PE, D'Urso G, Fletcher TM, Huijing F, Marshall A, Pulverer B, Renault B, Rosenblatt JD, Slingerland JM, Whelan WJ (eds.). "Novel Genome-Scale Correlation between DNA Replication and RNA Transcription During the Cell Cycle in Yeast is Predicted by Data-Driven Models" (PDF). Miami Nature Biotechnology Winter Symposium: Cell Cycle, Chromosomes and Cancer. Miami Beach, FL: University of Miami School of Medicine, vol. 15 (January 31 – February 4, 2004). Цитировать журнал требует
| журнал =(помощь) - ^ Alter O, Golub GH (November 2004). "Integrative analysis of genome-scale data by using pseudoinverse projection predicts novel correlation between DNA replication and RNA transcription". Труды Национальной академии наук Соединенных Штатов Америки. 101 (47): 16577–82. Bibcode:2004PNAS..10116577A. Дои:10.1073/pnas.0406767101. ЧВК 534520. PMID 15545604.
- ^ Omberg L, Golub GH, Alter O (November 2007). "A tensor higher-order singular value decomposition for integrative analysis of DNA microarray data from different studies". Труды Национальной академии наук Соединенных Штатов Америки. 104 (47): 18371–6. Bibcode:2007PNAS..10418371O. Дои:10.1073/pnas.0709146104. ЧВК 2147680. PMID 18003902.
- ^ Элледж SJ (декабрь 1996 г.). «Контрольные точки клеточного цикла: предотвращение кризиса идентичности». Наука. 274 (5293): 1664–72. Bibcode:1996 Наука ... 274.1664E. Дои:10.1126 / science.274.5293.1664. PMID 8939848. S2CID 39235426.
- ^ LeMaire-Adkins R, Radke K, Hunt PA (December 1997). "Lack of checkpoint control at the metaphase/anaphase transition: a mechanism of meiotic nondisjunction in mammalian females". Журнал клеточной биологии. 139 (7): 1611–9. Дои:10.1083/jcb.139.7.1611. ЧВК 2132649. PMID 9412457.
- ^ Sakaue-Sawano A, Kurokawa H, Morimura T, Hanyu A, Hama H, Osawa H, et al. (Февраль 2008 г.). "Visualizing spatiotemporal dynamics of multicellular cell-cycle progression". Клетка. 132 (3): 487–98. Дои:10.1016/j.cell.2007.12.033. PMID 18267078. S2CID 15704902.
- ^ Rodriguez EA, Tran GN, Gross LA, Crisp JL, Shu X, Lin JY, Tsien RY (September 2016). "A far-red fluorescent protein evolved from a cyanobacterial phycobiliprotein". Методы природы. 13 (9): 763–9. Дои:10.1038/nmeth.3935. ЧВК 5007177. PMID 27479328.
- ^ Champeris Tsaniras S, Kanellakis N, Symeonidou IE, Nikolopoulou P, Lygerou Z, Taraviras S (June 2014). "Licensing of DNA replication, cancer, pluripotency and differentiation: an interlinked world?". Семинары по клеточной биологии и биологии развития. 30: 174–80. Дои:10.1016/j.semcdb.2014.03.013. PMID 24641889.
- ^ Mao Z, Bozzella M, Seluanov A, Gorbunova V (September 2008). "DNA repair by nonhomologous end joining and homologous recombination during cell cycle in human cells". Клеточный цикл. 7 (18): 2902–6. Дои:10.4161/cc.7.18.6679. ЧВК 2754209. PMID 18769152.
дальнейшее чтение
- Морган Д.О. (2007). Клеточный цикл: принципы контроля. Лондон: Издается New Science Press совместно с Oxford University Press. ISBN 978-0-87893-508-6.
- Альбертс Б., Джонсон А., Льюис Дж, Рафф М., Робертс К., Уолтер П. (2008). «Глава 17». Молекулярная биология клетки (5-е изд.). Нью-Йорк: Наука Гарланд. ISBN 978-0-8153-4111-6.
- Кригер М., Скотт М.П., Мацудаира П.Т., Лодиш Х.Ф., Дарнелл Дж.Э., Зипурски Л., Кайзер С., Берк А. (2004). Молекулярная клеточная биология. Нью-Йорк: W.H. Фриман и CO. ISBN 978-0-7167-4366-8.
- Уотсон Дж. Д., Бейкер Т. А., Белл С. П., Ганн А., Левин М., Лосик Р. (2004). «Глава 7». Молекулярная биология гена (5-е изд.). Сан-Франциско: Пирсон / Бенджамин Каммингс. ISBN 978-0-8053-4642-8.
внешняя ссылка
 Эта статья включаетматериалы общественного достояния от NCBI документ: «Учебник по науке».
Эта статья включаетматериалы общественного достояния от NCBI документ: «Учебник по науке».- David Morgan's Seminar: Controlling the Cell Cycle
- The cell cycle & Cell death
- Transcriptional program of the cell cycle: high-resolution timing
- Cell cycle and metabolic cycle regulated transcription in yeast
- Cell Cycle Animation 1Lec.com
- Клеточный цикл
- Fucci:Using GFP to visualize the cell-cycle
- Science Creative Quarterly's overview of the cell cycle
- KEGG – Human Cell Cycle