Нандролон - Nandrolone
 | |
 | |
| Клинические данные | |
|---|---|
| Произношение | /ˈпæпdрəлoʊп/[1] |
| Торговые наименования | • Дека-дураболин (как ND ) • Дураболин (как АЭС ) • Многие другие (см. здесь ) |
| Другие имена | • 19-нортестостерон[2][3] • 10-нортестостерон • Estr-4-ен-17β-ол-3-он • Эстренолон • Эстренолон • 19-Норандрост-4-ен-17β-ол-3-он • Норандростенолон[2] • Нортестрионат[2] • Нортестонат[2] • Norandroone • SG-4341[2][3] |
| Беременность категория |
|
| Маршруты администрация | • Я инъекция (сложные эфиры ) • SC инъекция (сложные эфиры ) • Слезы (NS ) |
| Класс препарата | Андроген; Анаболический стероид; Прогестаген |
| Код УВД | |
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетический данные | |
| Биодоступность | • Устный: <3% (свиньи)[4] • Внутримышечный: высоко[5] |
| Метаболизм | Печень (снижение )[6][8] |
| Метаболиты | • 5α-дигидронандролон[6][7] • 19-норандростерон[6] • 19-норэтиохоланолон[6] • Конъюгаты[8] |
| Устранение период полураспада | • Нандролон: <4,3 часа[6] • ND (Я ): 6–12 дней[6][7][9] • АЭС: 2.7 дней[9] |
| Продолжительность действия | • ND (Я): 2–3 недели[7][10] • АЭС (Я): 5–7 дней[7][9] |
| Экскреция | Моча[6] |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.006.457 |
| Химические и физические данные | |
| Формула | C18ЧАС26О2 |
| Молярная масса | 274.404 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| (проверять) | |
Нандролон, также известный как 19-нортестостерон, является андроген и анаболический стероид (AAS), который используется в виде сложные эфиры Такие как нандролон деканоат (имя бренда Дека-дураболин) и фенилпропионат нандролона (имя бренда Дураболин).[2][11][7][12] Эфиры нандролона используются при лечении анемии, кахексия (синдром истощения), остеопороз, рак молочной железы, и по другим показаниям.[7] Они не используются устно и вместо этого даются инъекция в мышцу или же толстый.[7][12][13]
Побочные эффекты эфиров нандролона включают симптомы из маскулинизация подобно угревая сыпь, усиленный рост волос, голос меняется, и уменьшился сексуальное желание из-за его способности подавлять синтез эндогенного тестостерона, не будучи при этом достаточным андрогеном.[7] Они есть синтетический андрогены и анаболические стероиды и, следовательно, агонисты из рецептор андрогенов (AR), биологическая мишень андрогенов как тестостерон и дигидротестостерон (DHT).[7][14] Нандролон обладает сильным анаболический эффекты и слабые андрогенный эффекты, которые придают им мягкий профиль побочных эффектов и делают их особенно подходящими для использования женщинами и детьми.[7][14][15] Есть метаболиты нандролона, которые действуют как длительно действующие пролекарства в организме[7], Такие как 5α-дигидронандролон.
Сложные эфиры нандролона были впервые описаны и представлены для медицинского применения в конце 1950-х годов.[7] Они являются одними из наиболее широко используемых в мире ААС.[7] Помимо медицинского применения, сложные эфиры нандролона используются для улучшить телосложение и работоспособность, и считаются наиболее широко используемым ААС для таких целей.[7][16] Лекарства контролируемые вещества во многих странах немедицинское использование, как правило, незаконно.[7]
Медицинское использование
Сложные эфиры нандролона используются клинически, хотя все реже, для людей в катаболических состояниях с сильными ожогами, раком и СПИДом, и офтальмологический состав был доступен для поддержки заживления роговицы.[17]:134
Положительные эффекты эфиров нандролона включают рост мышц, стимуляцию аппетита и усиление эритроцит производство,[требуется медицинская цитата ] и плотность костной ткани.[18] Клинические исследования показали, что они эффективны при лечении анемия, остеопороз, и рак молочной железы.
Сульфат нандролона был использован в слеза формулировка как офтальмологический медикамент.[2][11]
Немедицинское использование
Эфиры нандролона используются для цели улучшения телосложения и производительности к конкурентный спортсмены, культуристы, и пауэрлифтеры.[7]
Побочные эффекты
Побочные эффекты эфиров нандролона включают маскулинизация среди прочего.[7] У женщин нандролон и эфиры нандролона сообщалось о повышении либидо, угревая сыпь, лица и Волосы на теле рост, голос меняется, и увеличение клитора.[19] Однако, как сообщается, маскулинизирующий эффект нандролона и его сложных эфиров слабее, чем у нандролона. тестостерон.[19] Также было обнаружено, что нандролон производит рост полового члена у мальчиков препубертатного возраста.[19] Аменорея и меноррагия были зарегистрированы как побочные эффекты нандролон ципионат.[19]
Нандролон теоретически может производить Эректильная дисфункция как побочный эффект, хотя в настоящее время нет клинических данных, подтверждающих это мнение.[20] Побочные эффекты высоких доз нандролона могут включать: сердечно-сосудистый токсичность а также гипогонадизм и бесплодие.[нужна цитата ] Нандролон может не производить выпадение волос на коже головы, хотя это тоже теоретически.[20]
Фармакология
Фармакодинамика
| Медикамент | Соотношениеа |
|---|---|
| Тестостерон | ~1:1 |
| Андростанолон (DHT) | ~1:1 |
| Метилтестостерон | ~1:1 |
| Метандриол | ~1:1 |
| Флуоксиместерон | 1:1–1:15 |
| Метандиенон | 1:1–1:8 |
| Дростанолон | 1:3–1:4 |
| Метенолон | 1:2–1:30 |
| Оксиметолон | 1:2–1:9 |
| Оксандролон | 1:3–1:13 |
| Станозолол | 1:1–1:30 |
| Нандролон | 1:3–1:16 |
| Этилэстренол | 1:2–1:19 |
| Норетандролон | 1:1–1:20 |
| Примечания: У грызунов. Сноски: а = Отношение андрогенной активности к анаболической. Источники: См. Шаблон. | |
Нандролон - это агонист АР, биологическая мишень из андрогены подобно тестостерон и DHT. В отличие от тестостерона и некоторых других ААС, нандролон не усиливается в андрогенных тканях, таких как скальп, кожа, и предстательная железа, следовательно, уменьшается вредное воздействие на эти ткани.[21] Это потому, что нандролон метаболизируется 5α-редуктаза к гораздо более слабому лиганду AR 5α-дигидронандролон (DHN), что уменьшило близость для рецептор андрогенов (AR) относительно нандролона in vitro и более слабый агонист AR потенция in vivo.[21] Отсутствие алкилирования на 17α-углероде резко снижает гепатотоксичный потенциал нандролона.[требуется медицинская цитата ] Эстроген эффекты в результате реакции с ароматаза также уменьшаются из-за уменьшения взаимодействия ферментов,[22] но такие эффекты как гинекомастия и уменьшил либидо все еще может произойти при достаточно высоких дозах.[нужна цитата ]
В дополнение к своей агонистической активности AR, в отличие от многих других AAS, нандролон также является мощным прогестаген.[23] Он привязан к рецептор прогестерона примерно с 22% сродства прогестерон.[23] Прогестагенная активность нандролона усиливает его антигонадотропный последствия,[24][7] как антигонадотропное действие - известное свойство прогестагенов.[25][26]
| Сложный | PR | AR | ER | GR | МИСТЕР | SHBG | CBG |
|---|---|---|---|---|---|---|---|
| Нандролон | 20 | 154–155 | <0.1 | 0.5 | 1.6 | 1–16 | 0.1 |
| Тестостерон | 1.0–1.2 | 100 | <0.1 | 0.17 | 0.9 | 19–82 | 3–8 |
| Эстрадиол | 2.6 | 7.9 | 100 | 0.6 | 0.13 | 8.7–12 | <0.1 |
| Примечания: Значения указаны в процентах (%). Ссылка лиганды (100%) были прогестерон для PR, тестостерон для AR, эстрадиол для ER, дексаметазон для GR, альдостерон для МИСТЕР, дигидротестостерон за SHBG, и кортизол за CBG. Источники: См. Шаблон. | |||||||
Анаболическая и андрогенная активность
Нандролон имеет очень высокое соотношение анаболической и андрогенной активности.[14] Фактически, нандролоноподобные ААС, такие как сам нандролон и тренболон считается, что у них одно из самых высоких соотношений анаболического и андрогенного действия среди всех ААС.[24] Это объясняется тем фактом, что, хотя тестостерон усиливается за счет преобразования в дигидротестостерон (DHT) в андрогенных тканях, обратное верно для нандролона и аналогичных ААС (то есть других производных 19-нортестостерона).[14] Таким образом, нандролоноподобные ААС, а именно сложные эфиры нандролона, являются наиболее часто используемыми ААС в клинических условиях, в которых желательны анаболические эффекты; например, при лечении СПИД -ассоциированный кахексия, суровый ожоги, и хроническая обструктивная болезнь легких.[24] Однако ААС с очень высоким соотношением анаболического и андрогенного действия, такие как нандролон, по-прежнему обладают значительными андрогенными эффектами и могут вызывать симптомы маскулинизация подобно гирсутизм и голос становится громче у женщин и детей при длительном применении.[14]
| Сложный | rAR (%) | час (%) | ||||||
|---|---|---|---|---|---|---|---|---|
| Тестостерон | 38 | 38 | ||||||
| 5α-дигидротестостерон | 77 | 100 | ||||||
| Нандролон | 75 | 92 | ||||||
| 5α-дигидронандролон | 35 | 50 | ||||||
| Этилэстренол | ND | 2 | ||||||
| Норетандролон | ND | 22 | ||||||
| 5α-дигидроноретандролон | ND | 14 | ||||||
| Метриболон | 100 | 110 | ||||||
| Источники: См. Шаблон. | ||||||||
Фармакокинетика
В устный активность нандролона была изучена.[27][28][29][30][31][32] При пероральном введении нандролона грызунам у него было около одной десятой потенция из подкожная инъекция нандролона.[27][33][19]
Нандролон очень низкий близость для человеческой сыворотки глобулин, связывающий половые гормоны (SHBG), около 5% от тестостерона и 1% от DHT.[34] это метаболизируется посредством фермент 5α-редуктаза, среди прочего.[35][требуется дополнительная ссылка (и) ] Нандролон менее подвержен метаболизму 5α-редуктазой и 17β-гидроксистероид дегидрогеназа чем тестостерон.[35] Это приводит к тому, что преобразованный меньше в так называемых "андрогенных" ткани словно кожа, волосяные фолликулы, и простата и в почки, соответственно.[35] Метаболиты нандролона включают 5α-дигидронандролон, 19-норандростерон, и 19-норэтиохоланолон, и эти метаболиты могут быть обнаружены в моча.[36]
Одинокий внутримышечные инъекции 100 мг фенилпропионат нандролона или же нандролон деканоат было обнаружено, что анаболический эффект длится от 10 до 14 дней и от 20 до 25 дней соответственно.[37] И наоборот, неэстерифицированный нандролон использовался внутримышечно один раз в день.[19][33]
- Уровни гормонов с эфирами нандролона при внутримышечной инъекции

Уровни нандролона после однократной внутримышечной инъекции 50, 100 или 150 мг нандролон деканоат в масляном растворе у мужчин.[38]

Уровни нандролона после однократной внутримышечной инъекции 100 мг нандролон деканоат или же фенилпропионат нандролона в 4 мл или 1 мл масло арахиса решение в ягодичный или же дельтовидная мышца у мужчин.[39]

Уровни нандролона при однократной внутримышечной инъекции 50 мг нандролон деканоат или же гексилоксифенилпропионат нандролона в масляном растворе у мужчин.[40]
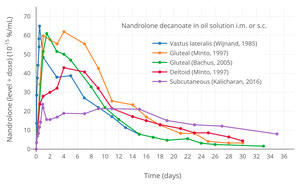
Нормализованная по дозе экспозиция нандролона (уровень в сыворотке, деленный на введенную дозу) с нандролон деканоат в масляном растворе внутримышечно или подкожно мужчинам.[41][42]
Химия

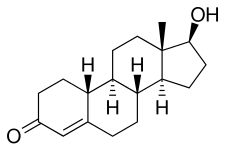
Нандролон, также известный как 19-нортестостерон (19-NT) или как эстренолон, а также эстра-4-ен-17β-ол-3-он или 19-норандрост-4-ен-17β-ол-3-он,[43] это встречающиеся в природе эстран (19-норандростан) стероидный препарат и производная из тестостерон (андрост-4-ен-17β-ол-3-он).[2][11] Это конкретно C19 деметилированный (ни ) аналог тестостерона.[2][11] Нандролон - это эндогенный средний в производство из эстрадиол из тестостерон через ароматаза в млекопитающие включая людей, и присутствует в организме в следовых количествах.[44] Его можно обнаружить во время беременность у женщин.[45] Эфиры нандролона обладают сложный эфир Такие как деканоат или же фенилпропионат прикреплен в положении C17β.[2][11]
Производные
Сложные эфиры
Разнообразные сложные эфиры нандролона продаются и используются в медицине.[2][11] Наиболее часто используемые сложные эфиры: нандролон деканоат и в меньшей степени фенилпропионат нандролона. Примеры других сложных эфиров нандролона, которые были проданы и использованы в медицине, включают: нандролон циклогексилпропионат, нандролон ципионат, гексилоксифенилпропионат нандролона, лаурат нандролона, сульфат нандролона, и нандролон ундеканоат.[2][11][7]
Анаболические стероиды
Нандролон является исходным соединением большой группы ААС. Известные примеры включают не-17α-алкилированный тренболон и 17α-алкилированный этилэстренол (этилнандрол) и метриболон (R-1881), а также 17α-алкилированный дизайнерские стероиды норболетон и тетрагидрогестринон (THG). Ниже приводится список производных нандролона, которые были разработаны как ААС:[7]
|
|
Прогестины
Нандролон вместе с этистерон (17α-этинилтестостерон), также является исходным соединением большой группы прогестины, то норэтистерон (17α-этинил-19-нортестостерон) производные.[46][47] Это семейство подразделяется на две группы: Estranes и гонаны.[46] Эстраны включают норэтистерон (норэтиндрон), норэтистерона ацетат, норэтистерона энантат, линестренол, этинодиола диацетат, и норэтинодрел, а гонаны включают норгестрел, левоноргестрел, дезогестрел, этоногестрел, гестоден, Norgestimate, диеногест (на самом деле производное 17α-цианометил-19-нортестостерона), и норэлгестромин.[46]
Синтез
Разработка метода восстановления ароматических колец до соответствующих дигидробензолов в контролируемых условиях А. Дж. Берчем открыла удобный путь к соединениям, относящимся к предполагаемым 19-норпрогестерон.
Эта реакция, теперь известная как Сокращение березы,[51] типична обработка монометилового эфира эстрадиол (1) с раствором металлического лития в жидком аммиаке в присутствии спирта в качестве источника протонов. Составляющие исходной реакции 1,4-диметалирования наиболее электронодефицитных положений ароматического кольца - в случае эстрогена - положения 1 и 4. Rxn промежуточного продукта с источником протонов приводит к дигидробензолу; Особым достоинством этой последовательности в стероидах является тот факт, что двойное связывание в точке 2 фактически превращается в фрагмент енольного эфира. Лечение этого продукта (2) со слабой кислотой, Щавелевая кислота например, приводит к гидролизу енольного эфира с образованием β, γ-неконъюгированного кетона 3. Гидролиз в более тяжелых условиях (минеральные кислоты ) приводит к миграции / конъюгации олефина с образованием нандролона (4).
Сложные эфиры
- Лечение 4 с декановым ангидридом и пиридин дает нандролон деканоат.[52]
- Ацилирование 4 с фенилпропионилхлоридом выходы нандролона фенпропионат.[53]
Обнаружение в биологических жидкостях
Использование нандролона непосредственно обнаруживается в волосах или косвенно в моче при тестировании на наличие 19-норандростерон, а метаболит. В Международный олимпийский комитет установил предел 2,0 мкг / л 19-норандростерона в моче в качестве верхнего предела,[54] за которым спортсмен подозревается в допинг. В крупнейшем исследовании нандролона, проведенном с участием 621 спортсмена, Олимпийские игры 1998 года в Нагано, ни один спортсмен не тестировал более 0,4 мкг / л. 19-Норандростерон был идентифицирован как следовое загрязнение в коммерческих препаратах андростендион, который до 2004 года был доступен без рецепта в качестве пищевой добавки в США.[55][56][57][58]
Ряд случаев применения нандролона в легкая атлетика произошел в 1999 году, и в нем участвовали известные спортсмены, такие как Мерлин Отти, Дитер Бауманн и Линфорд Кристи.[59] Однако в следующем году метод определения нандролона в то время оказался неверным. Марк Ричардсон, британский олимпийский эстафетный бегун, который дал положительный результат на это вещество, сдал значительное количество образцов мочи в контролируемой среде и дал положительный результат на лекарство, продемонстрировав возможность ложных срабатываний, что привело к пересмотру его запрета на участие в соревнованиях.[60]
Чрезмерное потребление незаменимой аминокислоты лизин (как указано в лечении герпеса) якобы показал ложноположительные результаты в некоторых случаях и был процитирован американскими дробовик К. Дж. Хантер в качестве причины его положительного теста, хотя в 2004 году он был признан федеральным большое жюри что он вводил нандролон.[61] Возможной причиной неверных результатов анализа мочи является наличие метаболитов других ААС, хотя и современных анализ мочи Обычно можно точно определить используемые ААС, анализируя соотношение двух оставшихся метаболитов нандролона. В результате множества отмененных приговоров процедура тестирования была пересмотрена Великобритания Спорт. 5 октября 2007 года трехкратный золотой призер Олимпийских игр по легкой атлетике. Мэрион Джонс признался в употреблении наркотика и был приговорен к шести месяцам тюремного заключения за ложь перед федеральным большим жюри в 2000 году.[62]
Масс-спектрометрии также используется для обнаружения небольших образцов нандролона в образцах мочи, поскольку он имеет уникальную молярную массу.
История

Нандролон был первым синтезированный в 1950 г.[2][43][17]:130[63] Впервые он был представлен как фенилпропионат нандролона в 1959 году, а затем как деканоат нандролона в 1962 году, за которым последовали дополнительные эфиры.[64]
Общество и культура
Родовые имена
Нандролон это родовое имя препарата и его ГОСТИНИЦА, БАН, DCF, и DCIT.[2][11][3][65] Формальные общие названия эфиров нандролона включают: нандролон циклогексилпропионат (БАНМ ), циклотат нандролона (USAN ), нандролон деканоат (USAN, USP, БАНМ, ЯНВАРЬ ), лаурат нандролона (БАНМ ), нандролона фенпропионат (USP ), и фенилпропионат нандролона (БАНМ, ЯНВАРЬ ).[2][11][3][65]
Допинг в спорте
Нандролон, вероятно, был одним из первых ААС, который использовался в качестве допингового агента в спорте в 1960-х годах. Запрещен на Олимпийских играх с 1974 года.[17]:128 Известно много случаев допинг в спорте с эфирами нандролона профессиональный спортсмены.
Исследование
Эфиры нандролона изучались по нескольким показаниям. Их интенсивно изучали на остеопороз, и увеличили усвоение кальция и уменьшили потерю костной массы, но вызвали вирилизацию примерно у половины женщин, которые принимали их, и в большинстве случаев отказались от этого приема, когда более эффективные препараты, такие как бисфосфонаты стал доступен.[20] Они также были изучены в клинические испытания за хроническая почечная недостаточность, апластическая анемия, и, как мужские контрацептивы.[17]:134
Рекомендации
- ^ «Значение нандролона в Кембриджском словаре английского языка».
- ^ а б c d е ж грамм час я j k л м п о Элкс Дж., Ганеллин ЧР, ред. (2014). Словарь лекарственных средств: химические данные: химические данные, структуры и библиографии. Нью-Йорк: Спрингер. стр. 660–. ISBN 978-1-4757-2085-3. OCLC 1079003025.
- ^ а б c d Мортон И.К., Холл Дж. М. (6 декабря 2012 г.). Краткий словарь фармакологических агентов: свойства и синонимы. Springer Science & Business Media. ISBN 978-94-011-4439-1.
- ^ Макэвой Дж. Д., Маквей К. Э., МакКоги В. Дж. (Декабрь 1998 г.). «Остатки эфиров нортестостерона в местах инъекций. Часть 1. Биодоступность при пероральном введении». Аналитик. 123 (12): 2475–8. Дои:10.1039 / a804919j. PMID 10435281.
- ^ Беккер К.Л. (2001). Принципы и практика эндокринологии и метаболизма. Липпинкотт Уильямс и Уилкинс. С. 1185–. ISBN 978-0-7817-1750-2.
- ^ а б c d е ж грамм «Дека-Дураболин» (PDF). Schering-Plough. Архивировано из оригинал (PDF) 18 декабря 2010 г.
- ^ а б c d е ж грамм час я j k л м п о п q р s т Ллевеллин В. (2011). Анаболики. Molecular Nutrition Llc. С. 402–412, 460–467, 193–194. ISBN 978-0-9828280-1-4.
- ^ а б Томас Дж. А. (6 декабря 2012 г.). Наркотики, спортсмены и физическая подготовка. Springer Science & Business Media. С. 27–29. ISBN 978-1-4684-5499-4.
- ^ а б c Minto CF, Howe C, Wishart S, Conway AJ, Handelsman DJ (апрель 1997 г.). «Фармакокинетика и фармакодинамика эфиров нандролона в масляном носителе: влияние сложного эфира, места инъекции и объема инъекции». Журнал фармакологии и экспериментальной терапии. 281 (1): 93–102. PMID 9103484.
- ^ «Дека-Дураболин» (PDF). Merck Sharp & Dohme (Австралия).
- ^ а б c d е ж грамм час я Index Nominum 2000: Международный справочник лекарственных средств. Тейлор и Фрэнсис. Январь 2000. С. 716–. ISBN 978-3-88763-075-1.
- ^ а б Sneader W (23 июня 2005 г.). Открытие лекарств: история. Джон Вили и сыновья. С. 206–. ISBN 978-0-471-89979-2.
- ^ Сингх Г.К., Тернер Л., Десаи Р., Хименес М., Хандельсман Д.Д. (июль 2014 г.). «Фармакокинетико-фармакодинамическое исследование подкожной инъекции депо деканоата нандролона с использованием отбора проб сухих пятен крови в сочетании с тандемными масс-спектрометрическими анализами жидкостной хроматографии при сверхвысоком давлении». Журнал клинической эндокринологии и метаболизма. 99 (7): 2592–8. Дои:10.1210 / jc.2014-1243. PMID 24684468.
- ^ а б c d е Кичман А.Т. (июнь 2008 г.). «Фармакология анаболических стероидов». Британский журнал фармакологии. 154 (3): 502–21. Дои:10.1038 / bjp.2008.165. ЧВК 2439524. PMID 18500378.
- ^ Кочакян CD (6 декабря 2012 г.). Анаболически-андрогенные стероиды. Springer Science & Business Media. С. 401–. ISBN 978-3-642-66353-6.
- ^ Джеймсон Дж. Л., Де Гроот Л. Дж. (25 февраля 2015 г.). Эндокринология: электронная книга для взрослых и детей. Elsevier Health Sciences. С. 2388–. ISBN 978-0-323-32195-2.
- ^ а б c d Hemmersbach P, Große J (2009). «Нандролон: многогранный допинговый агент». В Thieme D, Hemmersbach P (ред.). Допинг в спорте. Берлин: Springer. С. 127–154. ISBN 978-3-540-79088-4.
- ^ Handelsman DJ (2013). «Физиология андрогенов, фармакология и злоупотребления». В Де Гроот LJ (ред.). Эндотекст. 4.1.2 Фармакологическая андрогенная терапия - через книжную полку NCBI.
И тестостерон, и его неароматизирующееся производное нандролон вызывают повышенную плотность костей у мужчин с остеопорозом, вызванным глюкокортикоидами, с минимальными краткосрочными побочными эффектами.
- ^ а б c d е ж Camerino B, Sala G (1960). "Анаболические стероиды". Fortschritte der Arzneimittelforschung / Прогресс в исследованиях лекарственных средств / Progrès des recherches Pharmaceutiques. Fortschritte der Arzneimittelforschung. Прогресс в исследованиях лекарств. Progres des Recherches Pharmaceutiques. 2. С. 71–134. Дои:10.1007/978-3-0348-7038-2_2. ISBN 978-3-0348-7040-5. PMID 14448579.
- ^ а б c Пан М.М., Ковач-младший (апрель 2016 г.). «Помимо тестостерона ципионата: доказательства использования нандролона для улучшения мужского здоровья и благополучия». Трансляционная андрология и урология. 5 (2): 213–9. Дои:10.21037 / тау.2016.03.03. ЧВК 4837307. PMID 27141449.
- ^ а б Бергинк Е.В., Янссен П.С., Турпейн Е.В., ван дер Вис Дж. (Июнь 1985 г.). «Сравнение рецепторных связывающих свойств нандролона и тестостерона в условиях in vitro и in vivo». Журнал стероидной биохимии. 22 (6): 831–6. Дои:10.1016/0022-4731(85)90293-6. PMID 4021486.
- ^ Brueggemeier RW (16 сентября 2006 г.). «Половые гормоны (мужские): аналоги и антагонисты». В Мейерс Р.А. (ред.). Энциклопедия молекулярной клеточной биологии и молекулярной медицины (Абстрактные). Джон Уайли и сыновья. Дои:10.1002 / 3527600906.mcb.200500066. ISBN 978-3527600908.
- ^ а б Kuhl H (август 2005 г.). «Фармакология эстрогенов и прогестагенов: влияние разных путей введения». Климактерический. 8 Дополнение 1: 3–63. Дои:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ а б c de Souza GL, Hallak J (декабрь 2011 г.). «Анаболические стероиды и мужское бесплодие: всесторонний обзор». BJU International. 108 (11): 1860–5. Дои:10.1111 / j.1464-410X.2011.10131.x. PMID 21682835. S2CID 29035729.
- ^ Кузине Б., Янг Дж., Брайли С., Шансон П., Томас Дж. Л., Шейсон Дж. (Декабрь 1996 г.). «Антигонадотропная активность прогестинов (производных 19-нортестостерона и 19-норпрогестерона) не опосредуется через рецептор андрогенов». Журнал клинической эндокринологии и метаболизма. 81 (12): 4218–23. Дои:10.1210 / jcem.81.12.8954018. PMID 8954018.
- ^ Мове-Джарвис П. «Прогестерон и прогестины: общий обзор». (1983): 1-16.
- ^ а б Камерино Б., Скаки Р. (1975). «Состав и эффекты анаболических стероидов». Фармакология и терапия. Часть B. 1 (2): 233–75. Дои:10.1016 / 0306-039X (75) 90007-0. PMID 817322.
- ^ Хольткамп Д.Е., Хеминг А.Е., Мансор Л.Ф. (1955). «Сравнение перорального и подкожного введения в анаболической и андрогенной эффективности 19-нортестостерона и тестостерона». Журнал клинической эндокринологии и метаболизма. 15 (7): 848. Дои:10.1210 / jcem-15-7-834. ISSN 0021-972X.
- ^ Фурман Р. Х., Ховард Р. П., Смит К. В., Норча Л. Н. (январь 1956 г.). «Сравнение эффектов перорального метилтестостерона, 19-нортестостерона и 17-метил-19-нортестостерона на липиды и липопротеины сыворотки». Журнал лабораторной и клинической медицины. 48 (5): 808–809.
- ^ Фурман Р. Х., Ховард Р. П., Норча Л. Н., Кити Э. К. (январь 1958 г.). «Влияние андрогенов, эстрогенов и родственных стероидов на липиды и липопротеины сыворотки». Американский журнал медицины. 24 (1): 80–97. Дои:10.1016/0002-9343(58)90364-4. PMID 13498038.
- ^ Макэвой Дж. Д., Маквей К. Э., МакКоги В. Дж. (Декабрь 1998 г.). «Остатки эфиров нортестостерона в местах инъекций. Часть 1. Биодоступность при пероральном введении». Аналитик. 123 (12): 2475–8. Дои:10.1039 / a804919j. PMID 10435281.
- ^ Арнольд А. Поттс Г.О. (январь 1964 г.). «Пероральные анаболические и андрогенные эффекты 19-нортестостерона и 17α-метил-19-нортестостерона». Слушания Федерации. 23 (2): 412.
- ^ а б Бейкер WH, Хеннеман PH, Баггетт Б., Энгель Л.Л., Тиббетс Д., Браун М. (январь 1955 г.). «Метаболический эффект 19-нортестостерона». Журнал клинической эндокринологии и метаболизма. 15 (7): 848–849. Дои:10.1210 / jcem-15-7-834. ISSN 0021-972X.
- ^ Саарток Т., Дальберг Э., Густафссон Дж. А. (июнь 1984 г.). «Относительное сродство связывания анаболических андрогенных стероидов: сравнение связывания с рецепторами андрогенов в скелетных мышцах и простате, а также с глобулином, связывающим половые гормоны». Эндокринология. 114 (6): 2100–6. Дои:10.1210 / эндо-114-6-2100. PMID 6539197.
- ^ а б c Бергинк Э.В., Гилен Дж.А., Турпейн Э.В. (1985). «Метаболизм и связывание рецепторов нандролона и тестостерона в условиях in vitro и in vivo». Acta Endocrinologica. Дополнение. 271 (3_Suppla): 31–7. Дои:10.1530 / acta.0.109S0031. PMID 3865479.
- ^ Mottram DR (12 ноября 2010 г.). Наркотики в спорте. Рутледж. С. 63–. ISBN 978-1-135-25825-2.
- ^ Дорфман Р.И. (5 декабря 2016 г.). Стероидная активность у экспериментальных животных и человека. Elsevier Science. С. 68–. ISBN 978-1-4832-7300-6.
- ^ Багхус В.М., Смитс Дж.М., Верхеул Х.А., Де Ягер-Ван Дер Вин С.М., Порт А, Geurts TB (2005). «Фармакокинетическая оценка трех различных внутримышечных доз деканоата нандролона: анализ образцов сыворотки и мочи у здоровых мужчин». J. Clin. Эндокринол. Метаб. 90 (5): 2624–30. Дои:10.1210 / jc.2004-1526. PMID 15713722.
- ^ Минто С.Ф., Хоу С., Уишарт С., Конвей А.Дж., Хандельсман Д.Д. (1997). «Фармакокинетика и фармакодинамика эфиров нандролона в масляном носителе: влияние сложного эфира, места инъекции и объема инъекции». J. Pharmacol. Exp. Ther. 281 (1): 93–102. PMID 9103484.
- ^ Белкиен Л., Шюрмейер Т., Хано Р., Гуннарссон П.О., Нишлаг Е. (май 1985 г.). «Фармакокинетика эфиров 19-нортестостерона у нормальных мужчин». J. Стероид Биохим. 22 (5): 623–9. Дои:10.1016/0022-4731(85)90215-8. PMID 4010287.
- ^ Каличаран Р.В., Шот П., Вроманс Х. (февраль 2016 г.). «Фундаментальные представления о абсорбции лекарств из парентерального масляного депо». Eur J Pharm Sci. 83: 19–27. Дои:10.1016 / j.ejps.2015.12.011. PMID 26690043.
- ^ Каличаран, Рауин Викеш (2017). Новый взгляд на абсорбцию лекарств из нефтебаз (Тезис). Утрехтский университет.
- ^ а б Шнитцер Р. (1 января 1967 г.). Экспериментальная химиотерапия. Elsevier Science. С. 165–. ISBN 978-0-323-14611-1.
- ^ Bricout V, Wright F (июнь 2004 г.). «Обновленная информация о нандролоне и норстероидах: насколько эти вещества являются эндогенными или ксенобиотическими?». Европейский журнал прикладной физиологии. 92 (1–2): 1–12. Дои:10.1007 / s00421-004-1051-3. PMID 15042372. S2CID 6472015.
- ^ Липпи Дж., Франчини М., Банфи Дж. (Май 2011 г.). «Биохимия и физиология допинга анаболических андрогенных стероидов». Мини-обзоры по медицинской химии. 11 (5): 362–73. Дои:10.2174/138955711795445952. PMID 21443514. S2CID 3862299.
- ^ а б c Шиндлер А.Е., Кампаньоли С., Друкманн Р., Хубер Дж., Паскуалини Дж. Р., Швеппе К. В., Тийссен Дж. Х. (декабрь 2003 г.). «Классификация и фармакология прогестинов». Maturitas. 46 Приложение 1: S7 – S16. Дои:10.1016 / j.maturitas.2003.09.014. PMID 14670641.
- ^ Meikle AW (24 апреля 2003 г.). Эндокринная заместительная терапия в клинической практике. Springer Science & Business Media. С. 489–. ISBN 978-1-59259-375-0.
Estranes. Прогестагены эстрана и гонана являются производными 19-нортестостерона, гестагенного исходного соединения, используемого в оральных контрацептивах в Соединенных Штатах. Эстраны характеризуются наличием этинильной группы в положении 17 и отсутствием метильной группы между кольцами A и B (см. Рис. 10). Прогестагены эстрана, которые структурно связаны с норэтиндроном (норэтинодрел, линестренол, норэтиндронацетат, этинодиолдиацетат), превращаются в это исходное соединение. Норэтиндрон является вторым наиболее часто используемым прогестагеном в США для ЗГТ. Гонаны. Гонаны разделяют структурные модификации, обнаруженные в эстранах, а также обладают этинильной группой в положении 13 и кетогруппой в положении 3 (см. Фиг. 11). Норгестрел был синтезирован в 1963 году и представляет собой рацемическую смесь правовращающей и левовращающей форм. Левоноргестрел, левовращающая форма, обеспечивает биологическую активность. Гонаны третьего поколения (дезогестрел, гестоден и норгестимат) были разработаны для уменьшения нежелательных побочных эффектов прогестагенов, [...]
- ^ Уайлдс А. Л., Нельсон Н. А. (1953). «Легкий синтез 19-нортестостерона и 19-норандростендиона из эстрона». Журнал Американского химического общества. 75 (21): 5366–5369. Дои:10.1021 / ja01117a065.
- ^ Ueberwasser H, Heusler K, Kalvoda J, Meystre CH, Wieland P, Anner G, Wettstein A (1963). "19-Norsteroide II. Ein einfaches Herstellungsverfahren für 19-Norandrostan-Derivate. Über Steroide, 193. Mitteilung". Helvetica Chimica Acta. 46: 344–352. Дои:10.1002 / hlca.19630460135.
- ^ Симидзу И., Наито Ю., Цудзи Дж. (1980). «Синтез оптически активного (+) - 19-нортестостерона путем асимметричной реакции бис-аннулирования». Буквы Тетраэдра. 21 (5): 487–490. Дои:10.1016 / S0040-4039 (00) 71440-7.
- ^ Береза А.Дж. (1950). «Восстановление органических соединений металл-аммиачными растворами». Ежеквартальные обзоры, Химическое общество. 4: 69. Дои:10.1039 / QR9500400069.
- ^ США 2998423, DeWytt ED, Overbeek O, Overbeek GA, выпущенный 1961 г., назначенный Органон.
- ^ CH 206119, выпущен в 1939 г., закреплен за Gesellschaft für Chemische Industrie Basel
- ^ «Разъяснение по поводу тестирования на нандролон». Всемирное антидопинговое агентство. 2005-05-30. Архивировано из оригинал на 2012-09-15. Получено 2012-01-31.
- ^ Брессон М., Циримеле В., Злодей М., Кинц П. (май 2006 г.). «Допинг-контроль на метандиенон с использованием волос, анализируемых методом газовой хроматографии-тандемной масс-спектрометрии». Журнал хроматографии. B, Аналитические технологии в биомедицине и науках о жизни. 836 (1–2): 124–8. Дои:10.1016 / j.jchromb.2006.03.040. PMID 16597518.
- ^ Уэки М., Икекита А., Такао Ю. (2000). «[Метаболит нандролона в моче олимпийского спортсмена Нагано]». Яп. J. For. Tox. (на японском языке). 18: 198–199.
- ^ Катлин Д.Х., Ледер Б.З., Аренс Б., Старчевич Б., Хаттон К.К., Грин Г.А., Финкельштейн Дж.С. (2000). «Следы контаминации андростендиона, отпускаемого без рецепта, и положительные результаты анализа мочи на метаболит нандролона». JAMA. 284 (20): 2618–21. Дои:10.1001 / jama.284.20.2618. PMID 11086369.
- ^ Baselt RC (2008). Утилизация токсичных лекарств и химикатов у человека (8-е изд.). Фостер-Сити, Калифорния: Биомедицинские публикации. С. 1078–1080. ISBN 978-0-9626523-7-0.
- ^ Барон, Питер (2000-09-19). Проблема с наркотиками: Бауманн должен бороться до конца. Дейли Телеграф. Проверено 13 ноября 2010.
- ^ Ричардсон М (19 февраля 2004 г.). «Легкая атлетика: Марк Ричардсон объясняет, что он чувствовал на своем дисциплинарном слушании». легкая атлетика. Лондон: The Guardian. Получено 2010-11-13.
Это был такой устрашающий состав, с которым я когда-либо сталкивался на легкоатлетических трассах.
- ^ «Проследить, чтобы звезда Мэрион Джонс признала употребление стероидов». Национальное общественное радио. 2007-10-05. Получено 2009-11-09.
- ^ Спортивное антидопинговое управление Великобритании (январь 2000 г.). Нандролон Обзор (PDF) (Отчет). Великобритания Спорт. Архивировано из оригинал (PDF) на 2005-04-04. Получено 2013-02-02.
- ^ Береза А.Дж. (1950). «80. Гидроароматические стероидные гормоны. Часть I. 10-Нортестостерон». Журнал химического общества (возобновлено): 367. Дои:10.1039 / jr9500000367. ISSN 0368-1769.
- ^ Сводный список продуктов, потребление и / или продажа которых были запрещены, изъяты, строго ограничены или не одобрены правительствами. Публикации Организации Объединенных Наций. 1983. С. 154–. ISBN 978-92-1-130230-1.
- ^ а б «Нандролон».
дальнейшее чтение
- Geusens P (сентябрь 1995 г.). «Деканоат нандролона: фармакологические свойства и терапевтическое применение при остеопорозе». Клиническая ревматология. 14 Дополнение 3: 32–9. Дои:10.1007 / bf02210686. PMID 8846659. S2CID 24365057.
- Кичман А.Т. (июнь 2008 г.). «Фармакология анаболических стероидов». Британский журнал фармакологии. 154 (3): 502–21. Дои:10.1038 / bjp.2008.165. ЧВК 2439524. PMID 18500378.
- Хеммерсбах П., Гросс Дж. (2010). «Нандролон: многогранный допинг». Допинг в спорте. Handb Exp Pharmacol. Справочник по экспериментальной фармакологии. 195. С. 127–54. Дои:10.1007/978-3-540-79088-4_6. ISBN 978-3-540-79087-7. PMID 20020363.
- Velema MS, Kwa BH, de Ronde W (март 2012 г.). «Следует ли учитывать андрогенные анаболические стероиды в схеме лечения отдельных пациентов с хронической обструктивной болезнью легких?». Текущее мнение в области легочной медицины. 18 (2): 118–24. Дои:10.1097 / MCP.0b013e32834e9001. PMID 22189453. S2CID 6155275.
- Busardò FP, Frati P, Sanzo MD, Napoletano S, Pinchi E, Zaami S, Fineschi V (январь 2015 г.). «Влияние деканоата нандролона на центральную нервную систему». Современная нейрофармакология. 13 (1): 122–31. Дои:10,2174 / 1570159X13666141210225822. ЧВК 4462037. PMID 26074747.
- Ву С., Ковач-младший (октябрь 2016 г.). «Новое использование анаболических андрогенных стероидов нандролона и оксандролона в управлении мужским здоровьем». Текущие отчеты урологии. 17 (10): 72. Дои:10.1007 / s11934-016-0629-8. PMID 27535042. S2CID 43199715.
- Пан М.М., Ковач-младший (апрель 2016 г.). «Помимо тестостерона ципионата: доказательства использования нандролона для улучшения мужского здоровья и благополучия». Трансляционная андрология и урология. 5 (2): 213–9. Дои:10.21037 / тау.2016.03.03. ЧВК 4837307. PMID 27141449.