Медрогестон - Medrogestone
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Colprone, другие |
| Другие имена | Метрогестоун; Медрогестерон; AY-62022, NSC-123018, R-13615; 6,17α-диметил-6-дегидропрогестерон; 6,17α-диметил-4,6-прегнадиен-3,20-дион |
| Беременность категория |
|
| Маршруты администрация | Устно |
| Класс препарата | Прогестаген; Прогестин |
| Код УВД | |
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетический данные | |
| Биодоступность | Почти 100%[1][2] |
| Связывание с белками | 95%: Альбумин (90%), CBG (3%), SHBG (2%)[2] |
| Метаболизм | Печеночный (гидроксилирование )[1] |
| Устранение период полураспада | 35–36 часов[3][4][5] |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.012.323 |
| Химические и физические данные | |
| Формула | C23ЧАС32О2 |
| Молярная масса | 340.507 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
Медрогестон, продается под торговой маркой Colprone среди прочего, это прогестин лекарства, которые использовались в менопаузальная гормональная терапия и в лечении гинекологические расстройства.[6][2] Он доступен как отдельно, так и в сочетании с эстроген.[7] Принято устно.[2][8]
Медрогестон - это прогестин или синтетический прогестаген, и, следовательно, является агонист из рецептор прогестерона, то биологическая мишень прогестагенов, таких как прогестерон.[2] Имеет слабый антиандрогенный, глюкокортикоид, и антиминералокортикоид активность и ничего другого важного гормональный Мероприятия.[2][1][9][10] Благодаря своей прогестагенной активности медрогестон имеет антигонадотропный последствия.[1][2]
Медрогестон был описан еще в 1963 году и был введен для использования в медицине как минимум к 1966 году.[11][12][9] В основном он был снят с производства и остается доступным только в нескольких странах.[13][7]
Медицинское использование
В прошлом медрогестон использовался для лечения рак эндометрия и в некоторых схемах лечения рак молочной железы, а у мужчин для доброкачественная гиперплазия предстательной железы. Он до сих пор находит применение при лечении аменорея[14] и как прогестиновый компонент в некоторых формах менопаузальная гормональная терапия.[15]
Было обнаружено, что циклическое лечение низкими дозами (10 мг / день) медрогестона является эффективным при лечении фиброзно-кистозные изменения груди и связанные мастодиния (боль в груди).[16]
Медрогестон используется как форма только прогестагеновые противозачаточные средства, хотя это не имеет специальной лицензии.[17]
Противопоказания
Внутрипеченочный холестаз при беременности (остро или в анамнезе), вагинальное кровотечение неизвестного происхождения и тяжелые заболевания печень Такие как опухоли абсолютны противопоказания для медрогестона, как и тромботический такие события как тромбофлебит или же Инсульт.[18]
Медрогестон противопоказан при беременность потому что прогестагены связаны с риском для плод у животных и людей.[19]
Неизвестно, переходит ли медрогестон в грудное молоко, но этого следовало ожидать, учитывая его липофильность и исследования структурно родственных прогестинов.[19]
Побочные эффекты
Медрогестон редко производит побочные эффекты, все из которых типичны для прогестагенов. Они включают тошнота, депрессия.[18]
Передозировка
В Острая токсичность препарата низкий. Передозировка вызывает только безвредные побочные эффекты, такие как тошнота и вагинальное кровотечение.[19] В LD50 было обнаружено, что его содержание колеблется от 500 мг / кг у собак до более 3000 мг / кг у крыс. Хроническая токсичность был исследован на животных, но ничего, кроме типичных побочных эффектов прогестагенов и снижения простатический вес в макаки резус, были найдены. Случайный прием препарата, в том числе у детей, обычно не опасен. Прием чрезвычайно больших доз или прием пациентами с эпилепсия или же нарушение функции почек, может привести к поражению центральной нервной спазмы.[18]
Взаимодействия
Индукторы ферментов Такие как барбитураты, фенилбутазон, фенитоин, ампициллин или же тетрациклины ожидается снижение концентрации медрогестона в плазме, но систематических исследований не проводилось.[19]
Фармакология
Фармакодинамика
Медрогестон описывается как чистый прогестаген похожий по профилю на прогестерон.[9][20] Однако, в отличие от прогестерона, медрогестон более эффективен и активен при пероральном приеме.[9] Сообщается, что информации о рецепторное связывание медрогестона в различных рецепторы стероидных гормонов.[2] Однако на основании исследования на животных (например, Клауберг тест и другие анализы ), медрогестон является мощным гестагеном, лишенным андрогенный, эстрогенный, и глюкокортикоид активность, но со слабым антиандрогенный и очень слабый антиминералокортикоид Мероприятия.[9] Соответственно, нет доказательств андрогенной или глюкокортикоидной активности, включая влияние на вызванное эстрогеном увеличение триглицериды и Холестерин HDL и подавление надпочечников, наблюдались в клинических исследованиях.[2][21] Однако в исследовании медрогестона в очень высоких дозах (100 мг / день в течение 6 месяцев) доброкачественная гиперплазия предстательной железы, а гипергликемический эффект и изменения в плазме кортизол наблюдались и считались, вероятно, вторичными по отношению к активности глюкокортикоидов, а также наблюдалось снижение уровня натрия, которое объяснялось антиминералокортикоид Мероприятия.[10] В любом случае, при нормальных обстоятельствах (т.е. при типичных клинических дозировках) медрогестон описывается как прогестаген и антигонадотропин и слабый антиандроген у людей без другой клинически значимой активности.[1][2]
Медрогестоун оказался ингибитор из 3β-гидроксистероид дегидрогеназа / Δ5-4 изомераза in vitro, предотвращая преобразование прегненолон к прогестерон и 17α-гидроксипрегненолон к 17α-гидроксипрогестерон в крысе яички препаратов, и подавляет биосинтез из тестостерон in vivo у крыс.[22][23][24] Кроме того, как и прогестерон, медрогестон может подавлять 5α-редуктаза in vitro в микросомальный подготовка кожа и предстательная железа.[25] Хотя их клиническая значимость сомнительна, эти действия медрогестона могут способствовать его слабой антиандрогенной активности.[26]
Фармакокинетика
На пероральное введение, медрогестон быстро поглощен, а биодоступность почти 100%.[1][2] После приема 10 мг медрогестона пиковые концентрации в крови (CМаксимум ) 10–15 нг / мл.[2] В распределение и период полувыведения медрогестона - 4 часа и 35–36 часов соответственно.[2][3][4] Препарат в значительной степени (90%) связывается с альбумин, и лишь в небольшой степени кортикостероид-связывающий глобулин (3%) и глобулин, связывающий половые гормоны (2%).[2] В метаболизм медрогестона - самое главное гидроксилирование.[1][2]
Химия
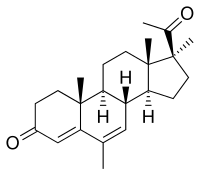
Медрогестон, также известный как 6,17α-диметил-6-дегидропрогестерон или 6,17α-диметил-4,6-прегнадиен-3,20-дион, представляет собой синтетический прегнане стероидный препарат и производная из прогестерон. Он структурно связан с 17α-гидроксипрогестерон производные мегестрола ацетат и медроксипрогестерона ацетат.[1][2] Медрогестон сам по себе не является производным 17α-гидроксипрогестерона, а является производным 17α-метилпрогестерон.[1][2] Это потому, что он имеет метильная группа в позиции C17α вместо гидрокси или же ацетоксигруппа.[1][2] Помимо метильной группы C17α, медрогестон имеет метильную группу в положении C6 и двойная связь между позициями C6 и C7.[1] Единственное структурное различие между медрогестоном и мегестрола ацетатом - это замена ацетоксигруппы C17α метильной группой.[11][13][7]
Синтез
О пероральной активности 17α-метилпрогестерона уже упоминалось. Это соединение, которое может быть обязано этим свойством ингибированию метаболизма способом, аналогичным синтетическим андрогенам и эстрогенам, само по себе недостаточно эффективно, чтобы представлять собой полезное лекарство. Включение известных потенцирующих модификаций дает коммерчески доступный пероральный прогестин медрогестон (4).
Получение ацетата 6-метил-16-дегидропрегненолона (1) предшественник покрыт Вот.

Восстановление сопряженной двойной связи 16,17 ацетата 6-метил-16-дегидропрегненолона с помощью лития в жидком аммиаке сначала приводит к енолят-иону 17; он алкилируется in situ метилиодидом. Известный теперь стерический контроль позволяет получить 17α-метильное соединение.
Ацетатная группа теряется в результате побочной реакции. В интересной модификации по обычной схеме (3) лечится изопропоксид алюминия и кетон (условия Оппенауэра), а также хлоранил в единственной реакции; 4,6-диен (медрогестерон) получают непосредственно на этом этапе.
История
Медрогестоун был впервые описан еще в 1963 году и, по всей видимости, продается по крайней мере с 1966 года.[11][12][9]
Общество и культура
Родовые имена
Медрогестон это родовое имя препарата и его ГОСТИНИЦА, USAN, и БАН.[11][13][6][7] Он также известен своими кодовыми именами развития AY-62022, NSC-123018, и R-13615.[11][13][6][7]
Фирменные наименования
Medrogestone продается или продается под торговыми марками Ayerluton, Colpro, Colpron, Colprone, Etogyn, Prothil и, в сочетании с конъюгированные эстрогены, Presomen.[11][13][7]
Доступность
Medrogestone продается в Соединенные Штаты[9] и Канада и широко во всем Европа, а также в Аргентина, Гонконг, и другие страны.[13] Однако он больше не доступен в Соединенные Штаты[28] или во многих других странах, и, как сообщается, продолжает продаваться только в нескольких странах, включая Франция, Германия, Тунис, и Египет.[7]
Рекомендации
- ^ а б c d е ж грамм час я j k Шиндлер А.Е., Кампаньоли С., Друкманн Р., Хубер Дж., Паскуалини Дж. Р., Швеппе К. В., Тийссен Дж. Х. (декабрь 2003 г.). «Классификация и фармакология прогестинов» (PDF). Maturitas. 46 Приложение 1: S7 – S16. Дои:10.1016 / j.maturitas.2003.09.014. PMID 14670641.[постоянная мертвая ссылка ]
- ^ а б c d е ж грамм час я j k л м п о п q р Kuhl H (2005). «Фармакология эстрогенов и прогестагенов: влияние разных путей введения» (PDF). Климактерический. 8 Дополнение 1: 3–63. Дои:10.1080/13697130500148875. PMID 16112947.
- ^ а б Станчик Ф.З. (2002). «Фармакокинетика и эффективность прогестинов, используемых для заместительной гормональной терапии и контрацепции». Обзоры в эндокринных и метаболических расстройствах. 3 (3): 211–24. Дои:10.1023 / А: 1020072325818. PMID 12215716.
Медрогестон Фармакокинетика медрогестона (доза 5 мг) была изучена на 12 китайских молодых мужчинах, которые получили однократную пероральную дозу этого препарата [20]. Среднее значение ± стандартное отклонение Cmax составляло 8,21 ± 2,78 нг / мл, а Tmax было 2,57 ± 1,02; период полувыведения составил 34,9 ± 17,0 часов.
- ^ а б Лобо Р., Кросиньяни П., Паолетти Р., Бруски Ф. (6 декабря 2012 г.). Женское здоровье и менопауза: новые стратегии - улучшение качества жизни. Springer Science & Business Media. С. 142–. ISBN 978-1-4615-1061-1.
- ^ Станчик Ф.З., Хэпгуд Дж. П., Винер С., Мишелл Д. Р. (апрель 2013 г.). «Прогестагены, используемые в постменопаузальной гормональной терапии: различия в их фармакологических свойствах, внутриклеточном действии и клинических эффектах». Эндокринные обзоры. 34 (2): 171–208. Дои:10.1210 / эр.2012-1008. ЧВК 3610676. PMID 23238854.
- ^ а б c Morton I, Morton I, Hall JM (31 октября 1999 г.). Краткий словарь фармакологических агентов: свойства и синонимы. Springer Science & Business Media. С. 173–. ISBN 978-0-7514-0499-9.
- ^ а б c d е ж грамм https://www.drugs.com/international/medrogestone.html
- ^ Виннифред Берг Катлер; Селсо-Рамон Гарсия (1993). Менопауза: руководство для женщин и тех, кто их любит. Нортон. стр.134 –. ISBN 978-0-393-30995-9.
- ^ а б c d е ж грамм Revesz C, Chappel CI (декабрь 1966 г.). «Биологическая активность медрогестона: новый перорально активный прогестин». Журнал репродукции и фертильности. 12 (3): 473–87. Дои:10.1530 / jrf.0.0120473. PMID 4288903.
- ^ а б Рангно Р. Э., Маклеод П. Дж., Руди Дж., Огилви Р. И. (1971). «Лечение доброкачественной гипертрофии простаты медрогестоном». Клиническая фармакология и терапия. 12 (4): 658–65. Дои:10.1002 / cpt1971124658. PMID 4105445.
- ^ а б c d е ж Elks J (14 ноября 2014 г.). Словарь лекарственных средств: химические данные: химические данные, структуры и библиографии. Springer. С. 759–760. ISBN 978-1-4757-2085-3.
- ^ а б Deghenghi, R .; Lefebvre, Y .; Mitchell, P .; Morand, P.F .; Годри, Р. (1963). «Синтез производных 17α-метилпрогестерона». Тетраэдр. 19 (2): 289–298. Дои:10.1016 / S0040-4020 (01) 98530-8. ISSN 0040-4020.
- ^ а б c d е ж Швейцарское фармацевтическое общество (январь 2000 г.). Index Nominum 2000: Международный справочник лекарственных средств. Тейлор и Фрэнсис. С. 638–. ISBN 978-3-88763-075-1.
- ^ Медрогестон в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- ^ Sweetman SC, изд. (2009). «Половые гормоны и их модуляторы». Мартиндейл: полный список лекарств (36-е изд.). Лондон: Фармацевтическая пресса. п. 2113. ISBN 978-0-85369-840-1.
- ^ Винклер У. Х., Шиндлер А. Э., Бринкманн США, Эберт С., Оберхофф С. (2001). «Циклическая прогестинотерапия для лечения мастопатии и мастодинии». Гинеколь. Эндокринол. 15 Дополнение 6: 37–43. Дои:10.1080 / gye.15.s6.37.43. PMID 12227885.
- ^ Gourdy P, Bachelot A, Catteau-Jonard S, Chabbert-Buffet N, Christin-Maître S, Conard J, Fredenrich A, Gompel A, Lamiche-Lorenzini F, Moreau C, Plu-Bureau G, Vambergue A, Vergès B, Kerlan V (ноябрь 2012 г.). «Гормональная контрацепция у женщин с риском сосудистых и метаболических нарушений: рекомендации Французского общества эндокринологов». Анна. Эндокринол. (Париж). 73 (5): 469–87. Дои:10.1016 / j.ando.2012.09.001. PMID 23078975.
- ^ а б c Питтнер Х., Ясек В., Вичо Х., ред. (2006). Кодекс Австрии (на немецком). 1 (Изд., 2006/2007). Вена: Österreichischer Apothekerverlag. п. 1696. ISBN 978-3-85200-177-7.
- ^ а б c d "Fachinformation zu Colpro" [Краткое изложение характеристик продукции Colpro] (на немецком языке). Открытая база данных лекарств. Ноябрь 1997. Архивировано с оригинал 9 декабря 2009 г.. Получено 15 августа 2010.
- ^ Гаутам Аллахбадия (29 февраля 2016 г.). Руководство по протоколам индукции овуляции и стимуляции яичников. JP Medical Ltd. стр. 94–. ISBN 978-93-5090-958-4.
Природные препараты P4 включают прогестерон, дидрогестерон и медрогестон.
- ^ Картер, В. Ф .; Faucher, G.L .; Гринблатт, Р. Б. (1964). «Оценка нового прогестагента, 6,17α-диметил-6-дегидропрогестерона». Американский журнал акушерства и гинекологии. 89 (5): 635–41. Дои:10.1016/0002-9378(64)90158-9. PMID 14176912.
- ^ Givner, M. L .; Дворник Д. (1972). «Подавление биосинтеза тестостерона медрогестоном». Experientia. 28 (9): 1105–1106. Дои:10.1007 / BF01918702. ISSN 0014-4754. PMID 4269193.
In vitro медрогестон блокирует синтез гормонов в половых железах за счет ингибирования 3β-гидроксистероид Δ4,5-изомеразы. In vivo медрогестон снижает уровень тестостерона в семенниках крыс.
- ^ Фрэнк Френч (6 декабря 2012 г.). Гормональная регуляция сперматогенеза. Springer Science & Business Media. С. 159–. ISBN 978-1-4613-4440-7.
Следовательно, мы ввели медрогестон в перфузируемое яичко, поскольку медрогестон является мощным ингибитором фермента Δ5-3-кетостероидизомеразы (52) и, следовательно, должен ингибировать биосинтез тестостерона.
- ^ Канадская федерация биологических обществ. Протоколы годового собрания.
С препаратом фермента яичек крысы медрогестон (1 × 10 '^ М) ингибировал превращение прегненолона в прогестерон (92%) и 17-гидроксипрогестерон (59%); и 17-гидроксипрегненолон на 17-гидроксипрогестерон (83%). С ...
- ^ Влияние гормонов на развитие опухолей. CRC Press. 1979 г. ISBN 978-0-8493-5352-9.
Фармакологические дозы медрогестона могут ингибировать снижение уровня тестостерона на 5а микросомальными препаратами из кожи и простаты.
- ^ Доброкачественная гипертрофия предстательной железы. Springer Science & Business Media. 6 декабря 2012. С. 266–. ISBN 978-1-4612-5476-8.
Медрогестон также обладает выраженной антиандрогенной активностью, хотя и не такой большой, как флутамид или ацетат ципротерона.
- ^ Deghenghi R, Revesz C, Gaudry R (май 1963). «Новый синтез и взаимосвязь структурной активности в 17-алкилированном прогестероне». Журнал медицинской химии. 6 (3): 301–4. Дои:10.1021 / jm00339a019. PMID 14185989.
- ^ "Drugs @ FDA: одобренные FDA лекарственные препараты". Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Получено 16 ноября 2016.
