Фотосинтез - Photosynthesis


Фотосинтез это процесс, используемый растениями и другими организмами для конвертировать Световая энергия в химическая энергия это может быть позже вышел для подпитки деятельности организмов. Эта химическая энергия хранится в углевод молекулы, такие как сахара, которые синтезируются из углекислый газ и воды - отсюда и название фотосинтез, от Греческий phs (φῶς), "свет" и загар (σύνθεσις), «собирая».[1][2][3] В большинстве случаев, кислород также выбрасывается как отходы. Наиболее растения, наиболее водоросли, и цианобактерии выполнить фотосинтез; такие организмы называются фотоавтотрофы. Фотосинтез в значительной степени отвечает за производство и поддержание содержание кислорода атмосферы Земли и поставляет большую часть энергии, необходимой для жизнь на Земле.[4]
Хотя фотосинтез осуществляется разными видами по-разному, процесс всегда начинается, когда энергия света поглощается белки называется реакционные центры которые содержат зеленый хлорофилл пигменты. В растениях эти белки содержатся внутри органеллы называется хлоропласты, которых больше всего в клетках листа, тогда как у бактерий они встроены в плазматическая мембрана. В этих светозависимых реакциях некоторая энергия используется для удаления электроны из подходящих веществ, таких как вода, с образованием газообразного кислорода. Водород, высвобождающийся при расщеплении воды, используется для создания еще двух соединений, которые служат в качестве кратковременных запасов энергии, позволяя его передаче управлять другими реакциями: эти соединения восстанавливаются. никотинамидадениндинуклеотидфосфат (НАДФН) и аденозинтрифосфат (АТФ), «энергетическая валюта» клеток.
У растений, водорослей и цианобактерий долгосрочное хранение энергии в виде сахаров производится последующей последовательностью светонезависимый реакция называется Цикл Кальвина; некоторые бактерии используют разные механизмы, такие как обратный цикл Кребса, чтобы достичь той же цели. В цикле Кальвина атмосферный углекислый газ составляет включены в уже существующие органические углеродные соединения, такие как рибулоза бисфосфат (РБП).[5] Используя АТФ и НАДФН, продуцируемые светозависимыми реакциями, полученные соединения затем уменьшенный и удаляется с образованием дополнительных углеводов, таких как глюкоза.
Вероятно, первые фотосинтезирующие организмы развился в начале эволюционная история жизни и, скорее всего, использовал восстановители Такие как водород или же сероводород, а не вода, как источники электронов.[6] Цианобактерии появились позже; то избыток кислорода они внесли непосредственный вклад в оксигенация Земли,[7] который оказал эволюция сложной жизни возможный. Сегодня средняя скорость захвата энергии фотосинтезом во всем мире составляет примерно 130тераватты,[8][9][10] что примерно в восемь раз больше текущего энергопотребление человеческой цивилизации.[11]Фотосинтезирующие организмы также конвертируют около 100–115 миллиардов тонны (91–104 петаграммы ) углерода в биомасса в год.[12][13]
Тот факт, что растения получают некоторую энергию от света, помимо воздуха, почвы и воды, был открыт в 1779 г. Ян Ингенхауз.
Обзор

Фотосинтезирующие организмы фотоавтотрофы, а это значит, что они могут синтезировать пища напрямую из углекислого газа и воды, используя энергию света. Однако не все организмы используют углекислый газ в качестве источника атомов углерода для фотосинтеза; фотогетеротрофы использовать в качестве источника углерода органические соединения, а не диоксид углерода.[4] У растений, водорослей и цианобактерий фотосинтез выделяет кислород. Это называется кислородный фотосинтез и на сегодняшний день это наиболее распространенный тип фотосинтеза, используемый живыми организмами. Хотя есть некоторые различия между кислородным фотосинтезом у растения, водоросли, и цианобактерии, общий процесс у этих организмов очень похож. Также существует множество разновидностей аноксигенный фотосинтез, используется в основном определенными типами бактерий, которые потребляют углекислый газ, но не выделяют кислород.
Углекислый газ превращается в сахар в процессе, называемом фиксация углерода; фотосинтез захватывает энергию солнечного света для преобразования углекислого газа в углевод. Фиксация углерода - это эндотермический редокс реакция. В общих чертах, фотосинтез противоположен клеточное дыхание: в то время как фотосинтез - это процесс восстановления углекислого газа до углеводов, клеточное дыхание - это окисление углеводов или других питательные вещества в углекислый газ. Питательные вещества, используемые в клеточном дыхании, включают углеводы, аминокислоты и жирные кислоты. Эти питательные вещества окисляются с образованием углекислого газа и воды, а также с высвобождением химической энергии, приводящей в движение организм. метаболизм. Фотосинтез и клеточное дыхание - это разные процессы, поскольку они происходят в разных последовательностях химических реакций и в разных клеточные отсеки.
Генерал уравнение для фотосинтеза, как было впервые предложено Корнелис ван Ниль следовательно является:[14]
- + + → + +
Поскольку вода используется в качестве донора электронов в кислородном фотосинтезе, уравнение этого процесса выглядит следующим образом:
- + + → + +
Это уравнение подчеркивает, что вода одновременно является реагентом в светозависимая реакция и продукт светонезависимая реакция, но отмена п молекулы воды с каждой стороны дают чистое уравнение:
- + + → +
Другие процессы заменяют другие соединения (например, арсенит ) для воды в роли источника электронов; например, некоторые микробы используют солнечный свет для окисления арсенита до арсенат:[15] Уравнение этой реакции:
- + + → + (используется для создания других соединений в последующих реакциях)[16]
Фотосинтез происходит в два этапа. На первом этапе светозависимые реакции или же легкие реакции улавливать энергию света и использовать ее для создания молекул-накопителей энергии АТФ и НАДФН. На втором этапе светонезависимые реакции используйте эти продукты для улавливания и уменьшения углекислого газа.
Большинство организмов, которые используют кислородный фотосинтез, используют видимый свет для светозависимых реакций, хотя по крайней мере три используют коротковолновую инфракрасный или, более конкретно, дальнее красное излучение.[17]
Некоторые организмы используют еще более радикальные варианты фотосинтеза. Немного археи используйте более простой метод, в котором используется пигмент, подобный тем, которые используются для зрения у животных. В бактериородопсин изменяет свою конфигурацию в ответ на солнечный свет, действуя как протонный насос. Это создает более прямой градиент протонов, который затем преобразуется в химическую энергию. Этот процесс не связан с фиксацией углекислого газа и не выделяет кислород и, по-видимому, развился отдельно от более распространенных типов фотосинтеза.[18][19]
Фотосинтетические мембраны и органеллы

- внешняя мембрана
- межмембранное пространство
- внутренняя мембрана (1 + 2 + 3: конверт)
- строма (водная жидкость)
- просвет тилакоида (внутри тилакоида)
- тилакоидная мембрана
- granum (стопка тилакоидов)
- тилакоид (ламелла)
- крахмал
- рибосома
- пластидная ДНК
- пластоглобула (капля липидов)
У фотосинтезирующих бактерий белки, которые собирают свет для фотосинтеза, встроены в клеточные мембраны. В простейшей форме речь идет о мембране, окружающей клетку.[20] Однако мембрану можно плотно сложить в цилиндрические листы, называемые тилакоиды,[21] или сгруппированы в круглые пузырьки называется интрацитоплазматические мембраны.[22] Эти структуры могут заполнять большую часть внутренней части клетки, придавая мембране очень большую площадь поверхности и, следовательно, увеличивая количество света, которое могут поглощать бактерии.[21]
У растений и водорослей фотосинтез происходит в органеллы называется хлоропласты. Типичный растительная клетка содержит от 10 до 100 хлоропластов. Хлоропласт окружен мембраной. Эта мембрана состоит из внутренней фосфолипидной мембраны, внешней фосфолипидной мембраны и межмембранного пространства. Мембрана окружена водной жидкостью, называемой стромой. В строму встроены стеки тилакоидов (грана), которые являются местом фотосинтеза. Тилакоиды выглядят как уплощенные диски. Сам тилакоид окружен тилакоидной мембраной, и в этом замкнутом объеме находится просвет или тилакоидное пространство. Встроенные в тилакоидную мембрану цельные и белок периферической мембраны комплексы фотосинтетической системы.
Растения поглощают свет в основном за счет пигмент хлорофилл. Зеленая часть светового спектра не поглощается, а отражается, что является причиной того, что большинство растений имеют зеленый цвет. Помимо хлорофилла, растения также используют такие пигменты, как каротины и ксантофиллы.[23] В водорослях также используется хлорофилл, но присутствуют и другие пигменты, такие как фикоцианин, каротины, и ксантофиллы в зеленые водоросли, фикоэритрин в красные водоросли (родофиты) и фукоксантин в бурые водоросли и диатомеи в результате получается большое разнообразие цветов.
Эти пигменты входят в состав растений и водорослей в виде комплексов, называемых антенными белками. В таких белках пигменты организованы для совместной работы. Такое сочетание белков еще называют светоуборочный комплекс.[24]
Хотя все клетки зеленых частей растения имеют хлоропласты, большинство из них находится в специально адаптированных структурах, называемых листья. Некоторые виды адаптировались к условиям сильного солнечного света и засушливость, например, многие Молочай и кактус виды имеют свои основные фотосинтетические органы в стеблях. Клетки во внутренних тканях листа, называемые мезофилл, может содержать от 450 000 до 800 000 хлоропластов на каждый квадратный миллиметр листа. Поверхность листа покрыта водостойким восковой кутикула что защищает лист от чрезмерного испарение воды и снижает абсорбцию ультрафиолетовый или же синий свет уменьшить обогрев. Прозрачный эпидермис слой позволяет свету проходить к частокол клетки мезофилла, в которых происходит большая часть фотосинтеза.
Светозависимые реакции

в светозависимые реакции, одна молекула пигмент хлорофилл поглощает один фотон и теряет один электрон. Этот электрон передается модифицированной форме хлорофилла, называемой феофитин, который передает электрон на хинон молекула, запускающая поток электронов вниз по электронная транспортная цепь что приводит к окончательному сокращению НАДФ к НАДФН. Кроме того, это создает протонный градиент (градиент энергии) через хлоропластная мембрана, который используется АТФ-синтаза в синтезе АТФ. Молекула хлорофилла в конечном итоге восстанавливает электрон, который она потеряла, когда молекула воды расщепляется в процессе, называемом фотолиз, который освобождает дикислород (O2) молекула как побочный продукт.
Общее уравнение светозависимых реакций в условиях нециклического электронного потока у зеленых растений:[25]
Не все длины волн света может поддерживать фотосинтез. Спектр фотосинтетического действия зависит от типа вспомогательные пигменты настоящее время. Например, у зеленых растений спектр действия напоминает спектр поглощения за хлорофиллы и каротиноиды с пиками поглощения в фиолетово-синем и красном свете. У красных водорослей спектр действия - сине-зеленый свет, что позволяет этим водорослям использовать синий конец спектра для роста в более глубоких водах, которые отфильтровывают более длинные волны (красный свет), используемые надземными зелеными растениями. Неабсорбированная часть световой спектр это то, что придает цвет фотосинтетическим организмам (например, зеленые растения, красные водоросли, пурпурные бактерии) и наименее эффективно для фотосинтеза в соответствующих организмах.
Схема Z
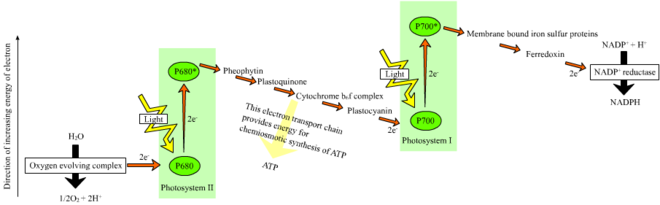
У растений светозависимые реакции происходят в тилакоидные мембраны из хлоропласты где они управляют синтезом АТФ и НАДФН. Светозависимые реакции бывают двух форм: циклические и нециклические.
В нециклической реакции фотоны попадают в светосборные антенные комплексы из фотосистема II к хлорофилл и другие вспомогательные пигменты (см. диаграмму справа). Поглощение фотона антенным комплексом освобождает электрон в результате процесса, называемого фотоиндуцированное разделение зарядов. Антенная система находится в ядре молекулы хлорофилла реакционного центра фотосистемы II. Этот освобожденный электрон передается основной молекуле-акцептору электронов, феофитину. Поскольку электроны перемещаются через электронная транспортная цепь (так называемой Z-схема показано на схеме), изначально он функционирует для создания хемиосмотический потенциал накачкой протонных катионов (H+) через мембрану в тилакоидное пространство. An АТФ-синтаза фермент использует этот хемиосмотический потенциал для производства АТФ во время фотофосфорилирование, в то время как НАДФН продукт терминала редокс реакция в Z-схема. Электрон входит в молекулу хлорофилла в Фотосистема I. Там он далее возбуждается светом, поглощаемым этим фотосистема. Затем электрон проходит по цепочке акцепторы электронов которому он передает часть своей энергии. Энергия, передаваемая акцепторам электронов, используется для перемещения ионов водорода через тилакоидную мембрану в просвет. Электрон в конечном итоге используется для восстановления кофермента НАДФ с помощью H+ НАДФН (который имеет функции в светонезависимой реакции); в этот момент путь этого электрона заканчивается.
Циклическая реакция аналогична нециклической, но отличается тем, что она генерирует только АТФ, а восстановленный НАДФ (НАДФН) не образуется. Циклическая реакция происходит только в фотосистеме I. После того, как электрон вытесняется из фотосистемы, электрон проходит по молекулам акцептора электронов и возвращается в фотосистему I, откуда он был испущен, отсюда и название. циклическая реакция.
Фотолиз воды
Линейный перенос электронов через фотосистему оставляет реакционный центр этой фотосистемы окисленным. Поднятие еще одного электрона сначала потребует повторного восстановления реакционного центра. Возбужденные электроны теряются из реакционного центра (P700) фотосистема I заменяются переводом из пластоцианин, электроны которого поступают в результате переноса электронов через фотосистема II. Фотосистема II, как первый шаг Z-схема, требуется внешний источник электронов для восстановления окисленного хлорофилла. а реакционный центр, названный P680. Источником электронов для фотосинтеза у зеленых растений и цианобактерий является вода. Две молекулы воды окисляются в четырех последовательных реакциях разделения заряда в фотосистеме II с образованием молекулы двухатомного кислород и четыре водород ионы. Полученные электроны переходят в окислительно-восстановительный тирозин остаток, который затем восстанавливает окисленный P680. Это сбрасывает способность P680 поглощать другой фотон и высвобождать еще один фотодиссоциированный электрон. Окисление воды - это катализированный в фотосистеме II окислительно-восстановительной структурой, содержащей четыре марганец ионы и ион кальция; это кислород-выделяющий комплекс связывает две молекулы воды и содержит четыре окислительных эквивалента, которые используются для запуска реакции окисления воды (диаграммы S-состояний Долая). Фотосистема II - единственный известный биологический фермент который осуществляет это окисление воды. Ионы водорода высвобождаются в просвете тилакоидов и, следовательно, вносят вклад в трансмембранный хемиосмотический потенциал, который приводит к синтезу АТФ. Кислород является побочным продуктом светозависимых реакций, но большинство организмов на Земле используют кислород для клеточное дыхание, включая фотосинтезирующие организмы.[26][27]
Светонезависимые реакции
Цикл Кальвина
в светонезависимый (или «темные») реакции, фермент RuBisCO захватывает CO2 от атмосфера и в процессе, называемом Цикл Кальвина, он использует новообразованный НАДФН и высвобождает трехуглеродные сахара, которые позже объединяются с образованием сахарозы и крахмала. Общее уравнение светонезависимых реакций у зеленых растений:[25]:128

Фиксация углерода производит промежуточный трехуглеродный сахарный продукт, который затем превращается в конечные углеводные продукты. Простые углеродные сахара, образующиеся в результате фотосинтеза, затем используются для образования других органических соединений, таких как строительный материал. целлюлоза, предшественники липид и аминокислота биосинтез, или как топливо в клеточное дыхание. Последний встречается не только у растений, но и у животные когда энергия растений проходит через пищевая цепочка.
Фиксация или восстановление углекислого газа - это процесс, при котором углекислый газ сочетается с пятиуглеродным сахаром, рибулоза 1,5-бисфосфат, чтобы получить две молекулы трехуглеродного соединения, глицерат 3-фосфат, также известный как 3-фосфоглицерат. Глицерат-3-фосфат, в присутствии АТФ и НАДФН производится на светозависимых стадиях, уменьшается до глицеральдегид-3-фосфат. Этот продукт также называют 3-фосфоглицеральдегидом (PGAL ) или, в более общем смысле, как триоза фосфат. Большая часть (5 из 6 молекул) производимого глицеральдегид-3-фосфата используется для регенерации рибулозо-1,5-бисфосфата, чтобы процесс можно было продолжить. Триозофосфаты, не «переработанные» таким образом, часто конденсируются с образованием гексоза фосфаты, которые в конечном итоге дают сахароза, крахмал и целлюлоза. Сахара, образующиеся при углеродной метаболизм образуют углеродные скелеты, которые можно использовать для других метаболических реакций, таких как производство аминокислоты и липиды.
Механизмы концентрирования углерода
На земле

В жарких и засушливых условиях растения закрывают свои устьица чтобы предотвратить потерю воды. В этих условиях CO
2 будет уменьшаться, а газообразный кислород, образующийся в результате световых реакций фотосинтеза, увеличиваться, вызывая увеличение фотодыхание посредством оксигеназа деятельность рибулозо-1,5-бисфосфаткарбоксилаза / оксигеназа и снижение фиксации углерода. Некоторые растения имеют развился механизмы для увеличения CO
2 концентрация в листьях в этих условиях.[28]
Растения, использующие C4 процесс фиксации углерода химически фиксирует углекислый газ в клетках мезофилла, добавляя его к трехуглеродной молекуле фосфоенолпируват (PEP), реакция, катализируемая ферментом, называемым Карбоксилаза PEP, создавая четырехуглеродную органическую кислоту щавелевоуксусная кислота. Щавелевоуксусная кислота или малат синтезированные этим процессом, затем перемещаются в специализированные связка ножен клетки, в которых фермент RuBisCO и другие ферменты цикла Кальвина, и где CO
2 выпущено декарбоксилирование четырехуглеродных кислот затем фиксируется активностью RuBisCO на трехуглеродном 3-фосфоглицериновые кислоты. Физическое отделение RuBisCO от световых реакций, генерирующих кислород, снижает фотодыхание и увеличивает CO
2 фиксация и, таким образом, фотосинтетическая способность листа.[29] C4 растения могут производить больше сахара, чем C3 растения в условиях повышенной освещенности и температуры. Многие важные культурные растения - это C.4 растения, включая кукурузу, сорго, сахарный тростник и просо. Растения, которые не используют PEP-карбоксилазу для фиксации углерода, называются C3 растения потому что реакция первичного карбоксилирования, катализируемая RuBisCO, производит трехуглеродные 3-фосфоглицериновые кислоты непосредственно в цикле Кальвина-Бенсона. Более 90% растений используют C3 фиксация углерода, по сравнению с 3%, которые используют C4 фиксация углерода;[30] однако эволюция C4 в более чем 60 линиях растений делает его ярким примером конвергентная эволюция.[28]
Ксерофиты, Такие как кактусы и большинство суккуленты, также используют карбоксилазу PEP для захвата диоксида углерода в процессе, называемом Метаболизм крассуловой кислоты (САМ). В отличие от C4 метаболизм, который пространственно отделяет CO
2 фиксация на ПКП из цикла Кальвина, САМ временно разделяет эти два процесса. У растений CAM анатомия листьев отличается от анатомии листьев C.3 растения и исправить CO
2 ночью, когда их устьица открыты. Заводы CAM хранят CO
2 в основном в виде яблочная кислота через карбоксилирование фосфоенолпируват в оксалоацетат, который затем восстанавливается до малата. Декарбоксилирование малата в течение дня высвобождает CO
2 внутри листьев, что позволяет углероду связывать 3-фосфоглицерат с помощью RuBisCO. Шестнадцать тысяч видов растений используют САМ.[31]
Оксалат кальция аккумулирующие растения, такие как Амарант гибридный и Колобантус quitensis, показали вариант фотосинтеза, в котором оксалат кальция кристаллы функционируют как динамические углеродные пулы, поставляя углекислый газ (CO2 ) к фотосинтетическим клеткам, когда устьица частично или полностью закрыты. Этот процесс получил название Тревожный фотосинтез. В стрессовых условиях (например, при дефиците воды) оксалат, выделяемый кристаллами оксалата кальция, превращается в CO.2 по оксалатоксидаза фермент и произведенный CO2 может поддержать Цикл Кальвина реакции. Реактивная перекись водорода (ЧАС2О2 ), побочный продукт оксалатоксидазной реакции, может быть нейтрализован каталаза. Тревожный фотосинтез представляет собой неизвестную вариацию фотосинтеза, которую нужно добавить к уже известным C4 и CAM пути. Однако тревожный фотосинтез, в отличие от этих путей, действует как биохимический насос, который собирает углерод изнутри органа (или из почвы), а не из атмосферы.[32][33]
В воде
Цианобактерии владеть карбоксисомы, которые увеличивают концентрацию CO
2 вокруг RuBisCO для увеличения скорости фотосинтеза. Фермент, карбоангидраза, расположенный в карбоксисоме, выделяет CO2 из растворенных гидрокарбонат-ионов (HCO−
3). Перед СО2 диффундирует, быстро поглощается RuBisCO, который концентрируется в карбоксисомах. HCO−
3 ионы сделаны из CO2 вне клетки другой карбоангидразой и активно перекачиваются в клетку мембранным белком. Они не могут пересечь мембрану, поскольку они заряжены, и в цитозоле они снова превращаются в CO.2 очень медленно без помощи карбоангидразы. Это приводит к тому, что HCO−
3 ионы накапливаются внутри клетки, откуда они диффундируют в карбоксисомы.[34] Пиреноиды в водоросли и роголистник также действовать, чтобы сконцентрироваться CO
2 вокруг RuBisCO.[35]
Порядок и кинетика
Общий процесс фотосинтеза проходит в четыре этапа:[13]
| Этап | Описание | Шкала времени |
|---|---|---|
| 1 | Передача энергии в антенном хлорофилле (тилакоидные мембраны) | фемтосекунда к пикосекунда |
| 2 | Перенос электронов в фотохимических реакциях (тилакоидные мембраны) | пикосекунда к наносекунда |
| 3 | Электронно-транспортная цепь и синтез АТФ (тилакоидные мембраны) | микросекунда к миллисекунда |
| 4 | Фиксация углерода и экспорт стабильной продукции | миллисекунда к второй |
Эффективность
Растения обычно превращают свет в химическая энергия с фотосинтетическая эффективность 3–6%.[36]Поглощенный непревращенный свет рассеивается в основном в виде тепла с небольшой долей (1-2%).[37] переиздан как флуоресценция хлорофилла на более длинных (красных) волнах. Этот факт позволяет измерять световую реакцию фотосинтеза с помощью флуорометров хлорофилла.[37]
Фактическая фотосинтетическая эффективность растений зависит от частоты преобразуемого света, интенсивности света, температуры и доли углекислого газа в атмосфере и может варьироваться от 0,1% до 8%.[38] По сравнению, солнечные панели преобразовать свет в электроэнергия при КПД примерно 6–20% для панелей массового производства и более 40% для лабораторных устройств.
Можно измерить эффективность как световых, так и темных реакций, но взаимосвязь между ними может быть сложной.[39] Например, энергетические молекулы АТФ и НАДФН, созданные световой реакцией, могут быть использованы для фиксации углерода или для фотодыхания в C3 растения.[39] Электроны могут также течь к другим электронным стокам.[40][41][42] По этой причине авторы нередко проводят различие между работой, выполняемой в условиях, не связанных с фотодыханием, и в условиях фотодыхания.[43][44][45]
Флуоресценция хлорофилла фотосистемы II может измерять световую реакцию, а инфракрасные газоанализаторы могут измерять темновую реакцию.[46] Также возможно проводить исследования как одновременно с использованием интегрированного флуориметра хлорофилла и системы газообмена, так и с использованием двух отдельных систем вместе.[47] Инфракрасные газоанализаторы и некоторые датчики влажности достаточно чувствительны для измерения фотосинтетической ассимиляции CO.2, а ΔH2O используя надежные методы[48] CO2 обычно измеряется в мкмоль / (м2/ с), частей на миллион или объема на миллион и H2O обычно измеряется в ммоль / (м2/ с) или в мбар.[48] Измеряя CO2 ассимиляция, ΔH2O, температура листа, барометрическое давление, площадь листа и фотосинтетически активная радиация или PAR, становится возможным оценить «A» или ассимиляцию углерода, «E» или транспирацию, «gs» или устьичную проводимость и Ci или внутриклеточный CO2.[48] Однако для измерения стресса растений чаще используется флуоресценция хлорофилла, где это возможно, потому что наиболее часто используемые параметры измерения FV / FM и Y (II) или F / FM 'могут быть сделаны за несколько секунд, что позволяет измерить более крупные популяции растений.[45]
Системы газообмена, которые предлагают контроль CO2 Уровни выше и ниже окружающей среды позволяют выполнять обычную практику измерения кривых A / Ci при различных CO2 уровни, чтобы охарактеризовать фотосинтетический ответ растения.[48]
Интегрированный флуориметр хлорофилла - системы газообмена позволяют более точно измерить реакцию и механизмы фотосинтеза.[46][47] В то время как стандартные системы фотосинтеза газообмена могут измерять Ci или субоматальный CO2 уровни, добавление интегрированных измерений флуоресценции хлорофилла позволяет более точно измерять CC заменить Ci.[47][49] Оценка CO2 в месте карбоксилирования в хлоропласте, или CC, становится возможным при измерении проводимости мезофилла или gм с использованием интегрированной системы.[46][47][50]
Системы измерения фотосинтеза не предназначены для прямого измерения количества света, поглощаемого листом. Но анализ флуоресценции хлорофилла, оптической плотности P700 и P515 и газообмена дает подробную информацию, например, о фотосистемы, квантовая эффективность и CO2 темпы ассимиляции. С помощью некоторых инструментов можно проанализировать даже зависимость фотосинтетической эффективности от длины волны.[51]
Явление, известное как квантовая прогулка значительно увеличивает эффективность передачи энергии света. В фотосинтетической клетке водорослей, бактерий или растений есть светочувствительные молекулы, называемые хромофоры расположены в форме антенны, названной фотокомплексом. Когда фотон поглощается хромофором, он превращается в квазичастица упоминается как экситон, который перескакивает с хромофора на хромофор в направлении реакционного центра фотокомплекса, набора молекул, которые улавливают его энергию в химической форме, которая делает ее доступной для метаболизма клетки. Волновые свойства экситона позволяют ему охватить более широкую область и опробовать несколько возможных путей одновременно, что позволяет ему мгновенно «выбрать» наиболее эффективный маршрут, по которому он будет иметь наибольшую вероятность прибытия в пункт назначения за минимально возможное время.
Поскольку это квантовое блуждание происходит при температурах, намного превышающих обычные квантовые явления, это возможно только на очень коротких расстояниях из-за препятствий в виде деструктивной интерференции, которые вступают в игру. Эти препятствия заставляют частицу на мгновение терять свои волновые свойства, прежде чем она снова их приобретет после того, как она будет освобождена из заблокированного положения посредством классического «прыжка». Таким образом, движение электрона к фотоцентру покрывается серией обычных прыжков и квантовых блужданий.[52][53][54]
Эволюция
Ранние фотосинтетические системы, например, в зеленый и пурпурная сера и зеленый и пурпурные несерные бактерии, как полагают, были аноксигенный, и в качестве доноры электронов. Считается, что зеленые и пурпурные серные бактерии использовали водород и сера как доноры электронов. Зеленые несерные бактерии использовали различные амино- и другие органические кислоты как донор электронов. Пурпурные несерные бактерии использовали множество неспецифических органических молекул. Использование этих молекул согласуется с геологическими доказательствами того, что ранняя атмосфера Земли была сильно развита. сокращение в то время.[55]
Окаменелости того, что считается нитчатый возраст фотосинтезирующих организмов составляет 3,4 миллиарда лет.[56][57] Более поздние исследования, опубликованные в марте 2018 года, также предполагают, что фотосинтез, возможно, начался около 3,4 миллиарда лет назад.[58][59]
Основной источник кислород в Атмосфера Земли происходит от кислородный фотосинтез, и его первое появление иногда называют кислородная катастрофа. Геологические данные свидетельствуют о том, что кислородный фотосинтез, такой как в цианобактерии, стало важным во время Палеопротерозой эпоху около 2 миллиардов лет назад. Современный фотосинтез у растений и большинства фотосинтезирующих прокариот является кислородным. Кислородный фотосинтез использует воду в качестве донора электронов, который окисленный к молекулярному кислороду (О
2) в фотосинтетический реакционный центр.
Симбиоз и происхождение хлоропластов

Образовалось несколько групп животных. симбиотический отношения с фотосинтетическими водорослями. Это наиболее часто встречается в кораллы, губки и морские анемоны. Предполагается, что это связано с особенно простой планы тела и большие площади поверхности этих животных по сравнению с их объемами.[60] Кроме того, несколько морских моллюски Elysia viridis и Elysia chlorotica также поддерживают симбиотические отношения с хлоропластами, которые они захватывают из водорослей в своем рационе и затем хранят в своих телах (см. Клептопластика ). Это позволяет моллюскам выживать только за счет фотосинтеза в течение нескольких месяцев.[61][62] Некоторые гены от растения ядро клетки были даже перенесены в слизней, так что хлоропласты могут снабжаться белками, которые им необходимы для выживания.[63]
Еще более близкая форма симбиоза может объяснить происхождение хлоропластов. Хлоропласты имеют много общего с фотосинтезирующими бактериями, включая круговой хромосома прокариотического типа рибосома, и подобные белки в центре реакции фотосинтеза.[64][65] В эндосимбиотическая теория предполагает, что фотосинтезирующие бактерии были приобретены ( эндоцитоз ) к раннему эукариотический клетки, чтобы сформировать первые клетки растения. Следовательно, хлоропласты могут быть фотосинтезирующими бактериями, которые приспособились к жизни внутри клеток растений. Нравиться митохондрии, хлоропласты обладают собственной ДНК, отдельной от ядерная ДНК их растительных клеток-хозяев и гены в этой ДНК хлоропластов напоминают гены, обнаруженные в цианобактерии.[66] ДНК в хлоропластах кодирует редокс белки, такие как те, что находятся в центрах фотосинтетической реакции. В Гипотеза CoRR предполагает, что это совместное расположение генов с их генными продуктами необходимо для окислительно-восстановительной регуляции экспрессии генов, и объясняет сохранение ДНК в биоэнергетических органеллах.[67]
Фотосинтетические эукариотические линии
Симбиотические и клептопластический исключены организмы:
- В глаукофиты и красный и зеленые водоросли —Клад Archaeplastida (одноклеточные и многоклеточные)
- В криптофиты —Клад Криптиста (одноклеточный)
- В гаптофиты —Клад Гаптиста (одноклеточный)
- В динофлагелляты и хромериды в суперфильме Myzozoa —Клад Альвеолаты (одноклеточный)
- В охрофиты —Клад Гетероконта (одноклеточные и многоклеточные)
- В хлорарахниофиты и три вида Паулинелла в типе Cercozoa —Клад Ризария (одноклеточный)
- В эвглениды —Клад Экскавата (одноклеточный)
За исключением эвгленид, все они принадлежат к Потогонные. Archaeplastida и фотосинтезирующая Paulinella получили свои пластиды через первичные эндосимбиоз в двух отдельных случаях, поглощая цианобактерию. Пластиды во всех других группах имеют происхождение от красных или зеленых водорослей и называются «красными линиями» и «зелеными линиями». Несмотря на то, что они способны выполнять фотосинтез, многие из них миксотрофы и практика гетеротрофия в различной степени.
Цианобактерии и эволюция фотосинтеза
Биохимическая способность использовать воду в качестве источника электронов в фотосинтезе возникла однажды, в общий предок из существующих цианобактерии (ранее называемые сине-зелеными водорослями), которые являются единственными прокариотами, выполняющими оксигенный фотосинтез. Геологические данные указывают на то, что это трансформирующее событие произошло в начале истории Земли, по крайней мере, 2450–2320 миллионов лет назад (млн лет назад) и, как предполагается, намного раньше.[68][69] Поскольку во время предполагаемого развития фотосинтеза атмосфера Земли почти не содержала кислорода, считается, что первые фотосинтезирующие цианобактерии не производили кислород.[70] Имеющиеся данные геобиологических исследований Архейский (> 2500 млн лет) осадочные породы указывает на то, что жизнь существовала 3500 млн лет назад, но вопрос о том, когда развился кислородный фотосинтез, все еще остается без ответа. Ясное палеонтологическое окно на цианобактерии эволюция открылся около 2000 млн лет назад, обнаружив и без того разнообразную биоту цианобактерий. Цианобактерии оставались основным первичные производители кислорода во всем Протерозойский эон (2500–543 млн лет назад), отчасти потому, что окислительно-восстановительная структура океанов благоприятствовала фотоавтотрофам, способным к азотфиксация.[нужна цитата ] Зеленые водоросли присоединились к цианобактериям в качестве основных производителей кислорода на континентальные шельфы ближе к концу Протерозойский, но это было только с Мезозойский (251–66 млн лет назад) излучение динофлагеллят, кокколитофорид и диатомовых водорослей привело к основное производство кислорода в водах морского шельфа принимают современный вид. Цианобактерии остаются критически важными для морские экосистемы в качестве первичные производители кислорода в океанических круговоротах как агенты биологической азотфиксации и, в модифицированном виде, как пластиды морских водорослей.[71]
Открытие
Хотя некоторые этапы фотосинтеза до сих пор полностью не изучены, общее уравнение фотосинтеза известно с XIX века.

Ян ван Гельмонт начал исследование процесса в середине 17 века, когда он тщательно измерил масса почвы, используемой растением, и массы растения по мере его роста. Заметив, что почвенная масса изменилась очень мало, он предположил, что масса растущего растения должна происходить из воды, единственного вещества, которое он добавил к горшечному растению. Его гипотеза была частично верной - большая часть набранной массы также происходит за счет углекислого газа, а также воды. Однако это было сигналом к мысли о том, что большая часть растений биомасса поступает от фотосинтеза, а не от самой почвы.
Джозеф Пристли, химик и министр, обнаружил, что, когда он изолировал объем воздуха под перевернутым сосудом и зажег в нем свечу (выделявшую CO2), свеча перегорит очень быстро, задолго до того, как закончится воск. Он также обнаружил, что мышь может аналогичным образом "травмировать" воздуха. Затем он показал, что воздух, который был «поврежден» свечой и мышью, можно восстановить с помощью растения.[72]
В 1779 г. Ян Ингенхауз повторил эксперименты Пристли. Он обнаружил, что именно влияние солнечного света на растение могло заставить его оживить мышь в считанные часы.[72][73]
В 1796 г. Жан Сенебье, швейцарский пастор, ботаник и натуралист, продемонстрировал, что зеленые растения потребляют углекислый газ и выделяют кислород под воздействием света. Вскоре после этого Николя-Теодор де Соссюр показали, что увеличение массы растения по мере роста не могло быть связано только с поглощением CO2 но также с добавлением воды. Таким образом, была изложена основная реакция, с помощью которой фотосинтез используется для производства пищи (например, глюкозы).[74]
Корнелис Ван Ниль сделал ключевые открытия, объясняющие химию фотосинтеза. Изучая пурпурные серные бактерии и зеленые бактерии, он первым продемонстрировал, что фотосинтез - это светозависимая окислительно-восстановительная реакция, в которой водород уменьшает (жертвует – электрон к) двуокись углерода.
Роберт Эмерсон открыл две световые реакции, тестируя продуктивность растений с использованием различных длин волн света. При использовании только красного цвета световые реакции подавлялись. Когда синий и красный были объединены, результат был намного более существенным. Таким образом, было две фотосистемы: одна поглощала волны с длиной волны до 600 нм, а другая - до 700 нм. Первый известен как PSII, второй - PSI. PSI contains only chlorophyll "a", PSII contains primarily chlorophyll "a" with most of the available chlorophyll "b", among other pigment. These include phycobilins, which are the red and blue pigments of red and blue algae respectively, and fucoxanthol for brown algae and diatoms. The process is most productive when the absorption of quanta are equal in both the PSII and PSI, assuring that input energy from the antenna complex is divided between the PSI and PSII system, which in turn powers the photochemistry.[13]
Роберт Хилл thought that a complex of reactions consisting of an intermediate to cytochrome b6 (now a plastoquinone), another is from cytochrome f to a step in the carbohydrate-generating mechanisms. These are linked by plastoquinone, which does require energy to reduce cytochrome f for it is a sufficient reductant. Further experiments to prove that the oxygen developed during the photosynthesis of green plants came from water, were performed by Hill in 1937 and 1939. He showed that isolated хлоропласты give off oxygen in the presence of unnatural reducing agents like утюг оксалат, феррицианид или же бензохинон after exposure to light. The Hill reaction[75] как следует:
- 2 ч2O + 2 A + (light, chloroplasts) → 2 AH2 + O2
where A is the electron acceptor. Therefore, in light, the electron acceptor is reduced and oxygen is evolved.
Сэмюэл Рубен и Мартин Камен использовал радиоактивные изотопы to determine that the oxygen liberated in photosynthesis came from the water.

Мелвин Кэлвин и Эндрю Бенсон, вместе с Джеймс Бэшэм, elucidated the path of carbon assimilation (the photosynthetic carbon reduction cycle) in plants. The carbon reduction cycle is known as the Цикл Кальвина, which ignores the contribution of Bassham and Benson. Many scientists refer to the cycle as the Calvin-Benson Cycle, Benson-Calvin, and some even call it the Calvin-Benson-Bassham (or CBB) Cycle.
Нобелевская премия -winning scientist Рудольф А. Маркус was able to discover the function and significance of the electron transport chain.
Отто Генрих Варбург и Дин Берк discovered the I-quantum photosynthesis reaction that splits the CO2, activated by the respiration.[76]
In 1950, first experimental evidence for the existence of фотофосфорилирование in vivo был представлен Otto Kandler using intact Хлорелла cells and interpreting his findings as light-dependent АТФ формирование.[77]В 1954 г. Дэниел И. Арнон и другие. discovered photophosphorylation in vitro in isolated хлоропласты with the help of P32.[78][79]
Louis N.M. Duysens и Jan Amesz discovered that chlorophyll a will absorb one light, oxidize cytochrome f, chlorophyll a (and other pigments) will absorb another light, but will reduce this same oxidized cytochrome, stating the two light reactions are in series.
Разработка концепции
В 1893 г. Чарльз Рид Барнс proposed two terms, photosyntax и фотосинтез, for the biological process of synthesis of complex carbon compounds out of carbonic acid, in the presence of chlorophyll, under the influence of light. Со временем срок фотосинтез came into common usage as the term of choice. Later discovery of anoxygenic photosynthetic bacteria and photophosphorylation necessitated redefinition of the term.[80]
C3 : C4 photosynthesis research
After WWII at late 1940 at the Калифорнийский университет в Беркли, the details of photosynthetic carbon metabolism were sorted out by the chemists Мелвин Кэлвин, Andrew Benson, James Bassham and a score of students and researchers utilizing the carbon-14 isotope and paper chromatography techniques.[81] The pathway of CO2 fixation by the algae Хлорелла in a fraction of a second in light resulted in a 3 carbon molecule called phosphoglyceric acid (PGA). For that original and ground-breaking work, a Нобелевская премия по химии was awarded to Melvin Calvin in 1961. In parallel, plant physiologists studied leaf gas exchanges using the new method of infrared gas analysis and a leaf chamber where the net photosynthetic rates ranged from 10 to 13 μmol CO2· М−2·s−1, with the conclusion that all terrestrial plants having the same photosynthetic capacities that were light saturated at less than 50% of sunlight.[82][83]
Later in 1958–1963 at Корнелл Университет, field grown кукуруза was reported to have much greater leaf photosynthetic rates of 40 μmol CO2· М−2·s−1 and was not saturated at near full sunlight.[84][85] This higher rate in maize was almost double those observed in other species such as wheat and soybean, indicating that large differences in photosynthesis exist among higher plants. At the University of Arizona, detailed gas exchange research on more than 15 species of monocot and dicot uncovered for the first time that differences in leaf anatomy are crucial factors in differentiating photosynthetic capacities among species.[86][87] In tropical grasses, including maize, sorghum, sugarcane, Bermuda grass and in the dicot amaranthus, leaf photosynthetic rates were around 38−40 μmol CO2· М−2·s−1, and the leaves have two types of green cells, i. е. outer layer of mesophyll cells surrounding a tightly packed cholorophyllous vascular bundle sheath cells. This type of anatomy was termed Kranz anatomy in the 19th century by the botanist Gottlieb Haberlandt while studying leaf anatomy of sugarcane.[88] Plant species with the greatest photosynthetic rates and Kranz anatomy showed no apparent photorespiration, very low CO2 compensation point, high optimum temperature, high stomatal resistances and lower mesophyll resistances for gas diffusion and rates never saturated at full sun light.[89] The research at Arizona was designated Citation Classic by the ISI 1986.[87] These species was later termed C4 plants as the first stable compound of CO2 fixation in light has 4 carbon as malate and aspartate.[90][91][92] Other species that lack Kranz anatomy were termed C3 type such as cotton and sunflower, as the first stable carbon compound is the 3-carbon PGA. At 1000 ppm CO2 in measuring air, both the C3 and C4 plants had similar leaf photosynthetic rates around 60 μmol CO2· М−2·s−1 indicating the suppression of photorespiration in C3 plants.[86][87]
Факторы

There are three main factors affecting photosynthesis[требуется разъяснение ] and several corollary factors. The three main are:[нужна цитата ]
Total photosynthesis is limited by a range of environmental factors. These include the amount of light available, the amount of лист area a plant has to capture light (shading by other plants is a major limitation of photosynthesis), rate at which carbon dioxide can be supplied to the хлоропласты to support photosynthesis, the availability of water, and the availability of suitable temperatures for carrying out photosynthesis.[93]
Light intensity (irradiance), wavelength and temperature

The process of photosynthesis provides the main input of free energy into the biosphere, and is one of four main ways in which radiation is important for plant life.[94]
The radiation climate within plant communities is extremely variable, with both time and space.
В начале 20 века Фредерик Блэкман и Габриэль Маттеи investigated the effects of light intensity (сияние ) and temperature on the rate of carbon assimilation.
- At constant temperature, the rate of carbon assimilation varies with irradiance, increasing as the irradiance increases, but reaching a plateau at higher irradiance.
- At low irradiance, increasing the temperature has little influence on the rate of carbon assimilation. At constant high irradiance, the rate of carbon assimilation increases as the temperature is increased.
These two experiments illustrate several important points: First, it is known that, in general, photochemical reactions are not affected by температура. However, these experiments clearly show that temperature affects the rate of carbon assimilation, so there must be two sets of reactions in the full process of carbon assimilation. Эти light-dependent 'photochemical' temperature-independent stage, and the light-independent, temperature-dependent stage. Second, Blackman's experiments illustrate the concept of ограничивающие факторы. Another limiting factor is the wavelength of light. Cyanobacteria, which reside several meters underwater, cannot receive the correct wavelengths required to cause photoinduced charge separation in conventional photosynthetic pigments. To combat this problem, a series of proteins with different pigments surround the reaction center. Этот блок называется фикобилисома.[требуется разъяснение ]
Carbon dioxide levels and photorespiration

As carbon dioxide concentrations rise, the rate at which sugars are made by the светонезависимые реакции increases until limited by other factors. RuBisCO, the enzyme that captures carbon dioxide in the light-independent reactions, has a binding affinity for both carbon dioxide and oxygen. When the concentration of carbon dioxide is high, RuBisCO will исправить углекислый газ. However, if the carbon dioxide concentration is low, RuBisCO will bind oxygen instead of carbon dioxide. This process, called фотодыхание, uses energy, but does not produce sugars.
RuBisCO oxygenase activity is disadvantageous to plants for several reasons:
- One product of oxygenase activity is phosphoglycolate (2 carbon) instead of 3-phosphoglycerate (3 carbon). Phosphoglycolate cannot be metabolized by the Calvin-Benson cycle and represents carbon lost from the cycle. A high oxygenase activity, therefore, drains the sugars that are required to recycle ribulose 5-bisphosphate and for the continuation of the Цикл Кальвина-Бенсона.
- Phosphoglycolate is quickly metabolized to glycolate that is toxic to a plant at a high concentration; it inhibits photosynthesis.
- Salvaging glycolate is an energetically expensive process that uses the glycolate pathway, and only 75% of the carbon is returned to the Calvin-Benson cycle as 3-phosphoglycerate. The reactions also produce аммиак (NH3), which is able to размытый out of the plant, leading to a loss of nitrogen.
- A highly simplified summary is:
- 2 glycolate + ATP → 3-phosphoglycerate + carbon dioxide + ADP + NH3
The salvaging pathway for the products of RuBisCO oxygenase activity is more commonly known as фотодыхание, since it is characterized by light-dependent oxygen consumption and the release of carbon dioxide.
Смотрите также
- Ян Андерсон (ученый)
- Искусственный фотосинтез
- Цикл Кальвина-Бенсона
- Фиксация углерода
- Клеточное дыхание
- Хемосинтез
- Daily light integral
- Реакция Хилла
- Интегрированный флуорометр
- Светозависимая реакция
- Органическая реакция
- Фотобиология
- Photoinhibition
- Фотосинтетический реакционный центр
- Фотосинтетически активное излучение
- Фотографиисистема
- Фотосистема I
- Фотосистема II
- Квантовая биология
- Радиосинтез
- Красный край
- Витамин Д
Рекомендации
- ^ "photosynthesis". Интернет-словарь этимологии. В архиве from the original on 2013-03-07. Получено 2013-05-23.
- ^ φῶς. Лидделл, Генри Джордж; Скотт, Роберт; Греко-английский лексикон на Проект Персей
- ^ σύνθεσις. Лидделл, Генри Джордж; Скотт, Роберт; Греко-английский лексикон на Проект Персей
- ^ а б Bryant DA, Frigaard NU (Nov 2006). "Prokaryotic photosynthesis and phototrophy illuminated". Тенденции в микробиологии. 14 (11): 488–496. Дои:10.1016/j.tim.2006.09.001. PMID 16997562.
- ^ Reece J, Urry L, Cain M, Wasserman S, Minorsky P, Jackson R (2011). Биология (Международное изд.). Река Аппер Сэдл, штат Нью-Джерси: Pearson Education. стр.235, 244. ISBN 978-0-321-73975-9.
This initial incorporation of carbon into organic compounds is known as carbon fixation.
- ^ Олсон Дж. М. (май 2006 г.). «Фотосинтез в архейскую эпоху». Фотосинтез Исследования. 88 (2): 109–117. Дои:10.1007 / s11120-006-9040-5. PMID 16453059. S2CID 20364747.
- ^ Buick R (Aug 2008). «Когда развился кислородный фотосинтез?». Philosophical Transactions of the Royal Society of London, Series B. 363 (1504): 2731–2743. Дои:10.1098 / rstb.2008.0041. ЧВК 2606769. PMID 18468984.
- ^ Nealson KH, Conrad PG (Dec 1999). «Жизнь: прошлое, настоящее и будущее». Philosophical Transactions of the Royal Society of London, Series B. 354 (1392): 1923–1939. Дои:10.1098 / рстб.1999.0532. ЧВК 1692713. PMID 10670014.
- ^ Уитмарш Дж, Говинджи (1999). «Фотосинтетический процесс». In Singhal GS, Renger G, Sopory SK, Irrgang KD, Govindjee (eds.). Концепции фотобиологии: фотосинтез и фотоморфогенез. Бостон: Kluwer Academic Publishers. С. 11–51. ISBN 978-0-7923-5519-9.
100×1015 grams of carbon/year fixed by photosynthetic organisms, which is equivalent to 4×1018 kJ/yr = 4×1021 J/yr of free energy stored as reduced carbon.
- ^ Стегер У., Ахтерберг В., Блок К., Боде Х., Френц В., Собрать С., Ханекамп Г., Имбоден Д., Янке М., Кост М., Курц Р., Нутцингер Х. Г., Зисемер Т. (2005). Sustainable development and innovation in the energy sector. Берлин: Springer. п. 32. ISBN 978-3-540-23103-5. В архиве from the original on 2016-09-02. Получено 2016-02-21.
The average global rate of photosynthesis is 130 TW.
- ^ «Мировое потребление первичной энергии по типам энергии и отдельным группам стран, 1980–2004 гг.». Управление энергетической информации. 31 июля 2006 г. Архивировано с оригинал (XLS) 9 ноября 2006 г.. Получено 2007-01-20.
- ^ Field CB, Behrenfeld MJ, Randerson JT, Falkowski P (Jul 1998). «Первичная продукция биосферы: интеграция наземных и океанических компонентов». Наука. 281 (5374): 237–240. Bibcode:1998Научный ... 281..237F. Дои:10.1126/science.281.5374.237. PMID 9657713. В архиве из оригинала на 2018-09-25. Получено 2018-04-20.
- ^ а б c «Фотосинтез». Энциклопедия науки и технологий Макгро-Хилла. 13. Нью-Йорк: Макгроу-Хилл. 2007. ISBN 978-0-07-144143-8.
- ^ Уитмарш Дж, Говинджи (1999). "Chapter 2: The Basic Photosynthetic Process". In Singhal GS, Renger G, Sopory SK, Irrgang KD, Govindjee (eds.). Concepts in Photobiology: Photosynthesis and Photomorphogenesis. Бостон: Kluwer Academic Publishers. п. 13. ISBN 978-0-7923-5519-9.
- ^ Anaerobic Photosynthesis, Новости химии и машиностроения, 86, 33, August 18, 2008, p. 36
- ^ Kulp TR, Hoeft SE, Asao M, Madigan MT, Hollibaugh JT, Fisher JC, Stolz JF, Culbertson CW, Miller LG, Oremland RS (Aug 2008). "Arsenic(III) fuels anoxygenic photosynthesis in hot spring biofilms from Mono Lake, California". Наука. 321 (5891): 967–970. Bibcode:2008Sci...321..967K. Дои:10.1126/science.1160799. PMID 18703741. S2CID 39479754.
- ^ «Ученые обнаружили уникальный микроб в самом большом озере Калифорнии». В архиве from the original on 2009-07-12. Получено 2009-07-20.
- ^ Plants: Diversity and Evolution В архиве 2016-09-01 at the Wayback Machine, page 14, Martin Ingrouille, Bill Eddie
- ^ Oakley T (19 December 2008). "Evolutionary Novelties: Opsins: An amazing evolutionary convergence". Архивировано из оригинал on 17 April 2019. Получено 17 апреля 2019.
- ^ Tavano CL, Donohue TJ (December 2006). "Development of the bacterial photosynthetic apparatus". Текущее мнение в микробиологии. 9 (6): 625–631. Дои:10.1016/j.mib.2006.10.005. ЧВК 2765710. PMID 17055774.
- ^ а б Mullineaux CW (1999). "The thylakoid membranes of cyanobacteria: structure, dynamics and function". Австралийский журнал физиологии растений. 26 (7): 671–677. Дои:10.1071/PP99027.
- ^ Sener MK, Olsen JD, Hunter CN, Schulten K (October 2007). "Atomic-level structural and functional model of a bacterial photosynthetic membrane vesicle". Труды Национальной академии наук Соединенных Штатов Америки. 104 (40): 15723–15728. Bibcode:2007PNAS..10415723S. Дои:10.1073/pnas.0706861104. ЧВК 2000399. PMID 17895378.
- ^ Кэмпбелл Н.А., Уильямсон Б., Хейден Р.Дж. (2006). Biology Exploring Life. Река Аппер Сэдл, Нью-Джерси: Prentice Hall. ISBN 978-0-13-250882-7. Архивировано из оригинал на 2014-11-02. Получено 2009-02-03.
- ^ Ziehe D, Dünschede B, Schünemann D (December 2018). "Molecular mechanism of SRP-dependent light-harvesting protein transport to the thylakoid membrane in plants". Фотосинтез Исследования. 138 (3): 303–313. Дои:10.1007/s11120-018-0544-6. ЧВК 6244792. PMID 29956039.
- ^ а б Raven PH, Evert RF, Eichhorn SE (2005). Biology of Plants (7-е изд.). Нью-Йорк: В. Х. Фриман и компания. стр.124–127. ISBN 978-0-7167-1007-3.
- ^ "Yachandra/Yano Group". Lawrence Berkeley National Laboratory. Архивировано из оригинал на 2019-07-22. Получено 2019-07-22.
- ^ Pushkar Y, Yano J, Sauer K, Boussac A, Yachandra VK (February 2008). "Structural changes in the Mn4Ca cluster and the mechanism of photosynthetic water splitting". Труды Национальной академии наук Соединенных Штатов Америки. 105 (6): 1879–1884. Bibcode:2008PNAS..105.1879P. Дои:10.1073/pnas.0707092105. ЧВК 2542863. PMID 18250316.
- ^ а б Williams BP, Johnston IG, Covshoff S, Hibberd JM (September 2013). "Phenotypic landscape inference reveals multiple evolutionary paths to C4 photosynthesis". eLife. 2: e00961. Дои:10.7554/eLife.00961. ЧВК 3786385. PMID 24082995.
- ^ Taiz L, Geiger E (2006). Физиология растений (4-е изд.). Sinauer Associates. ISBN 978-0-87893-856-8.
- ^ Monson RK, Sage RF (1999). "The Taxonomic Distribution of C
4 Photosynthesis". C₄ биология растений. Бостон: Академическая пресса. pp. 551–580. ISBN 978-0-12-614440-6. - ^ Dodd AN, Borland AM, Haslam RP, Griffiths H, Maxwell K (April 2002). "Crassulacean acid metabolism: plastic, fantastic". Журнал экспериментальной ботаники. 53 (369): 569–580. Дои:10.1093/jexbot/53.369.569. PMID 11886877.
- ^ Tooulakou, Georgia; Giannopoulos, Andreas; Nikolopoulos, Dimosthenis; Bresta, Panagiota; Dotsika, Elissavet; Orkoula, Malvina G.; Kontoyannis, Christos G.; Fasseas, Costas; Liakopoulos, Georgios; Klapa, Maria I.; Karabourniotis, George (August 2016). "Alarm Photosynthesis: Calcium Oxalate Crystals as an Internal CO 2 Source in Plants". Физиология растений. 171 (4): 2577–2585. Дои:10.1104/pp.16.00111. ISSN 0032-0889. ЧВК 4972262. PMID 27261065.
- ^ Gómez-Espinoza, Olman; González-Ramírez, Daniel; Bresta, Panagiota; Karabourniotis, George; Bravo, León A. (2020-10-02). "Decomposition of Calcium Oxalate Crystals in Colobanthus quitensis under CO2 Limiting Conditions". Растения. 9 (10): 1307. Дои:10.3390/plants9101307. ISSN 2223-7747. ЧВК 7600318. PMID 33023238.
- ^ Барсук MR, Price GD (февраль 2003 г.). "CO2 concentrating mechanisms in cyanobacteria: molecular components, their diversity and evolution". Журнал экспериментальной ботаники. 54 (383): 609–622. Дои:10.1093 / jxb / erg076. PMID 12554704.
- ^ Badger MR, Andrews JT, Whitney SM, Ludwig M, Yellowlees DC, Leggat W, Price GD (1998). "The diversity and coevolution of Rubisco, plastids, pyrenoids, and chloroplast-based CO2-concentrating mechanisms in algae". Канадский журнал ботаники. 76 (6): 1052–1071. Дои:10.1139/b98-074.
- ^ Miyamoto K. "Chapter 1 – Biological energy production". Renewable biological systems for alternative sustainable energy production (FAO Agricultural Services Bulletin – 128). Продовольственная и сельскохозяйственная организация Объединенных Наций. В архиве из оригинала 7 сентября 2013 г.. Получено 4 января 2009.
- ^ а б Maxwell K, Johnson GN (April 2000). "Chlorophyll fluorescence – a practical guide". Журнал экспериментальной ботаники. 51 (345): 659–668. Дои:10.1093/jexbot/51.345.659. PMID 10938857.
- ^ Govindjee R. "What is Photosynthesis?". Biology at Illinois. Архивировано из оригинал 27 мая 2014 г.. Получено 17 апреля 2014.
- ^ а б Rosenqvist E, van Kooten O (2006). "Chapter 2: Chlorophyll Fluorescence: A General Description and Nomenclature". In DeEll JA, Toivonen PM (eds.). Practical Applications of Chlorophyll Fluorescence in Plant Biology. Dordrecht, the Netherlands: Kluwer Academic Publishers. pp. 39–78.
- ^ Baker NR, Oxborough K (2004). "Chapter 3: Chlorophyll fluorescence as a probe of photosynthetic productivity". In Papaqeorgiou G, Govindjee (eds.). Chlorophylla Fluorescence a Signature of Photosynthesis. Dordrecht, The Netherlands: Springer. С. 66–79.
- ^ Flexas J, Escalnona JM, Medrano H (January 1999). "Water stress induces different levels of photosynthesis and electron transport rate regulation in grapevines". Растение, клетка и окружающая среда. 22 (1): 39–48. Дои:10.1046/j.1365-3040.1999.00371.x.
- ^ Fryer MJ, Andrews JR, Oxborough K, Blowers DA, Baker NR (1998). "Relationship between CO2 assimilation, photosynthetic electron transport, and active O2 metabolism in leaves of maize in the field during periods of low temperature". Физиология растений. 116 (2): 571–580. Дои:10.1104/pp.116.2.571. ЧВК 35114. PMID 9490760.
- ^ Earl H, Said Ennahli S (2004). "Estimating photosynthetic electron transport via chlorophyll fluorometry without Photosystem II light saturation". Фотосинтез Исследования. 82 (2): 177–186. Дои:10.1007/s11120-004-1454-3. PMID 16151873. S2CID 291238.
- ^ Genty B, Briantais J, Baker NR (1989). "The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence". Biochimica et Biophysica Acta (BBA) - Общие предметы. 990 (1): 87–92. Дои:10.1016/s0304-4165(89)80016-9.
- ^ а б Baker NR (2008). "Chlorophyll fluorescence: A probe of photosynthesis in vivo". Ежегодный обзор биологии растений. 59: 89–113. Дои:10.1146/annurev.arplant.59.032607.092759. PMID 18444897. S2CID 31451852.
- ^ а б c Bernacchi CJ, Portis AR, Nakano H, von Caemmerer S, Long SP (2002). "Temperature response of mesophyll conductance. Implications for the determination of Rubisco enzyme kinetics and for limitations to photosynthesis in vivo". Физиология растений. 130 (4): 1992–1998. Дои:10.1104/pp.008250. ЧВК 166710. PMID 12481082.
- ^ а б c d Ribas-Carbo M, Flexas J, Robinson SA, Tcherkez GG (2010). "В естественных условиях measurement of plant respiration". University of Wollongong Research Online.
- ^ а б c d Long SP, Bernacchi CJ (2003). "Gas exchange measurements, what can they tell us about the underlying limitations to photosynthesis? Procedures and sources of error". Журнал экспериментальной ботаники. 54 (392): 2393–2401. Дои:10.1093/jxb/erg262. PMID 14512377.
- ^ Bernacchi CJ, Portis A (2002). "R., Nakano H., von Caemmerer S., and Long S.P. (2002) Temperature response of nesophyll conductance. Implications for the determination of Rubisco enzyme kinetics and for limitations to photosynthesis in vivo". Физиология растений. 130 (4): 1992–1998. Дои:10.1104/pp.008250. ЧВК 166710. PMID 12481082.
- ^ Yin X, Struik PC (2009). "Theoretical reconsiderations when estimating the mesophyll conductanceto CO2 diffusion in leaves of C3 plants by analysis of combined gas exchange and chlorophyll fluorescence measurements". Растение, клетка и окружающая среда. 32 (11): 1513–1524 [1524]. Дои:10.1111/j.1365-3040.2009.02016.x. PMID 19558403.
- ^ Schreiber U, Klughammer C, Kolbowski J (2012). "Assessment of wavelength-dependent parameters of photosynthetic electron transport with a new type of multi-color PAM chlorophyll fluorometer". Фотосинтез Исследования. 113 (1–3): 127–144. Дои:10.1007/s11120-012-9758-1. ЧВК 3430841. PMID 22729479.
- ^ Palmer J (21 June 2013). "Plants 'seen doing quantum physics'". Новости BBC. В архиве из оригинала 3 октября 2018 г.. Получено 21 июн 2018.
- ^ Lloyd S (10 March 2014). "Quantum Biology: Better living through quantum mechanics". The Nature of Reality. Nova: PBS Online; WGBH Boston. В архиве из оригинала от 3 июля 2017 г.. Получено 8 сентября 2017.
- ^ Hildner R, Brinks D, Nieder JB, Cogdell RJ, van Hulst NF (June 2013). "Quantum coherent energy transfer over varying pathways in single light-harvesting complexes". Наука. 340 (6139): 1448–1451. Bibcode:2013Sci...340.1448H. Дои:10.1126/science.1235820. PMID 23788794. S2CID 25760719.
- ^ Gale J (2009). Astrobiology of Earth: The emergence, evolution and future of life on a planet in turmoil. Издательство Оксфордского университета. С. 112–113. ISBN 978-0-19-154835-2.
- ^ Davis K (2 October 2004). "Photosynthesis got a really early start". Новый ученый. В архиве с оригинала 1 мая 2015 г.. Получено 8 сентября 2017.
- ^ Hooper R (19 August 2006). "Revealing the dawn of photosynthesis". Новый ученый. В архиве from the original on 24 May 2015. Получено 8 сентября 2017.
- ^ Caredona, Tanai (6 March 2018). "Early Archean origin of heterodimeric Photosystem I". Гелион. 4 (3): e00548. Дои:10.1016/j.heliyon.2018.e00548. ЧВК 5857716. PMID 29560463. Архивировано из оригинал 1 апреля 2019 г.. Получено 23 марта 2018.
- ^ Howard V (7 March 2018). "Photosynthesis Originated A Billion Years Earlier Than We Thought, Study Shows". Журнал Astrobiology. Получено 23 марта 2018.[постоянная мертвая ссылка ]
- ^ Venn AA, Loram JE, Douglas AE (2008). "Photosynthetic symbioses in animals". Журнал экспериментальной ботаники. 59 (5): 1069–1080. Дои:10.1093/jxb/erm328. PMID 18267943.
- ^ Rumpho ME, Summer EJ, Manhart JR (May 2000). "Solar-powered sea slugs. Mollusc/algal chloroplast symbiosis". Физиология растений. 123 (1): 29–38. Дои:10.1104/pp.123.1.29. ЧВК 1539252. PMID 10806222.
- ^ Muscatine L, Greene RW (1973). Chloroplasts and algae as symbionts in molluscs. Международный обзор цитологии. 36. С. 137–169. Дои:10.1016/S0074-7696(08)60217-X. ISBN 978-0-12-364336-0. PMID 4587388.
- ^ Rumpho ME, Worful JM, Lee J, Kannan K, Tyler MS, Bhattacharya D, Moustafa A, Manhart JR (November 2008). «Горизонтальный перенос гена ядерного гена psbO водорослей в фотосинтезирующий морской слизень Elysia chlorotica». Труды Национальной академии наук Соединенных Штатов Америки. 105 (46): 17867–17871. Bibcode:2008PNAS..10517867R. Дои:10.1073 / pnas.0804968105. ЧВК 2584685. PMID 19004808.
- ^ Douglas SE (December 1998). "Plastid evolution: origins, diversity, trends". Текущее мнение в области генетики и развития. 8 (6): 655–661. Дои:10.1016/S0959-437X(98)80033-6. PMID 9914199.
- ^ Reyes-Prieto A, Weber AP, Bhattacharya D (2007). "The origin and establishment of the plastid in algae and plants". Ежегодный обзор генетики. 41: 147–168. Дои:10.1146/annurev.genet.41.110306.130134. PMID 17600460. S2CID 8966320.[постоянная мертвая ссылка ]
- ^ Raven JA, Allen JF (2003). "Genomics and chloroplast evolution: what did cyanobacteria do for plants?". Геномная биология. 4 (3): 209. Дои:10.1186/gb-2003-4-3-209. ЧВК 153454. PMID 12620099.
- ^ Allen JF (December 2017). "The CoRR hypothesis for genes in organelles". Журнал теоретической биологии. 434: 50–57. Дои:10.1016/j.jtbi.2017.04.008. PMID 28408315.
- ^ Tomitani A, Knoll AH, Cavanaugh CM, Ohno T (April 2006). "The evolutionary diversification of cyanobacteria: molecular-phylogenetic and paleontological perspectives". Труды Национальной академии наук Соединенных Штатов Америки. 103 (14): 5442–5447. Bibcode:2006PNAS..103.5442T. Дои:10.1073/pnas.0600999103. ЧВК 1459374. PMID 16569695.
- ^ "Cyanobacteria: Fossil Record". Ucmp.berkeley.edu. Архивировано из оригинал на 24.08.2010. Получено 2010-08-26.
- ^ Smith A (2010). Биология растений. Нью-Йорк: Наука Гарланд. п. 5. ISBN 978-0-8153-4025-6.
- ^ Herrero A, Flores E (2008). Цианобактерии: молекулярная биология, геномика и эволюция (1-е изд.). Caister Academic Press. ISBN 978-1-904455-15-8.
- ^ а б Martin, Daniel; Thompson, Andrew; Stewart, Iain; Gilbert, Edward; Hope, Katrina; Kawai, Grace; Griffiths, Alistair (2012-09-04). "A paradigm of fragile Earth in Priestley's bell jar". Экстремальная физиология и медицина. 1 (1): 4. Дои:10.1186/2046-7648-1-4. ISSN 2046-7648. ЧВК 3707099. PMID 23849304.
- ^ Гест, Ховард (2000). «Двухсотлетие д-ра Яна Инген-Хуса, доктора медицины (1730–1799), пионера исследований фотосинтеза». Фотосинтез Исследования. 63 (2): 183–90. Дои:10.1023 / А: 1006460024843. PMID 16228428. S2CID 22970505.
- ^ Евгений Рабинович (1945) Фотосинтез и родственные процессы через Библиотека наследия биоразнообразия
- ^ Уокер Д.А. (2002). "'И чье яркое присутствие »- высокая оценка Роберта Хилла и его реакции» (PDF). Фотосинтез Исследования. 73 (1–3): 51–54. Дои:10.1023 / А: 1020479620680. PMID 16245102. S2CID 21567780. Архивировано из оригинал (PDF) на 2008-03-09. Получено 2015-08-27.
- ^ Отто Варбург - биография В архиве 2010-12-15 на Wayback Machine. Nobelprize.org (1970-08-01). Проверено 11 ноября 2011.
- ^ Кандлер О. (1950). "Über die Beziehungen zwischen Phosphathaushalt und Photosynthese. I. Phosphatspiegelschwankungen bei Chlorella pyrenoidosa als Folge des Licht-Dunkel-Wechsels" [О взаимосвязи между метаболизмом фосфатов и фотосинтезом I. Вариации уровней фосфатов в Chlorella pyrenoidosa как следствие смены света на темноту] (PDF). Zeitschrift für Naturforschung. 5b (8): 423–437. Дои:10.1515 / znb-1950-0806. S2CID 97588826. В архиве (PDF) из оригинала на 2018-06-24. Получено 2018-06-26.
- ^ Арнон Д.И., Уотли FR, Аллен МБ (1954). «Фотосинтез изолированными хлоропластами. II. Фотофосфорилирование, преобразование света в энергию фосфатной связи». Журнал Американского химического общества. 76 (24): 6324–6329. Дои:10.1021 / ja01653a025.
- ^ Арнон Д.И. (1956). «Фосфорный обмен и фотосинтез». Ежегодный обзор физиологии растений. 7: 325–354. Дои:10.1146 / annurev.pp.07.060156.001545.
- ^ Гест Х (2002). «История слова фотосинтез и эволюция его определения». Фотосинтез Исследования. 73 (1–3): 7–10. Дои:10.1023 / А: 1020419417954. PMID 16245098. S2CID 11265932.
- ^ Кальвин М. (июль 1989 г.). «Сорок лет фотосинтеза и связанной с ним деятельности». Фотосинтез Исследования. 21 (1): 3–16. Дои:10.1007 / BF00047170 (неактивно 16.12.2020). PMID 24424488.CS1 maint: DOI неактивен по состоянию на декабрь 2020 г. (связь)
- ^ Вердуин Дж (1953). «Таблица скорости фотосинтеза в оптимальных, близких к естественным условиям». Являюсь. Дж. Бот. 40 (9): 675–679. Дои:10.1002 / j.1537-2197.1953.tb06540.x. JSTOR 2439681.
- ^ Verduin J, Whitwer EE, Cowell BC (1959). «Максимальные показатели фотосинтеза в природе». Наука. 130 (3370): 268–269. Bibcode:1959Научный ... 130..268В. Дои:10.1126 / science.130.3370.268. PMID 13668557. S2CID 34122342.
- ^ Хескет Дж. Д., Масгрейв Р. (1962). «Фотосинтез в полевых условиях. IV. Световые исследования отдельных листьев кукурузы». Crop Sci. 2 (4): 311–315. Дои:10.2135 / сельскохозяйственных культурci1962.0011183x000200040011x. S2CID 83706567.
- ^ Хескет Дж. Д., Мосс Д. Н. (1963). «Вариация реакции фотосинтеза на свет». Crop Sci. 3 (2): 107–110. Дои:10.2135 / сельскохозяйственных культурci1963.0011183X000300020002x.
- ^ а б Эль-Шаркави, Массачусетс, Хескет Дж. Д. (1965). "Фотосинтез между видами в зависимости от характеристик анатомии листа и CO2 диффузионные сопротивления ». Crop Sci. 5 (6): 517–521. Дои:10.2135 / сельскохозяйственных культурci1965.0011183x000500060010x.
- ^ а б c Эль-Шаркави М.А., Хескет Д.Д. (1986). "Citation Classic-Photosynthesis среди видов в связи с характеристиками анатомии листа и CO2 сопротивление диффузии » (PDF). Curr. Cont./Agr.Biol.Environ. 27: 14.[постоянная мертвая ссылка ]
- ^ Haberlandt G (1904). Physiologische Pflanzanatomie. Лейпциг: Энгельманн.
- ^ Эль-Шаркави М.А. (1965). Факторы, ограничивающие скорость фотосинтеза различных видов растений (Кандидатская диссертация). Университет Аризоны, Тусон, США.
- ^ Карпилов Ю.С. (1960). «Распределение радиоактивности углерода-14 среди продуктов фотосинтеза кукурузы». Proc. Казань с / х. Inst. 14: 15–24.
- ^ Корчак HP, Харт CE, Бурр Г.О. (1965). «Фиксация углекислого газа в листьях сахарного тростника». Физиология растений. 40 (2): 209–213. Дои:10.1104 / стр. 40.2.209. ЧВК 550268. PMID 16656075.
- ^ Хэтч MD, Slack CR (1966). «Фотосинтез листьями сахарного тростника. Новая реакция карбоксилирования и путь образования сахара». Biochem. J. 101 (1): 103–111. Дои:10.1042 / bj1010103. ЧВК 1270070. PMID 5971771.
- ^ Чапин Ф.С., Матсон П.А., Муни Х.А. (2002). Принципы экологии наземных экосистем. Нью-Йорк: Спрингер. С. 97–104. ISBN 978-0-387-95443-1.
- ^ Джонс HG (2014). Растения и микроклимат: количественный подход к экологической физиологии растений (Третье изд.). Кембридж: Издательство Кембриджского университета. ISBN 978-0-521-27959-8.
дальнейшее чтение
| Библиотечные ресурсы о Фотосинтез |
Книги
- Бидлак Дж. Э., Стерн К. Р., Янски С. (2003). Вводная биология растений. Нью-Йорк: Макгроу-Хилл. ISBN 978-0-07-290941-8.
- Бланкеншип RE (2014). Молекулярные механизмы фотосинтеза (2-е изд.). Джон Уайли и сыновья. ISBN 978-1-4051-8975-0.
- Говинджи, Битти Дж. Т., Гест Х, Аллен Дж. Ф. (2006). Открытия в фотосинтезе. Достижения в фотосинтезе и дыхании. 20. Берлин: Springer. ISBN 978-1-4020-3323-0.
- Рис JB и др. (2013). Кэмпбелл Биология. Бенджамин Каммингс. ISBN 978-0-321-77565-8.
Статьи
- Гупта Р.С., Мухтар Т., Сингх Б. (июнь 1999 г.). «Эволюционные отношения между фотосинтетическими прокариотами (Heliobacterium chlorum, Chloroflexus aurantiacus, цианобактерии, Хлоробиум тепидум и протеобактерии): последствия для происхождения фотосинтеза ". Молекулярная микробиология. 32 (5): 893–906. Дои:10.1046 / j.1365-2958.1999.01417.x. PMID 10361294. S2CID 33477550.
- Резерфорд А.В., Фаллер П. (январь 2003 г.). «Фотосистема II: эволюционные перспективы». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 358 (1429): 245–253. Дои:10.1098 / rstb.2002.1186. ЧВК 1693113. PMID 12594932.
внешняя ссылка
- Коллекция страниц фотосинтеза для всех уровней от известного эксперта (Говинджи)
- Углубленное, передовое лечение фотосинтеза, также от Говинджи
- Научная помощь: фотосинтез Статья, соответствующая науке в средней школе
- Метаболизм, клеточное дыхание и фотосинтез - виртуальная библиотека биохимии и клеточной биологии
- Общее обследование фотосинтеза на среднем уровне
- Общая энергетика фотосинтеза
- Вехи открытия фотосинтеза - эксперименты и предыстория
- Источник кислорода, производимый фотосинтезом Интерактивная анимация, учебное пособие
- Маршалл Дж. (29 марта 2011 г.). «Дебют первого практичного искусственного листа». Новости открытия.
- Фотосинтез - светозависимая и светонезависимая стадии
- Khan Academy, видео введение
- Эренберг Р. (2017-12-15). «Исправление фотосинтеза». Известный журнал.

