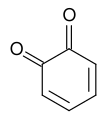
Хинон - Quinone
В хиноны являются классом органические соединения которые формально "производятся от ароматный соединения [такие как бензол или же нафталин ] путем преобразования четного числа –CH = групп в –C (= O) - групп с любой необходимой перегруппировкой двойные связи ", в результате чего" полностью сопряженный циклический диона структура".[1] [2][3]Типичным представителем этого класса является 1,4-бензохинон или циклогексадиендион, часто называемый просто «хиноном» (отсюда и название класса). Другие важные примеры: 1,2-бензохинон (орто-хинон), 1,4-нафтохинон и 9,10-антрахинон.
Характеристики
Хиноны представляют собой окисленные производные ароматических соединений и часто легко получаются из реакционноспособных ароматических соединений с электронодонорные заместители Такие как фенолы и катехины, которые увеличивают нуклеофильность кольца и способствуют большему окислительно-восстановительный потенциал необходимо для нарушения ароматичности. (Хиноны конъюгированы, но не ароматичны). Хиноны электрофильные Майкл акцепторы стабилизируется сопряжением. В зависимости от хинона и сайта восстановления восстановление может реоматизировать соединение или нарушить конъюгацию. Сопряженное добавление почти всегда нарушает спряжение.
Период, термин хинон также используется в более общем смысле для большого класса соединений, формально производных от ароматических хинонов путем замены некоторых водород атомы другими атомами или радикалами.

Хлоранил, реагент в органической химии
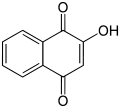
Lawsone, краситель, присутствующий в листьях хны
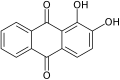
Ализарин, распространенный красный краситель
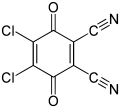
DDQ, реагент в органической химии

Даунорубицин, противораковый препарат
Возникновение и использование
Производство перекиси водорода
Хиноны широко применяются в промышленности для производства пероксид водорода. 2-Алкилантрахиноны гидрируются до соответствующих гидрохинонов (хинизаринов), которые затем переносят ЧАС
2 к кислороду:
- дигидроантрахинон + О
2 → антрахинон + ЧАС
2О
2
таким образом, несколько миллиардов килограммов ЧАС
2О
2 выпускаются ежегодно.[4]
1,4-Нафтохинон, полученный окислением нафталина с триоксид хрома.[5] Это предшественник антрахинона.
Биохимия
Убихинон -1 - это 1,4-бензохинон природного происхождения, который участвует в дыхание аппарат.

Предполагается, что они встречаются у всех дышащих организмов.[6] Некоторые из них служат акцепторами электронов в электронных транспортных цепочках, таких как фотосинтез (пластохинон, филлохинон ), и аэробного дыхания (убихинон ). Филлохинон также известен как Витамин К1 поскольку он используется животными для карбоксилирования определенных белков, которые участвуют в коагуляция крови, кость формирование и другие процессы. И наоборот, токсичность парацетамол связано с его метаболизмом хинонимин, который затем вступает в реакцию с белками печени, вызывая печеночную недостаточность.
В брызгах жуки-бомбардиры гидрохинон вступает в реакцию с перекисью водорода с образованием сильного пара, отпугивающего животных.
Автоокисление нейромедиатора дофамин и его предшественник L-Dopa генерирует сравнительно стабильный дофаминовый хинон, который ингибирует функционирование переносчика дофамина (DAT) и TH фермент, приводящий к снижению митохондриального АТФ производство.[7]
Другие натуральные продукты
Бензохинон блаттеллахинон - это половой феромон у тараканов.
Лекарственные
Некоторые хиноны представляют фармакологический интерес. Они образуют основной класс цитотоксинов, используемых в борьбе с раком. Одним из примеров является даунорубицин, который является антилейкемическим.[6] Некоторые из них показывают анти-опухолевый Мероприятия. Они воплощают некоторые претензии в травяной медицины. Эти приложения включают слабительное (сеннозиды ), противомикробные и противопаразитарные (Рейн и сапрортохинон, атоваквон ), противоопухолевый (эмодин и юглон ), ингибирование PGE2 биосинтез (арнебинон и арнебифуранон ) и анти-сердечно-сосудистые заболевания (Таншинон ).[8]
Другой препарат, содержащий хинон, - Мекарбинат (димкарбин ), образованный реакцией этилового эфира N-метил-β-аминокротонат с пара-бензохиноном. Другие включают Амендол, Оксифемедол, Фемедол все в FR5142 (M) - 1967-06-05.[требуется разъяснение ] Примечание: все это индолы, полученные Синтез индола Неницеску. Противоопухолевый Апазиквон.
Соединения бензохинона являются метаболитом парацетамол.[9]
Красители
Многие натуральные и искусственные красящие вещества (красители и пигменты ) являются производными хинона. Они уступают только азокрасители в качестве красителей, с особым акцентом на синий цвет. Ализарин (1,2-дигидрокси-9,10-антрахинон), экстрагированный из марена завод, был первым натуральным красителем, синтезированным из каменноугольной смолы.
Реагенты в органической химии
Бензохинон используется в органическая химия как окислитель. Сильно окисляющие хиноны включают: хлоранил и 2,3-дихлор-5,6-дициано-1,4-бензохинон (также известный как DDQ).[10]
Носитель заряда аккумулятора
9,10-антрахинон-2,7-дисульфоновая кислота (AQDS) - хинон, аналогичный хинону, встречающемуся в природе в ревень использовался в качестве носителя заряда в безметалловых проточные батареи.[11]
Номенклатура
Хиноны обычно называются с префиксом, который указывает на исходный ароматический углеводород («бензо-» для бензола, «нафто-» для нафталина, «антра-» для антрацен и т. д.) и суффикс «-хинон». Инфиксные множители «-di-», «-tri-», «-tetra-» (и т.д.) используются, когда имеется 4, 6, 8 (и т.д.) карбонилов. Положение карбонильных групп может быть указано перед префиксом (например, «1,4,5,8-нафтодихинон») или после него («антра-1,4-хинон»).
Смотрите также
- Антрахинон
- Бензохинон
- Нафтохинон
- Пластохинон
- Пирролохинолинхинон
- Хинон метид
- Хинондиимин - аналог азота, используемый в качестве антисептика. Амбазон
- Malbranchea cinnamomea
Рекомендации
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "Хиноны ". Дои:10.1351 / goldbook.Q05015
- ^ Патай, Саул; Раппопорт, Цви, ред. (1988). Хиноноидные соединения: Vol. 1 (1988). Дои:10.1002/9780470772119. ISBN 9780470772119.
- ^ Патай, Саул; Раппопорт, Цви, ред. (1988). Хиноноидные соединения: Vol. 2 (1988). Дои:10.1002/9780470772126. ISBN 9780470772126.
- ^ Густав Гур, Юрген Гленнеберг, Сильвия Якоби «Перекись водорода» в Энциклопедии промышленной химии Ульмана 2007, Wiley-VCH, Weinheim. Дои: 10.1002 / 14356007.a13_443.pub2.
- ^ Брауде Э. А .; Фосетт, Дж. С. (1953). «1,4-Нафтохинон». Органический синтез. 33: 50. Дои:10.15227 / orgsyn.033.0050.; Коллективный объем, 4, п. 698
- ^ а б О'Брайен, П.Дж. (1991). «Молекулярные механизмы цитотоксичности хинонов». Химико-биологические взаимодействия. 80 (1): 1–41. Дои:10.1016/0009-2797(91)90029-7. PMID 1913977.
- ^ Доршевска, Иоланта; Прендеки, Михал; Козубски, Маргарита Лианери и Войцех (2014-01-31). «Молекулярные эффекты терапии L-допа при болезни Паркинсона». Текущая геномика. 15 (1): 11–17. Дои:10.2174/1389202914666131210213042. ЧВК 3958954. PMID 24653659.
- ^ Лю Х., «Извлечение и выделение соединений из лекарственных растений» в «Методы исследования традиционных лекарственных трав», изд. Уиллоу Дж. Х. Лю, 2011 г., John Wiley and Sons, Inc.
- ^ Dahlin, D.C .; Miwa, G.T .; Lu, A. Y .; Нельсон, С. Д. (1984). «N-ацетил-п-бензохинонимин: продукт окисления ацетаминофена, опосредованный цитохромом P-450». Труды Национальной академии наук Соединенных Штатов Америки. 81 (5): 1327–1331. Bibcode:1984PNAS ... 81.1327D. Дои:10.1073 / pnas.81.5.1327. ЧВК 344826. PMID 6424115.
- ^ Марш, Джерри (1985), Продвинутая органическая химия: реакции, механизмы и структура (3-е изд.), Нью-Йорк: Wiley, ISBN 0-471-85472-7
- ^ Хускинсон, Брайан; Маршак, Майкл П .; Су, Чангвон; Эр, Сулейман; Герхардт, Майкл Р .; Гальвин, Купер Дж .; Чен, Сюйдун; Аспуру-Гузик, Алан; Гордон, Рой Дж .; Азиз, Майкл Дж. (9 января 2014 г.). «Безметалловая органо-неорганическая проточная батарея на водной основе» (PDF). Природа. 505 (7482): 195–198. Bibcode:2014Натура.505..195H. Дои:10.1038 / природа12909. PMID 24402280. S2CID 4459692.
внешняя ссылка
- Хиноны в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)