Синтез индола Неницеску - Nenitzescu indole synthesis
| Синтез индола Неницеску | |
|---|---|
| Названный в честь | Костин Ненишеску |
| Тип реакции | Реакция образования кольца |
В Синтез индола Неницеску это химическая реакция который образует 5-гидроксииндол производные от бензохинон и β-аминокротоновые сложные эфиры.

Эта реакция была названа в честь ее первооткрывателя, Костин Ненишеску, который впервые сообщил об этом в 1929 году.[1] Это может быть выполнено с рядом различных комбинаций R-групп, которые включают метил, метокси, этил, пропил и H заместители.[2] Существует также твердотельный вариант, в котором реакция протекает на полимерном каркасе с высокой степенью сшивки.[3] Синтез особенно интересен, потому что индолы являются основой ряда биохимически важных молекул, в том числе нейротрансмиттеры и новый класс противоопухолевых соединений.[4]
Механизм
Механизм реакции Неницеску состоит из Майкл дополнение, за которым следует нуклеофильная атака посредством енамин пи бонд, а затем устранение.[5]

Реакция была впервые опубликована Неницеску в 1929 году.[1] и с тех пор был усовершенствован Алленом и другие.[2] В своей публикации 1996 года Аллен и его коллеги исследовали влияние различных заместителей на исходный бензохинон на структуру конечного продукта. Эти стерические эффекты также свидетельствовали о том, что один из двух предложенных в настоящее время механизмов более вероятен, чем другой, что привело к публикации механизма, показанного выше.
Условия
Предварительное исследование, проведенное Каткевичей и другие. исследовал условия реакции синтеза Неницеску и сообщил о поведении реакции, когда она протекает в различных растворителях.[6] Их результаты показали, что реакция лучше всего протекает в высокополярном растворителе, и были предложены дальнейшие кинетические исследования, включающие изменение субстрата, реагентов, растворителей и присутствие кислот и оснований Льюиса. Два года спустя Вележева и другие. продолжил сообщать об альтернативной версии синтеза с использованием Катализатор кислоты Льюиса.[7] Они сообщают, что катализирующий эффект происходит от активации енамина через дикетодиенамин-ZnCl.2 сложный.
Однако, несмотря на улучшение условий, традиционный синтез Неницеску не подходил для использования в промышленных масштабах из-за относительно низкого выхода и полимеризации при нормальных условиях реакции. Первоначально считалось, что бензохинон необходимо использовать в 100% избытке, чтобы довести реакцию до завершения в таком масштабе, но Huang et al. сообщили, что превышение на 20–60% является наиболее эффективным.[8] Кроме того, они сообщили, что для идеальных условий для крупномасштабной реакции должно быть мольное соотношение бензохинона и этил-3-аминокротоната 1: 1,2-1,6, и реакция должна протекать при комнатной температуре. Этих условий достаточно для производства партий от 100 кг.
Одним из наиболее распространенных вариантов реакции Неницеску является твердая фаза вариант. Об этой реакции впервые сообщил Ketcha и другие., показано ниже.[3]
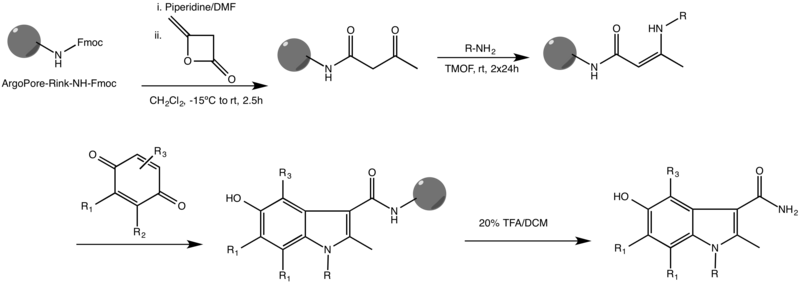
Это происходит на высоком сшитый Смола ArgoPore®-Rink-NH-Fmoc и функционирует с различными заместителями в обоих реагентах. Сообщалось также о других синтезах индола в твердой фазе, в некоторых из которых используются различные каркасы и металлические катализаторы, чтобы довести реакцию до завершения.
Есть также множество других реакций, которые приводят к тому же индольному скелету. В обзорной статье Табер и другие. разделите эти реакции на девять основных типов синтеза индола: Фишер, Мори, Хеметсбергер, Бухвальд, Сундберг, Маделунг, Неницеску, ван Леузен и Канемацу.[9]
Приложения
Скелет 5-гидроксииндола является основой ряда биохимически важных молекул. Среди них есть серотонин, нейротрансмиттер; индометацин, нестероидное противовоспалительное средство; L-761,066, а Ингибитор ЦОГ-2; и LY311727, ингибитор секреторной фосфолипазы.[3] В настоящее время одним из наиболее интересных приложений синтеза Неницеску является его способность производить предшественник противоопухолевых соединений. Этот синтез, о котором сообщалось в 2006 году, включает реакцию 1,4,9,10-антрадихинона с различными енаминами.[4] Продукты этой реакции составляют новый класс ведущих структур для разработки противоопухолевых препаратов.
использованная литература
- ^ а б Неницеску, C.D. (1929). «Производные 2-метил-5-гидроксииндола». Бык. Soc. Чим. Румыния. 11: 37–43.
- ^ а б Allen, G .; Pidacks, C .; Вайс, М. (5 июня 1996 г.). "Митомициновые антибиотики. Синтетические исследования". Варенье. Chem. Soc. 88 (11): 2536–2544. Дои:10.1021 / ja00963a032. PMID 5941382.
- ^ а б c Кетча, Дэниел М .; Wilson, L.J .; Портлок, Д. (2000). «Твердофазный синтез индола Неницеску». Буквы Тетраэдра. 41 (33): 6253–6257. Дои:10.1016 / S0040-4039 (00) 00697-3.
- ^ а б Шенк, Лотар Вернер; Kuna, K .; Франк, W .; Альберт, А .; Asche, C .; Kucklaender, U. (10 января 2006 г.). «1,4,9,10-Антрадихинон в качестве предшественника противоопухолевых соединений». Биоорганическая и медицинская химия. 14 (10): 3599–3614. Дои:10.1016 / j.bmc.2006.01.026. PMID 16458517.
- ^ Ли, Джи Джек (2009). Название Реакции, 4-е изд.. Берлин: Springer-Verlag. стр.391 –392. ISBN 978-3642010521.
- ^ Каткевица, Дазе; Trapencieris, P .; Boman, A .; Kalvins, I .; Лундштедт, Т. (2004). «Реакция Неницеску: начальный отбор экспериментальных условий для улучшения выхода модельной реакции». J. Chemometrics. 18 (34): 1883–187. Дои:10.1002 / cem.863. S2CID 95058789.
- ^ Вележева, Валерия С .; Соколов, А.И .; Корниенко, А.Г .; Лысенко, К.А .; Нелюбина, Ю.В .; Годовиков, И.А .; Перегудов, А.С .; Миронов, А.Ф. (15 сентября 2008 г.). «Орле кислоты Льюиса в синтезе индола Неницеску». Буквы Тетраэдра. 49 (50): 7106–7109. Дои:10.1016 / j.tetlet.2008.09.087.
- ^ Хуан, Юнь-Шэн; Zhang, W .; Чжан, X .; Ван, Дж. (2010). «Технологический синтез 5-гидрокси-2-метил-1H-индола». Исследование химических промежуточных продуктов. 36 (8): 975–983. Дои:10.1007 / с11164-010-0210-х. S2CID 94168531.
- ^ Табер, Дуглас Ф .; Тирунахари, П.К. (21 июня 2011 г.). «Синтез индола: обзор и предлагаемая классификация». Тетраэдр. 67 (38): 7195–7210. Дои:10.1016 / j.tet.2011.06.040. ЧВК 4255418. PMID 25484459.
