Жирная кислота - Fatty acid
| Виды жиры в еда |
|---|
| Смотрите также |
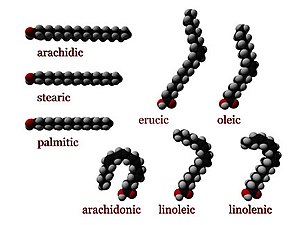
В химия, особенно в биохимия, а жирная кислота это карбоновая кислота с длинным алифатический цепочка, которая либо насыщенный или ненасыщенный. Большинство встречающихся в природе жирных кислот имеют неразветвленная цепь четного числа атомов углерода от 4 до 28.[1] Жирные кислоты обычно не встречаются в организмах в их отдельной форме, а вместо этого существуют в виде трех основных классов сложные эфиры: триглицериды, фосфолипиды, и эфиры холестерина. В любой из этих форм важны жирные кислоты. диетический источники топлива для животных, и они являются важными структурными элементами для клетки.
История
Понятие о жирных кислотах (Acide Gras) был введен в 1813 г. Мишель Эжен Шеврёль,[2][3][4] хотя изначально он использовал несколько вариантов терминов: Graisse Acide и Acide Huileux («кислый жир» и «масляная кислота»).[5]
Типы жирных кислот

Жирные кислоты классифицируются по-разному: по длине, по насыщенности и ненасыщенности, по четному и нечетному содержанию углерода, а также по линейным и разветвленным.
Длина жирных кислот
- Короткоцепочечные жирные кислоты (SCFA) жирные кислоты с алифатический хвосты из пяти или меньше угли (например. Масляная кислота ).[6]
- Жирные кислоты со средней длиной цепи (MCFA) жирные кислоты с алифатический хвосты от 6 до 12[7] угли, которые могут образовывать триглицериды со средней длиной цепи.
- Длинноцепочечные жирные кислоты (LCFA) жирные кислоты с алифатический хвосты от 13 до 21 угли.[8]
- Жирные кислоты с очень длинной цепью (VLCFA) жирные кислоты с алифатический хвосты из 22 и более угли.
Насыщенные жирные кислоты
Насыщенные жирные кислоты не имеют двойных связей C = C. У них одинаковая формула CH3(CH2)пCOOH, с вариациями на "n". Важная насыщенная жирная кислота - это стеариновая кислота (n = 16), которая при нейтрализации щелочью является наиболее распространенной формой мыло.

| Распространенное имя | Химическая структура | C:D[9] |
|---|---|---|
| Каприловая кислота | CH3(CH2)6COOH | 8:0 |
| Каприновая кислота | CH3(CH2)8COOH | 10:0 |
| Лауриновая кислота | CH3(CH2)10COOH | 12:0 |
| Миристиновая кислота | CH3(CH2)12COOH | 14:0 |
| Пальмитиновая кислота | CH3(CH2)14COOH | 16:0 |
| Стеариновая кислота | CH3(CH2)16COOH | 18:0 |
| Арахидовая кислота | CH3(CH2)18COOH | 20:0 |
| Бегеновая кислота | CH3(CH2)20COOH | 22:0 |
| Лигноцериновая кислота | CH3(CH2)22COOH | 24:0 |
| Серотовая кислота | CH3(CH2)24COOH | 26:0 |
Ненасыщенные жирные кислоты
Ненасыщенные жирные кислоты имеют один или несколько C = C двойные связи. Двойные связи C = C могут давать либо СНГ или же транс изомеры.
- СНГ
- А СНГ Конфигурация означает, что два атома водорода, примыкающие к двойной связи, выступают на одной стороне цепи. Жесткость двойной связи замораживает ее конформацию, и в случае СНГ изомер, заставляет цепь изгибаться и ограничивает конформационную свободу жирной кислоты. Чем больше двойных связей в цепочке СНГ конфигурации, тем меньше у нее гибкости. Когда в сети много СНГ связей, он становится довольно изогнутым в своих наиболее доступных формах. Например, олеиновая кислота, с одной двойной связью, имеет "излом", тогда как линолевая кислота, с двумя двойными связями, имеет более выраженный изгиб. α-линоленовая кислота, с тремя двойными связями, имеет форму крючка. Эффект этого заключается в том, что в ограниченных средах, например, когда жирные кислоты являются частью фосфолипида в липидном бислое или триглицериды в липидных каплях, цис-связи ограничивают способность жирных кислот к плотной упаковке и, следовательно, могут влиять на температура плавления мембраны или жира. Однако цис-ненасыщенные жирные кислоты увеличивают текучесть клеточных мембран, а транс-ненасыщенные жирные кислоты - нет.
- транс
- А транс конфигурация, напротив, означает, что два соседних атома водорода лежат на противоположный стороны цепи. В результате они не вызывают сильного изгиба цепи, а их форма похожа на прямые насыщенные жирные кислоты.
В большинстве встречающихся в природе ненасыщенных жирных кислот каждая двойная связь имеет три (п-3 ), шесть (п-6 ) или девять (п-9 ) атомы углерода после него, и все двойные связи имеют цис-конфигурацию. Большинство жирных кислот в транс конфигурация (транс-жиры ) не встречаются в природе и являются результатом обработки человеком (например, гидрирование ). Некоторые трансжирные кислоты естественным образом содержатся в молоке и мясе жвачные животные (например, крупный рогатый скот и овцы). Они производятся ферментацией в рубце этих животных. Они также встречаются в молочные продукты из молока жвачных животных, а также может быть найден в грудное молоко женщин, которые получили их из своего рациона.
Геометрические различия между различными типами ненасыщенных жирных кислот, а также между насыщенными и ненасыщенными жирными кислотами играют важную роль в биологических процессах и в построении биологических структур (таких как клеточные мембраны).
| Распространенное имя | Химическая структура | ΔИкс[10] | C:D[9] | ИЮПАК[11] | п−Икс[12] |
|---|---|---|---|---|---|
| Миристолеиновая кислота | CH3(CH2)3CH = CH(CH2)7COOH | СНГ-Δ9 | 14:1 | 14:1(9) | п−5 |
| Пальмитолеиновая кислота | CH3(CH2)5CH = CH(CH2)7COOH | СНГ-Δ9 | 16:1 | 16:1(9) | п−7 |
| Сапиеновая кислота | CH3(CH2)8CH = CH(CH2)4COOH | СНГ-Δ6 | 16:1 | 16:1(6) | п−10 |
| Олеиновая кислота | CH3(CH2)7CH = CH(CH2)7COOH | СНГ-Δ9 | 18:1 | 18:1(9) | п−9 |
| Элаидиновая кислота | CH3(CH2)7CH = CH(CH2)7COOH | транс-Δ9 | 18:1 | п−9 | |
| Вакценовая кислота | CH3(CH2)5CH = CH(CH2)9COOH | транс-Δ11 | 18:1 | п−7 | |
| Линолевая кислота | CH3(CH2)4CH = CHCH2CH = CH(CH2)7COOH | СНГ,СНГ-Δ9, Δ12 | 18:2 | 18:2(9,12) | п−6 |
| Линоэлаидовая кислота | CH3(CH2)4CH = CHCH2CH = CH(CH2)7COOH | транс,транс-Δ9, Δ12 | 18:2 | п−6 | |
| α-линоленовая кислота | CH3CH2CH = CHCH2CH = CHCH2CH = CH(CH2)7COOH | СНГ,СНГ,СНГ-Δ9, Δ12, Δ15 | 18:3 | 18:3(9,12,15) | п−3 |
| Арахидоновая кислота | CH3(CH2)4CH = CHCH2CH = CHCH2CH = CHCH2CH = CH(CH2)3COOHNIST | СНГ,СНГ,СНГ,СНГ-Δ5Δ8, Δ11, Δ14 | 20:4 | 20:4(5,8,11,14) | п−6 |
| Эйкозапентаеновая кислота | CH3CH2CH = CHCH2CH = CHCH2CH = CHCH2CH = CHCH2CH = CH(CH2)3COOH | СНГ,СНГ,СНГ,СНГ,СНГ-Δ5, Δ8, Δ11, Δ14, Δ17 | 20:5 | 20:5(5,8,11,14,17) | п−3 |
| Эруковая кислота | CH3(CH2)7CH = CH(CH2)11COOH | СНГ-Δ13 | 22:1 | 22:1(13) | п−9 |
| Докозагексаеновая кислота | CH3CH2CH = CHCH2CH = CHCH2CH = CHCH2CH = CHCH2CH = CHCH2CH = CH(CH2)2COOH | СНГ,СНГ,СНГ,СНГ,СНГ,СНГ-Δ4, Δ7, Δ10, Δ13, Δ16, Δ19 | 22:6 | 22:6(4,7,10,13,16,19) | п−3 |
Четные и нечетные жирные кислоты
Большинство жирных кислот имеют четную цепочку, например стеариновая (C18) и олеиновая (C18), что означает, что они состоят из четного числа атомов углерода. Некоторые жирные кислоты имеют нечетное число атомов углерода; их называют жирными кислотами с нечетной цепью (OCFA). Наиболее распространенными OCFA являются насыщенные производные C15 и C17, пентадекановая кислота и гептадекановая кислота соответственно, которые содержатся в молочных продуктах.[13][14] На молекулярном уровне OCFAs биосинтезируются и метаболизируются несколько иначе, чем родственники с четной цепью.
Номенклатура
Нумерация атомов углерода

Большинство встречающихся в природе жирных кислот имеют неразветвленная цепь атомов углерода, с карбоксильная группа (–COOH) на одном конце, а метильная группа (–CH3) на другом конце.
Положение углерод атомы в основной цепи жирной кислоты обычно обозначаются путем отсчета от 1 на конце -COOH. Углеродный номер Икс часто сокращается или C-Икс (или иногда CИкс), с Икс= 1, 2, 3 и т. Д. Это схема нумерации, рекомендованная ИЮПАК.
В другом соглашении используются буквы Греческий алфавит последовательно, начиная с первого углерода после карбоксил. Таким образом, углерод α (альфа ) представляет собой С-2, углерод β (бета ) является C-3 и так далее.
Хотя жирные кислоты могут иметь различную длину, в этом втором соглашении последний атом углерода в цепи всегда обозначается как ω (омега ), которая является последней буквой греческого алфавита. Третье соглашение о нумерации считает атомы углерода с этого конца, используя метки «ω», «ω-1», «ω-2». В качестве альтернативы метка "ω−Икс"написано" n−Икс", где" n "означает количество атомов углерода в цепи.[15]
В любой схеме нумерации положение двойная связь в цепи жирных кислот всегда указывается путем указания метки углерода, ближайшего к карбоксил конец.[15] Таким образом, в жирной кислоте из 18 атомов углерода, двойная связь между C-12 (или ω-6) и C-13 (или ω-5), как говорят, находится «в» положении C-12 или ω-6. Название кислоты ИЮПАК, такое как «октадек-12-еновая кислота» (или более произносимый вариант «12-октадекановая кислота»), всегда основано на нумерации «С».
Обозначение ΔИкс,у,... традиционно используется для обозначения жирной кислоты с двойными связями в положениях Икс,у, .... (Заглавная греческая буква «Δ» (дельта ) соответствует Римский "D", для Dдвойная связь). Так, например, 20-углеродный арахидоновая кислота есть Δ5,8,11,14, что означает, что он имеет двойные связи между атомами углерода 5 и 6, 8 и 9, 11 и 12 и 14 и 15.
В контексте рациона человека и метаболизма жиров ненасыщенные жирные кислоты часто классифицируются по положению двойной связи, ближайшей к ω-углероду (только), даже в случае множественные двойные связи такой как незаменимые жирные кислоты. Таким образом, арахидоновая кислота, линолевая кислота (18 атомов углерода, Δ9,12), и миристолеиновая кислота (14-углерод, Δ8) все классифицируются как "ω-3" жирные кислоты; это означает, что их формула заканчивается на –CH = CH–CH
2–CH
3.
Жирные кислоты с нечетное число атомов углерода называются жирные кислоты с нечетной цепью, тогда как остальные представляют собой жирные кислоты с четной цепью. Разница в том имеет отношение к глюконеогенезу.
Название жирных кислот
В следующей таблице описаны наиболее распространенные системы наименования жирных кислот.
| Номенклатура | Примеры | Объяснение |
|---|---|---|
| Банальный | Пальмитолеиновая кислота | Тривиальные имена (или же общие имена) - это несистематические исторические названия, которые являются наиболее частой системой именования в литературе. Наиболее распространенные жирные кислоты имеют тривиальные названия в дополнение к их систематические названия (Смотри ниже). Эти имена часто не соответствуют какой-либо схеме, но они краткие и часто недвусмысленные. |
| Систематический | цис-9-октадек-9-еновая кислота (9Z) -октадек-9-еновая кислота | Систематические названия (или же ИЮПАК имена) происходят от стандарта Правила ИЮПАК по номенклатуре органической химии, опубликовано в 1979 г.,[16] вместе с рекомендацией, опубликованной специально для липидов в 1977 году.[17] Нумерация атомов углерода начинается с карбоновый конец основной цепи молекулы. Двойные облигации помечены СНГ -/транс - обозначение или E -/Z - обозначения, где это необходимо. Эти обозначения обычно более подробны, чем общепринятая номенклатура, но имеют то преимущество, что они более технически ясны и наглядны. |
| ΔИкс | СНГ-Δ9, СНГ-Δ12 октадекадиеновая кислота | В ΔИкс (или же дельта-Икс) номенклатура, каждая двойная связь обозначена ΔИкс, где двойная связь начинается с Икс-я углерод-углеродная связь, подсчет из карбоновый конец основной цепи молекулы. Каждой двойной связи предшествует СНГ - или же транс - префикс, обозначающий конфигурацию молекулы вокруг связи. Например, линолевая кислота обозначен "СНГ-Δ9, СНГ-Δ12 октадекадиеновая кислота ". Эта номенклатура имеет то преимущество, что она менее многословна, чем систематическая, но не более технически ясна или описательна.[нужна цитата ] |
| п−Икс (или ω−Икс) | п−3 (или же ω − 3 ) | п−Икс (п минус Икс; также ω−Икс или же омега-Икс) номенклатура оба дают названия для отдельных соединений и классифицируют их по их вероятным биосинтетическим свойствам у животных. Двойная связь расположена на Иксth углерод-углеродная связь, подсчет от метил конец основной цепи молекулы. Например, α-линоленовая кислота классифицируется как п−3 или же Омега 3 жирная кислота, и поэтому она, вероятно, разделяет биосинтетический путь с другими соединениями этого типа. Ω−Икс, омега-Икс, или обозначение "омега" распространено в популярной литературе по питанию, но ИЮПАК отказался от этого в пользу п−Икс обозначения в технической документации.[16] Наиболее часто исследуемые пути биосинтеза жирных кислот: п−3 и п−6. |
| Липидные числа | 18:3 18: 3n3 18:3, СНГ,СНГ,СНГ-Δ9, Δ12, Δ15 18:3(9,12,15) | Липидные числа принять форму C:D,[9] куда C число атомов углерода в жирной кислоте и D - количество двойных связей в жирной кислоте. Если D больше единицы, предполагается, что двойные связи прерываются CH 2 единицы, т.е., с интервалом в 3 атома углерода вдоль цепи. Например, α-линоленовая кислота представляет собой жирную кислоту 18: 3, и ее три двойные связи расположены в положениях Δ9, Δ12, а Δ15. Это обозначение может быть неоднозначным, поскольку некоторые разные жирные кислоты могут иметь одинаковые C:D числа. Следовательно, когда существует неоднозначность, это обозначение обычно используется в паре с ΔИкс или же п−Икс срок.[16] Например, хотя α-линоленовая кислота и γ-линоленовая кислота оба имеют соотношение 18: 3, они могут быть однозначно описаны как 18: 3n3 и 18: 3n6 жирных кислот соответственно. Для той же цели IUPAC рекомендует использовать в скобках список позиций двойных связей, добавленный к обозначению C: D.[11] Например, IUPAC рекомендовал обозначения для α- и γ-линоленовой кислоты: 18: 3 (9,12,15) и 18: 3 (6,9,12) соответственно. |
Свободные жирные кислоты
Когда циркулирующий в плазма (жирные кислоты плазмы), а не в их сложный эфир, жирные кислоты известны как неэтерифицированные жирные кислоты (NEFA) или свободные жирные кислоты (FFA). FFA всегда привязаны к транспортный белок, Такие как альбумин.[18]
Производство
Промышленное
Жирные кислоты обычно производятся в промышленных масштабах гидролиз из триглицериды, с удалением глицерин (видеть олеохимические вещества ). Фосфолипиды представляют собой другой источник. Некоторые жирные кислоты производятся синтетически гидрокарбоксилирование алкенов.[19]
Гипероксигенированные жирные кислоты
Гипероксигенированные жирные кислоты производятся с помощью специальных промышленных процессов для кремы для кожи местного применения. Процесс основан на введении или насыщении пероксидов в сложные эфиры жирных кислот через присутствие ультрафиолетового света и барботирования газообразного кислорода при контролируемых температурах. Конкретно линоленовые кислоты было показано, что они играют важную роль в поддержании функции водного барьера кожи (предотвращая потерю воды и обезвоживание кожи).[20] В исследовании, проведенном в Испании в марте 2005 г. в журнале Journal of Wound Care, сравнивали коммерческий продукт с жирным плацебо и этот конкретный продукт был более эффективным и рентабельным.[21] Ряд таких Внебиржевой медицинские изделия теперь широко доступны. Однако местно применяется оливковое масло не был признан хуже в "рандомизированный "тройное слепое контролируемое исследование не меньшей эффективности", проведенное в Испании в 2015 году.[22][23] Коммерческие продукты, вероятно, будут менее грязными и более пригодными для стирки, чем оливковое масло или вазелин, оба из которых при местном применении могут испачкать одежду и постельное белье.
Животными
У животных жирные кислоты образуются из углеводов преимущественно в печень, жировая ткань, а молочные железы в период лактации.[24]
Углеводы превращаются в пируват к гликолиз как первый важный шаг в превращении углеводов в жирные кислоты.[24] Затем пируват декарбоксилируется с образованием ацетил-КоА в митохондрия. Однако этот ацетил-КоА необходимо транспортировать в цитозоль где происходит синтез жирных кислот. Это не может произойти напрямую. Чтобы получить цитозольный ацетил-КоА, цитрат (образуется конденсацией ацетил-КоА с оксалоацетат ) удален из цикл лимонной кислоты и переносится через внутреннюю митохондриальную мембрану в цитозоль.[24] Там он расщеплен Цитрат лиаза АТФ на ацетил-КоА и оксалоацетат. Оксалоацетат возвращается в митохондрии в виде малат.[25] Цитозольный ацетил-КоА карбоксилируется ацетил-КоА карбоксилаза в малонил-КоА, первый совершенный шаг в синтезе жирных кислот.[25][26]
Затем малонил-КоА участвует в повторяющейся серии реакций, которые удлиняют растущую цепь жирных кислот на два атома углерода за раз. Таким образом, почти все природные жирные кислоты имеют четное число атомов углерода. Когда синтез завершен, свободные жирные кислоты почти всегда объединяются с глицерином (три жирные кислоты на одну молекулу глицерина) с образованием триглицериды, основная форма хранения жирных кислот и, следовательно, энергии у животных. Однако жирные кислоты также являются важными компонентами фосфолипиды которые образуют фосфолипидные бислои из которых построены все мембраны клетки ( клеточная стенка, и мембраны, которые охватывают все органеллы внутри ячеек, таких как ядро, то митохондрии, эндоплазматический ретикулум, а аппарат Гольджи ).[24]
«Несвязанные жирные кислоты» или «свободные жирные кислоты», обнаруженные в кровообращении животных, происходят в результате распада (или липолиз ) хранимых триглицериды.[24][27] Поскольку они нерастворимы в воде, эти жирные кислоты транспортируются связанными с плазмой. альбумин. Уровни «свободных жирных кислот» в крови ограничены доступностью сайтов связывания альбумина. Они могут поступать из крови всеми клетками, имеющими митохондрии (за исключением клеток Центральная нервная система ). Жирные кислоты могут быть расщеплены только в митохондриях с помощью бета-окисление с последующим горением в цикл лимонной кислоты в CO2 и вода. Клетки центральной нервной системы, хотя и обладают митохондриями, не могут забирать свободные жирные кислоты из крови, поскольку гематоэнцефалический барьер невосприимчив к большинству свободных жирных кислот,[нужна цитата ] без учета короткоцепочечные жирные кислоты и жирные кислоты со средней длиной цепи.[28][29] Эти клетки должны производить свои собственные жирные кислоты из углеводов, как описано выше, чтобы производить и поддерживать фосфолипиды своих клеточных мембран и их органелл.[24]
Различия между видами животных
Исследования по клеточные мембраны из млекопитающие и рептилии обнаружили, что мембраны клеток млекопитающих состоят из более высокой доли полиненасыщенных жирных кислот (DHA, омега-3 жирные кислоты ) чем рептилии.[30] Исследования по составу жирных кислот птиц выявили те же пропорции, что и у млекопитающих, но с на 1/3 меньше омега-3 жирных кислот по сравнению с омега-6 для данного размера тела.[31] Такой состав жирных кислот приводит к более жидкой клеточной мембране, но также к такой, которая проницаема для различных ионов (H + и Na +), в результате чего клеточные мембраны становятся более дорогостоящими в обслуживании. Утверждалось, что эта стоимость обслуживания является одной из основных причин высокой скорости метаболизма и сопутствующих теплокровность млекопитающих и птиц.[30] Однако полиненасыщение клеточных мембран также может происходить в ответ на хронические низкие температуры. В рыбы все более холодная среда приводит к увеличению содержания в клеточных мембранах как мононенасыщенных, так и полиненасыщенных жирных кислот, чтобы поддерживать большую текучесть (и функциональность) мембран при более низких температуры.[32][33]
Жирные кислоты в пищевых жирах
В следующей таблице приведены жирные кислоты, витамин Е и холестерин состав некоторых общих диетических жиров.[34][35]
| Насыщенный | Мононенасыщенный | Полиненасыщенные | Холестерин | Витамин Е | |
|---|---|---|---|---|---|
| г / 100г | г / 100г | г / 100г | мг / 100г | мг / 100г | |
| Животные жиры | |||||
| Утиный жир[36] | 33.2 | 49.3 | 12.9 | 100 | 2.70 |
| Сало[36] | 40.8 | 43.8 | 9.6 | 93 | 0.60 |
| Жир[36] | 49.8 | 41.8 | 4.0 | 109 | 2.70 |
| Масло сливочное | 54.0 | 19.8 | 2.6 | 230 | 2.00 |
| Растительные жиры | |||||
| Кокосовое масло | 85.2 | 6.6 | 1.7 | 0 | .66 |
| Кокосовое масло | 60.0 | 32.9 | 3.0 | 0 | 1.8 |
| Пальмовое масло | 81.5 | 11.4 | 1.6 | 0 | 3.80 |
| пальмовое масло | 45.3 | 41.6 | 8.3 | 0 | 33.12 |
| Хлопковое масло | 25.5 | 21.3 | 48.1 | 0 | 42.77 |
| Масло зародышей пшеницы | 18.8 | 15.9 | 60.7 | 0 | 136.65 |
| Соевое масло | 14.5 | 23.2 | 56.5 | 0 | 16.29 |
| Оливковое масло | 14.0 | 69.7 | 11.2 | 0 | 5.10 |
| Кукурузное масло | 12.7 | 24.7 | 57.8 | 0 | 17.24 |
| Подсолнечное масло | 11.9 | 20.2 | 63.0 | 0 | 49.00 |
| Сафлоровое масло | 10.2 | 12.6 | 72.1 | 0 | 40.68 |
| Конопляное масло | 10 | 15 | 75 | 0 | 12.34 |
| Рапсовое / рапсовое масло | 5.3 | 64.3 | 24.8 | 0 | 22.21 |
Реакции жирных кислот
Жирные кислоты вступают в реакции, как и другие карбоновые кислоты, т.е. этерификация и кислотно-основные реакции.
Кислотность
Жирные кислоты не сильно различаются по кислотности, на что указывают их соответствующие пKа. Нонановая кислота, например, имеет pKа 4,96, что лишь немного слабее уксусной кислоты (4,76). По мере увеличения длины цепи растворимость жирных кислот в воде уменьшается, так что жирные кислоты с более длинной цепью имеют минимальное влияние на pH водного раствора. Даже те жирные кислоты, которые нерастворимы в воде, растворятся в теплой воде. этиловый спирт, и может быть титрованный с едкий натр решение с использованием фенолфталеин как индикатор. Этот анализ используется для определения содержания свободных жирных кислот в жирах; то есть доля триглицеридов, которые были гидролизованный.
Нейтрализация жирных кислот, т.е. омыление, это широко распространенный способ металлическое мыло.[37]
Гидрирование и закалка
Гидрирование ненасыщенных жирных кислот широко практикуется. Типичные условия включают 2,0–3,0 МПа H2 давление, 150 ° C, и никель, нанесенный на кремнезем в качестве катализатора. Эта процедура позволяет получить насыщенные жирные кислоты. Степень гидрирования обозначена значком йодное число. Гидрогенизированные жирные кислоты менее склонны к прогоркание. Поскольку насыщенные жирные кислоты более высокая температура плавления чем ненасыщенные предшественники, процесс называется закалкой. Соответствующая технология используется для преобразования растительных масел в маргарин. Гидрирование триглицеридов (по сравнению с жирными кислотами) выгодно, потому что карбоновые кислоты разрушают никелевые катализаторы, давая никелевые мыла. Во время частичного гидрирования ненасыщенные жирные кислоты могут быть изомеризованы из СНГ к транс конфигурация.[38]
Более форсированное гидрирование, т. Е. Использование более высоких давлений H2 и более высоких температур, превращает жирные кислоты в жирные спирты. Однако жирные спирты легче производить из жирных кислот. сложные эфиры.
в Варрентрапп реакция некоторые ненасыщенные жирные кислоты расщепляются в расплавленной щелочи, реакция, которая в какой-то момент имела отношение к выяснению структуры.
Автоокисление и прогорклость
Ненасыщенные жирные кислоты претерпевают химическое изменение, известное как самоокисление. Процесс требует кислорода (воздуха) и ускоряется наличием следов металлов. Растительные масла в небольшой степени сопротивляются этому процессу, потому что они содержат антиоксиданты, такие как токоферол. Жиры и масла часто обрабатывают хелатирующие агенты Такие как лимонная кислота удалить металлические катализаторы.
Озонолиз
Ненасыщенные жирные кислоты подвержены разложению под действием озона. Эта реакция практикуется при производстве азелаиновая кислота ((CH2)7(CO2ЧАС)2) из олеиновая кислота.[38]
Тираж
Пищеварение и потребление
Короткий- и жирные кислоты со средней длиной цепи всасываются непосредственно в кровь через капилляры кишечника и проходят через воротная вена так же, как и другие усвоенные питательные вещества. Тем не мение, длинноцепочечные жирные кислоты не попадают напрямую в капилляры кишечника. Вместо этого они всасываются в жировые стенки кишечника. ворсинки и снова собрать в триглицериды. Триглицериды покрыты холестерин и белок (белковая оболочка) в соединение, называемое хиломикрон.
Изнутри клетки хиломикрон выделяется в лимфатический капилляр называется молочный, который сливается с более крупными лимфатическими сосудами. Он транспортируется через лимфатическую систему и грудной проток вплоть до места около сердца (где артерии и вены больше). Грудной проток выводит хиломикроны в кровоток через левую подключичная вена. На этом этапе хиломикроны могут транспортировать триглицериды в ткани, где они хранятся или метаболизируются для получения энергии.
Метаболизм
При метаболизме жирные кислоты выделяют большое количество АТФ. Многие типы клеток могут использовать либо глюкоза или жирные кислоты для этой цели. Жирные кислоты (поступающие с пищей или за счет триглицеридов, хранящихся в жировых тканях) распределяются по клеткам и служат топливом для сокращения мышц и общего метаболизма. Они разбиты на CO2 и вода внутриклеточно митохондрии, высвобождая большое количество энергии, захваченной в виде АТФ через бета-окисление и цикл лимонной кислоты.
Незаменимые жирные кислоты
Жирные кислоты, которые необходимы для хорошего здоровья, но не могут быть получены в достаточном количестве из других субстратов и, следовательно, должны быть получены из пищи, называются незаменимыми жирными кислотами. Есть две серии незаменимых жирных кислот: одна имеет двойную связь. три атома углерода от метильного конца; другой имеет двойную связь шесть атомов углерода от метильного конца. У людей отсутствует способность вводить двойные связи в жирных кислотах, кроме атомов углерода 9 и 10, если считать со стороны карбоновых кислот.[39] Две незаменимые жирные кислоты: линолевая кислота (Лос-Анджелес) и альфа-линоленовая кислота (ALA). Эти жирные кислоты широко распространены в растительных маслах. Человеческое тело имеет ограниченную способность преобразовывать ALA в более длинную цепь. омега-3 жирные кислоты — эйкозапентаеновая кислота (EPA) и докозагексаеновая кислота (DHA), который также можно получить из рыбы. Омега-3 и омега-6 жирные кислоты биосинтетический предшественники эндоканнабиноиды с антиноцицептивный, анксиолитик, и нейрогенный характеристики.[40]
Распределение
Жирные кислоты крови принимают различные формы на разных этапах кровообращения. Через кишечник они попадают в хиломикроны, но также существуют в липопротеины очень низкой плотности (ЛПОНП) и липопротеины низкой плотности (ЛПНП) после обработки в печени. Кроме того, при выходе из адипоциты, жирные кислоты существуют в крови в виде свободные жирные кислоты.
Предполагается, что смесь жирных кислот, выделяемых кожей млекопитающих, вместе с молочная кислота и пировиноградная кислота, отличается и позволяет животным с острым обонянием различать особей.[41]
Анализ
Химический анализ жирных кислот в липидах обычно начинается с переэтерификация шаг, который расщепляет их исходные эфиры (триглицериды, воски, фосфолипиды и т. д.) и превращает их в метил сложные эфиры, которые затем разделяют с помощью газовой хроматографии.[42] или проанализированы газовая хроматография и в серединеИК-спектроскопия.
Разделение непредельных изомеров возможно ион серебра (Аргентация) тонкослойная хроматография.[43][44] Другие методы разделения включают высокоэффективная жидкостная хроматография (с короткими колонками, заполненными силикагель со связанными группами фенилсульфоновой кислоты, атомы водорода которых заменены на ионы серебра). Роль серебра заключается в его способности образовывать комплексы с ненасыщенными соединениями.
Промышленное использование
Жирные кислоты в основном используются в производстве мыло, как в косметических целях, так и в случае металлическое мыло, как смазочные материалы. Жирные кислоты также превращаются через их метиловые эфиры в жирные спирты и жирные амины, которые являются предшественниками поверхностно-активных веществ, детергентов и смазок.[38] Другие приложения включают их использование в качестве эмульгаторы, текстурирующие агенты, смачивающие агенты, пеногасители, или стабилизирующие агенты.[45]
Сложные эфиры жирных кислот с более простыми спиртами (например, метил-, этил-, н-пропил-, изопропил- и бутиловые эфиры) используются в качестве смягчающих веществ в косметике и других продуктах личной гигиены, а также в качестве синтетических смазок. Сложные эфиры жирных кислот с более сложными спиртами, такими как сорбитол, этиленгликоль, диэтиленгликоль гликоль, и полиэтиленгликоль употребляются в пищу или используются для личной гигиены и очистки воды, или используются в качестве синтетических смазочных материалов или жидкостей для обработки металлов.
Смотрите также
Рекомендации
- ^ Moss, G.P .; Смит, П. А. С .; Тавернье, Д. (1997). Сборник химической терминологии ИЮПАК. Чистая и прикладная химия. 67 (2-е изд.). Международный союз теоретической и прикладной химии. С. 1307–1375. Дои:10.1351 / pac199567081307. ISBN 978-0-521-51150-6. S2CID 95004254. Получено 2007-10-31.
- ^ Шеврёль, М. Э. (1813). Sur plusieurs corps gras, et specific sur leurs combinaisons avec les alcalis. Annales de Chimie, т. 88, стр. 225-261. ссылка (Галлика), ссылка (Google).
- ^ Шеврёль, М.Э. Recherches sur les corps gras d'origine animale. Левро, Париж, 1823 г. связь.
- ^ Лерэ, С. Хронологическая история липидного центра. Киберлипид Центр. Последнее обновление 11 ноября 2017 г. связь В архиве 2017-10-13 на Wayback Machine.
- ^ Ментен, П. Dictionnaire de chimie: Une Approche étymologique et Historique. Де Бёк, Брюссель. связь.
- ^ Сифуэнтес, Алехандро, изд. (2013-03-18). «Микробные метаболиты в кишечнике человека». Foodomics: расширенная масс-спектрометрия в современной науке о продуктах питания и питании. Джон Уайли и сыновья, 2013. ISBN 9781118169452.
- ^ Рот, Карл С. (19 декабря 2013 г.). «Дефицит ацил-КоА-дегидрогеназы со средней длиной цепи». Medscape.
- ^ Beermann, C .; Jelinek, J .; Reinecker, T .; Hauenschild, A .; Boehm, G .; Klör, H.-U. (2003). "Краткосрочные эффекты пищевых жирных кислот со средней длиной цепи и п-3 длинноцепочечные полиненасыщенные жирные кислоты на жировой обмен у здоровых добровольцев ». Липиды в здоровье и болезнях. 2: 10. Дои:10.1186 / 1476-511X-2-10. ЧВК 317357. PMID 14622442.
- ^ а б c «C: D» - это цифровой символ: общее количество (C) атомов углерода жирной кислоты и количество (D) двойных (ненасыщенный) облигации в нем; если D> 1, предполагается, что двойные связи разделены одним или несколькими метиленовый мостик (s).
- ^ Каждая двойная связь в жирной кислоте обозначена Δx, где двойная связь расположена на x-й углерод-углеродной связи, считая от конца карбоновой кислоты.
- ^ а б «Номенклатура липидов ИЮПАК: Приложение A: названия и символы высших жирных кислот». www.sbcs.qmul.ac.uk.
- ^ В п минус х (также ω-x или омега-x) номенклатура: двойная связь жирной кислоты расположена на x-й углерод-углеродной связи, считая от концевого метильного углерода (обозначенного как n или ω) по направлению к карбонильному углероду.
- ^ Пфеффер, Мария; Jaudszus, Анке (2016). «Пентадекановая и гептадекановая кислоты: многогранные жирные кислоты с нечетной цепью». Достижения в области питания: международный обзорный журнал. 7 (4): 730–734. Дои:10.3945 / an.115.011387. ЧВК 4942867. PMID 27422507.
- ^ Смит, С. (1994). «Синтаза жирных кислот животных: один ген, один полипептид, семь ферментов». Журнал FASEB. 8 (15): 1248–1259. Дои:10.1096 / fasebj.8.15.8001737. PMID 8001737. S2CID 22853095.
- ^ а б c Распространенная ошибка - говорить, что последний углерод - это «ω-1».
Другая распространенная ошибка - сказать, что позиция связи в омега-нотации - это номер углерода, ближайшего к КОНЦУ.
Для двойных связей эти две ошибки компенсируют друг друга; так что жирная кислота «ω-3» действительно имеет двойную связь между 3-м и 4-м атомами углерода с конца, считая метил как 1.
Однако для замен и других целей они этого не делают: гидроксил «при ω-3» находится на углероде 15 (четвертый с конца), а не 16. См., Например, эту статью. Дои:10.1016/0005-2760(75)90089-2
Также обратите внимание, что «-» в обозначении омега - это знак минус, а «ω − 3» в принципе следует читать «омега минус три». Однако очень часто (особенно в ненаучной литературе) пишут «ω-3» (с дефисом / тире) и читают как «омега-три». См., Например, Карен Дули (2008), Омега-3 жирные кислоты и диабет. - ^ а б c Rigaudy, J .; Клесней, С. П. (1979). Номенклатура органической химии. Пергамон. ISBN 978-0-08-022369-8. OCLC 5008199.
- ^ «Номенклатура липидов. Рекомендации, 1976». Европейский журнал биохимии. 79 (1): 11–21. 1977. Дои:10.1111 / j.1432-1033.1977.tb11778.x.
- ^ Иллюстрированный медицинский словарь Дорланда. Эльзевир.
- ^ Аннекен, Дэвид Дж .; Оба, Сабина; Кристоф, Ральф; Фиг, Георг; Штейнбернер, Удо; Вестфехтель, Альфред (2006). "Жирные кислоты". Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a10_245.pub2.
- ^ Незаменимые жирные кислоты смазывают кожу и предотвращают появление пролежней (см. "Рекомендуемое чтение в конце")
- ^ Эффективность соединения гипероксигенированных жирных кислот в предотвращении пролежней
- ^ Lupiañez-Perez, I .; Уттумчандани, С.К .; Morilla-Herrera, J.C .; Martin-Santos, F.J .; Fernandez-Gallego, M.C .; Navarro-Moya, F.J .; Lupiañez-Perez, Y .; Contreras-Fernandez, E .; Моралес-Асенсио, Дж. М. (2015). «Оливковое масло для местного применения не уступает гипероксигенированным жирным препаратам для предотвращения пролежней у иммобилизованных пациентов с высоким риском при уходе на дому. Результаты многоцентрового рандомизированного тройного слепого контролируемого исследования не меньшей эффективности». PLOS ONE. 10 (4): e0122238. Bibcode:2015PLoSO..1022238L. Дои:10.1371 / journal.pone.0122238. ЧВК 4401455. PMID 25886152.
- ^ Номер клинического исследования NCT01595347 за «Эффективность крема с оливковым маслом в профилактике пролежней у иммобилизованных пациентов в первичной медицинской помощи (PrevenUP)» на ClinicalTrials.gov
- ^ а б c d е ж Страйер, Люберт (1995). «Метаболизм жирных кислот». Биохимия (4-е изд.). Нью-Йорк: В. Х. Фриман и компания. С. 603–628. ISBN 978-0-7167-2009-6.
- ^ а б Ferre, P .; Фуфель, Ф. (2007). «Фактор транскрипции SREBP-1c и липидный гомеостаз: клиническая перспектива». Гормональные исследования. 68 (2): 72–82. Дои:10.1159/000100426. PMID 17344645.
этот процесс показан графически на странице 73
- ^ Воет, Дональд; Voet, Judith G .; Пратт, Шарлотта В. (2006). Основы биохимии (2-е изд.). Джон Уайли и сыновья. стр.547, 556. ISBN 978-0-471-21495-3.
- ^ Zechner, R .; Strauss, J. G .; Haemmerle, G .; Lass, A .; Циммерманн, Р. (2005). «Липолиз: путь в стадии строительства». Curr. Мнение. Липидол. 16 (3): 333–340. Дои:10.1097 / 01.mol.0000169354.20395.1c. PMID 15891395. S2CID 35349649.
- ^ Цудзи А (2005). «Передача малых молекулярных лекарств через гематоэнцефалический барьер через транспортные системы, опосредованные переносчиками». NeuroRx. 2 (1): 54–62. Дои:10.1602 / нейрох.2.1.54. ЧВК 539320. PMID 15717057.
Поглощение вальпроевой кислоты снижалось в присутствии жирных кислот со средней длиной цепи, таких как гексаноат, октаноат и деканоат, но не пропионата или бутирата, что указывает на то, что вальпроевая кислота попадает в мозг через транспортную систему для жирных кислот со средней длиной цепи. , а не жирные кислоты с короткой цепью. ... Основываясь на этих сообщениях, считается, что вальпроевая кислота двунаправленно транспортируется между кровью и мозгом через ГЭБ посредством двух различных механизмов, чувствительных к монокарбоновым кислотам и чувствительных к среднецепочечным жирным кислотам транспортеров, для оттока и поглощения соответственно.
- ^ Виджей Н., Моррис МЭ (2014). «Роль переносчиков монокарбоксилатов в доставке лекарств в мозг». Curr. Pharm. Des. 20 (10): 1487–98. Дои:10.2174/13816128113199990462. ЧВК 4084603. PMID 23789956.
Транспортеры монокарбоксилатов (MCT), как известно, опосредуют транспорт монокарбоксилатов с короткой цепью, таких как лактат, пируват и бутират. ... MCT1 и MCT4 также связаны с транспортом короткоцепочечных жирных кислот, таких как ацетат и формиат, которые затем метаболизируются в астроцитах [78].
- ^ а б Hulbert AJ, Else PL (август 1999 г.). «Мембраны как возможные стимуляторы обмена веществ». Журнал теоретической биологии. 199 (3): 257–74. Дои:10.1006 / jtbi.1999.0955. PMID 10433891.
- ^ Халберт А.Дж., Фолкс С., Баттемер В.А., Else PL (ноябрь 2002 г.). «Ацильный состав мышечных оболочек у птиц зависит от размера тела». Журнал экспериментальной биологии. 205 (Пт 22): 3561–9. PMID 12364409.
- ^ Халберт AJ (июль 2003 г.). «Жизнь, смерть и мембранные бислои». Журнал экспериментальной биологии. 206 (Pt 14): 2303–11. Дои:10.1242 / jeb.00399. PMID 12796449.
- ^ Рейнард Р.С., Коссинс А.Р. (май 1991 г.). «Гомеовязкостная адаптация и термокомпенсация натриевого насоса эритроцитов форели». Американский журнал физиологии. 260 (5, п. 2): R916–24. Дои:10.1152 / ajpregu.1991.260.5.R916. PMID 2035703.
- ^ Макканн; Уиддоусон; Агентство пищевых стандартов (1991). "Жиры и масла". Состав продуктов. Королевское химическое общество.
- ^ Алтарь, Тед. «Больше, чем вы хотели знать о жирах / маслах». Sundance Natural Foods. Получено 2006-08-31.
- ^ а б c «Национальная база данных по питательным веществам Министерства сельского хозяйства США для стандартной справки». Министерство сельского хозяйства США. Архивировано из оригинал на 2015-03-03. Получено 2010-02-17.
- ^ Клаус Шуман, Курт Зикманн (2005). «Мыло». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a24_247. ISBN 978-3527306732.CS1 maint: использует параметр авторов (связь)
- ^ а б c Аннекен, Дэвид Дж .; и другие. "Жирные кислоты". Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH.
- ^ Bolsover, Стивен Р .; и другие. (15 февраля 2004 г.). Клеточная биология: краткий курс. Джон Вили и сыновья. стр. 42ff. ISBN 978-0-471-46159-3.
- ^ Рамсден, Кристофер Э .; Замора, Дейзи; Макрияннис, Александрос; Wood, JodiAnne T .; Манн, Дж. Дуглас; Faurot, Keturah R .; MacIntosh, Beth A .; Majchrzak-Hong, Sharon F .; Гросс, Джеклин Р. (август 2015 г.). «Вызванные диетой изменения в эндоканнабиноидах, производных от n-3 и n-6, и уменьшение головной боли и психологического стресса». Журнал боли. 16 (8): 707–716. Дои:10.1016 / j.jpain.2015.04.007. ISSN 1526-5900. ЧВК 4522350. PMID 25958314.
- ^ «Электронный нос, созданный для обнаружения паров кожи». Science Daily. 21 июля 2009 г.. Получено 2010-05-18.
- ^ Aizpurua-Olaizola O, Ormazabal M, Vallejo A, Olivares M, Navarro P, Etxebarria N, et al. (Январь 2015 г.). «Оптимизация последовательного извлечения жирных кислот и полифенолов из отходов винограда Vitis vinifera в сверхкритических жидкостях». Журнал пищевой науки. 80 (1): E101-7. Дои:10.1111/1750-3841.12715. PMID 25471637.
- ^ Брейер Б., Штульфаут Т., Фок Х.П. (июль 1987 г.). «Разделение жирных кислот или сложных метиловых эфиров, включая позиционные и геометрические изомеры, с помощью тонкослойной хроматографии с агентированием оксида алюминия». Журнал хроматографической науки. 25 (7): 302–6. Дои:10.1093 / chromsci / 25.7.302. PMID 3611285.
- ^ Breuer, B .; Stuhlfauth, T .; Фок, Х. П. (1987). «Разделение жирных кислот или метиловых эфиров, включая позиционные и геометрические изомеры, с помощью тонкослойной хроматографии с аргентацией оксида алюминия». Журнал хроматографической науки. 25 (7): 302–6. Дои:10.1093 / chromsci / 25.7.302. PMID 3611285.
- ^ «Жирные кислоты: строительные блоки для промышленности» (PDF). aciscience.org. Американский институт очистки. Получено 22 апреля 2018.
внешняя ссылка
| Scholia имеет химический класс профиль для Жирная кислота. |
