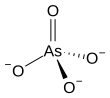
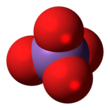
Арсенат - Arsenate
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК арсорат | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ChemSpider | |||
PubChem CID | |||
| |||
| |||
| Характеристики | |||
| AsO3− 4 | |||
| Молярная масса | 138.919 | ||
| Конъюгированная кислота | Мышьяковая кислота | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
В арсенат ион является В качествеО3−
4.An арсенат (составное) - любое сложный который содержит этот ион. Арсенаты соли или же сложные эфиры из мышьяковая кислота.Атом мышьяка в арсенате имеет валентность из 5 и также известен как пятивалентный мышьяк или же Как (V).Арсенат напоминает фосфат во многом, поскольку мышьяк и фосфор входят в одну группу (столбец) периодическая таблица. Арсенаты - умеренные окислители, с электродный потенциал из +0,56V для сокращения до арсениты.
Вхождение
Арсенаты в природе встречаются в различных минералы. Эти минералы могут содержать гидратированный или же безводный арсенаты. В отличие от фосфатов, арсенаты не теряются из минерала во время выветривание. Примеры минералов, содержащих арсенат, включают: адамит, аларсит, аннабергит, эритрит и леграндит.[1] Если для уравновешивания заряда в формуле требуются два иона арсената, это называется диарсенат например диарсенат трицинка, Zn3(AsO4)2.
Ионы
Слово арсенат происходит от мышьяковая кислота, H3AsO4. Эта умеренно сильная кислота превращается в арсенат дигидрогена (ЧАС
2AsO−
4), арсенат водорода (HAsO2−
4) и арсенат (AsO3−
4) в зависимости от pH. Количественное соотношение между этими видами определяется константами кислотной диссоциации:
- ЧАС3AsO4 + H2O ⇌ H2AsO−
4 + H3О+ (K1 = 10−2.19) - ЧАС2AsO−
4 + H2O ⇌ HAsO2−
4 + H3О+ (K2 = 10−6.94) - HAsO2−
4 + H2O ⇌ AsO3−
4 + H3О+ (K3 = 10−11.5)
Эти значения аналогичны значениям для гидрофосфатов. В водном растворе, близком к нейтральному, преобладают арсенат водорода и дигидроарсенат.
Отравление арсенатом
Арсенат может заменить неорганический фосфат в шаге гликолиз что производит 1,3-бисфосфоглицерат из глицеральдегид-3-фосфат. Это дает 1-арсено-3-фосфоглицерат вместо этого, который нестабилен и быстро гидролизуется, образуя следующий промежуточный продукт в пути, 3-фосфоглицерат. Следовательно, гликолиз идет, но АТФ молекула, которая будет образована из 1,3-бисфосфоглицерат теряется - арсенат является разобщителем гликолиза, что объясняет его токсичность.[2]
Как и другие соединения мышьяка, арсенит связывается с липоевая кислота,[3] подавление превращения пируват в ацетил-КоА, блокируя Цикл Кребса и, следовательно, приводит к дальнейшей потере АТФ.[4]
Смотрите также
- Категория: Арсенаты
Рекомендации
- ^ Mineralienatlas - Фосфат, арсенат, ванадат Mineralklasse. (на немецком)
- ^ Хьюз, Майкл Ф. (2002). «Токсичность мышьяка и возможные механизмы действия» (PDF). Письма токсикологии (133): 4.[постоянная мертвая ссылка ]
- ^ «Архивная копия». Архивировано из оригинал 20 марта 2018 г.. Получено 4 февраля 2018.CS1 maint: заархивированная копия как заголовок (связь)
- ^ Ким Геле; Селена Чоу; Уильям С. Беккет (1 октября 2009 г.), Практический пример токсичности мышьяка, Агентство по токсическим веществам и регистрации заболеваний