Карбоангидраза - Carbonic anhydrase
| Карбонатдегидратаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
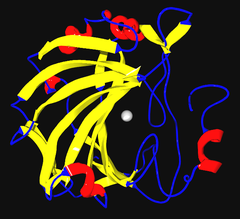 Ленточная диаграмма карбоангидразы II человека, с видимым ионом цинка в центре | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 4.2.1.1 | ||||||||
| Количество CAS | 9001-03-0 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| Карбоангидраза эукариотического типа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Carb_anhydrase | ||||||||
| Pfam | PF00194 | ||||||||
| ИнтерПро | IPR001148 | ||||||||
| PROSITE | PDOC00146 | ||||||||
| SCOP2 | 1 банка / Объем / СУПФАМ | ||||||||
| Мембранома | 333 | ||||||||
| |||||||||
В углеангидразы (или же карбонатдегидратазы) образуют семью ферменты который катализировать взаимопревращение между углекислый газ и воды и диссоциированный ионы угольная кислота (т.е. бикарбонат и ионы водорода ).[1] В активный сайт большинства углекислых ангидраз содержит цинк ион. Поэтому они классифицируются как металлоферменты. Фермент поддерживает кислотно-щелочной баланс и помогает транспортировать углекислый газ.[2]
Карбоангидраза помогает поддерживать кислотно-щелочной гомеостаз регулировать pH, и баланс жидкости. В зависимости от расположения роль фермента меняется незначительно. Например, карбоангидраза производит кислоту в слизистой оболочке желудка. В почках контроль ионов бикарбоната влияет на содержание воды в клетке. Контроль ионов бикарбоната также влияет на содержание воды в глазах. Ингибиторы карбоангидразы используются для лечения глаукомы, чрезмерного скопления воды в глазах. Блокирование этого фермента сдвигает жидкостный баланс в глазах пациента, чтобы уменьшить накопление жидкости, тем самым снимая давление.[2][3]
В Эффект Бора это способ описать сродство гемоглобина к связыванию кислорода. Эффект Бора был описан Кристианом Бором в 1904 году и относится к сдвигу кривой диссоциации кислорода, вызванному изменением концентрации диоксида углерода или изменением pH. По сути, увеличение углекислого газа приводит к снижению pH крови, что снижает связывание кислорода с гемоглобином.[4] Обратное верно, когда уменьшение концентрации углекислого газа повышает pH крови, что увеличивает скорость связывания кислорода с гемоглобином. Связать эффект Бора с карбоангидразой просто: карбоангидраза ускоряет реакцию углекислого газа, вступающего в реакцию с водой, с образованием протонов водорода и ионов бикарбоната.
Для описания равновесия в реакции карбоангидразы используется принцип Ле Шателье. Ткани более кислые, чем легкие, потому что углекислый газ вырабатывается клеточным дыханием и вступает в реакцию с водой в тканях с образованием протонов водорода. Поскольку концентрация углекислого газа выше, равновесие смещается вправо, в сторону бикарбоната. Противоположное явление наблюдается в легких, где выделяется диоксид углерода, поэтому его концентрация ниже, поэтому равновесие смещается влево в сторону диоксида углерода, чтобы попытаться повысить его концентрацию.[5]

Фон
Фермент известен как вещество, которое действует в живых организмах как катализатор, который помогает ускорить химические реакции.[6] Карбоангидраза - один из важных ферментов, который содержится в эритроцитах, слизистой оболочке желудка, клетках поджелудочной железы и даже почечных канальцах. Это очень старый фермент, который был открыт в 1932 году и разделен на три основных класса.[7] Первый класс - это альфа-карбоангидраза, обнаруженная у млекопитающих, второй класс - это бета-карбоангидраза, которая содержится в бактериях и растениях, и, наконец, третий класс - это гамма-карбоангидраза, которая содержится в метаногеновых бактериях в горячих источниках.[8] Все три класса карбоангидразы имеют один и тот же активный центр с металлическим центром Zn, однако структурно они не похожи друг на друга. Основная роль карбоангидразы у людей - катализировать превращение диоксида углерода в угольную кислоту и обратно. Однако это также может помочь с CO.2 транспорт в крови, который, в свою очередь, помогает дыханию. Он может даже участвовать в образовании соляной кислоты в желудке.[6] Следовательно, роль карбоангидразы зависит от того, где она находится в организме.
Реакция
Реакция, которая показывает катализирование карбоангидразы в наших тканях: CO2 + H2О ЧАС2CO3 ЧАС+ + HCO3−. Катализирование карбоангидразы в легких показано: H+ + HCO3− ЧАС2CO3 CO2 + H2О. Причина, по которой реакции протекают в противоположных направлениях для тканей и легких, заключается в различном уровне pH, обнаруженном в них. Без катализатора карбоангидразы реакция протекает очень медленно, однако с катализатором реакция составляет 107 раз быстрее.
Реакция, катализируемая карбоангидразой:
- HCO3− + H+ CO2 + H2О
Угольная кислота имеет pKа около 6,36 (точное значение зависит от среды), поэтому при pH 7 протонируется небольшой процент бикарбоната.
Карбоангидраза - один из самых быстрых ферментов, скорость которого обычно ограничивается распространение скорость его субстраты. Типичная каталитическая скорость различных форм этого фермента находится в пределах 104 и 106 реакции в секунду.[9]
Некаталитическая обратная реакция является относительно медленной (кинетика в 15-секундном диапазоне). Вот почему газированный напиток не дегазируется мгновенно при открытии тары; однако он быстро дегазируется во рту при контакте с карбоангидразой, содержащейся в слюне.[10]
Ангидраза определяется как фермент, который катализирует удаление молекулы воды из соединения, и поэтому именно эта «обратная» реакция дала карбоангидразу ее название, потому что она удаляет молекулу воды из угольной кислоты.
В легких карбоангидраза превращает бикарбонат в двуокись углерода, пригодную для выдоха.
Механизм
А цинк протезная группа в ферменте координируется в трех положениях гистидин боковые цепи. Четвертую координационную позицию занимают воды. Четвертый гистидин находится рядом с водным лигандом, способствуя образованию центра Zn-OH, который связывает CO2 дать бикарбонат цинка.[11] Конструкция является примером общей кислоты - общего основания катализ (см. статью "Кислотный катализ Активный центр также имеет карман, подходящий для углекислого газа, приближая его к гидроксидной группе.
Семьи

Карбоангидраза была первоначально обнаружена в эритроцитах коров.[2]
Распознаются по крайней мере пять различных семейств CA: α, β, γ, δ и ζ. Эти семьи не имеют значимых аминокислотная последовательность сходство и в большинстве случаев считается примером конвергентная эволюция. Α-КА обнаружены у людей.
α-CA
Позвоночные, водоросли и немного бактерии есть это семейство центров сертификации.
Ферменты CA, обнаруженные в млекопитающие делятся на четыре широкие подгруппы,[12] которые, в свою очередь, состоят из нескольких изоформ:
- то цитозольный CA (CA-I, CA-II, CA-III, CA-VII и CA XIII) (CA1, CA2, CA3, CA7, CA13 )
- митохондриальный CA (CA-VA и CA-VB) (CA5A, CA5B )
- секретируемые CA (CA-VI) (CA6 )
- ассоциированные с мембраной CA (CA-IV, CA-IX, CA-XII, CA-XIV и CA-XV) (CA4, CA9, CA12, CA14 )
Существуют три дополнительных «акаталитических» изоформы карбоангидразы человека (CA-VIII, CA-X, и CA-XI ) (CA8, CA10, CA11 ), функции которого остаются неясными.[13]

| Изоформа | Ген | Молекулярная масса[15] | Расположение (ячейка) | Расположение (ткань)[15] | Удельная активность ферментов человека (кроме мыши CA XV) (s−1)[16] | Чувствительность к сульфаниламиды (ацетазоламид в этой таблице) Kя (нМ)[16] |
|---|---|---|---|---|---|---|
| CA-I | CA1 | 29 кДа | цитозоль | эритроцит и Желудочно-кишечный тракт | 2.0 × 105 | 250 |
| CA-II | CA2 | 29 кДа | цитозоль | почти повсеместно | 1.4 × 106 | 12 |
| CA-III | CA3 | 29 кДа | цитозоль | 8% растворимого белка типа I мышца | 1.3 × 104 | 240000 |
| CA-IV | CA4 | 35 кДа | внеклеточный GPI -связанный | Желудочно-кишечный тракт, почка, эндотелий | 1.1 × 106 | 74 |
| CA-VA | CA5A | 34,7 кДа (прогноз) | митохондрии | печень | 2.9 × 105 | 63 |
| CA-VB | CA5B | 36,4 кДа (прогноз) | митохондрии | широко распространенный | 9.5 × 105 | 54 |
| CA-VI | CA6 | 39–42 кДа | секреторный | слюна и молоко | 3.4 × 105 | 11 |
| CA-VII | CA7 | 29 кДа | цитозоль | широко распространенный | 9.5 × 105 | 2.5 |
| CA-IX | CA9 | 54, 58 кДа | клеточная мембрана -ассоциированный | нормальный Желудочно-кишечный тракт, несколько видов рака | 1.1 × 106 | 16 |
| CA-XII | CA12 | 44 кДа | внеклеточно расположенный активный сайт | почка, определенный раки | 4.2 × 105 | 5.7 |
| CA-XIII[17] | CA13 | 29 кДа | цитозоль | широко распространенный | 1.5 × 105 | 16 |
| CA-XIV | CA14 | 54 кДа | внеклеточно расположенный активный сайт | почка, сердце, скелетные мышцы, мозг | 3.1 × 105 | 41 |
| CA-XV[18] | CA15 | 34–36 кДа | внеклеточный GPI -связанный | почка, не экспрессируется в тканях человека | 4.7 × 105 | 72 |
β-CA
Наиболее прокариотический и посадить хлоропласт Центры сертификации относятся к семейству бета-версий. образцы подписи для этого семейства были определены:
- C- [SA] -D-S-R- [LIVM] -x- [AP]
- [EQ] - [YF] -A- [LIVM] -x (2) - [LIVM] -x (4) - [LIVMF] (3) -x-G-H-x (2) -C-G
γ-CA
Гамма-класс СА происходят от метаногены, метан-продуцирующие бактерии которые растут в горячих источниках.
δ-CA
Дельта-класс центров сертификации был описан в диатомеи. Отличие этого класса КА в последнее время[19] под вопросом, однако.
ζ-CA
Дзета-класс КА встречается исключительно в бактерии в несколько хемолитотрофы и морской цианобактерии которые содержат cso-карбоксисомы.[20] Недавний трехмерный анализ[19] предполагают, что ζ-CA имеет некоторое структурное сходство с β-CA, особенно вблизи участка иона металла. Таким образом, две формы могут быть отдаленно связаны, даже если лежащие в основе аминокислотная последовательность с тех пор значительно разошелся.
η-CA
Семейство ЭТА КА было недавно обнаружено у организмов рода Плазмодий. Это группа ферментов, ранее считавшихся принадлежащими к альфа-семейству КА, однако было продемонстрировано, что η-КА обладают уникальными особенностями, такими как характер координации их ионов металлов.[21]
ι-CA
Класс iota - это самый последний описанный класс CA. Он был обнаружен в морской диатоме Thalassiosira pseudonana, и широко распространен среди морского фитопланктона.[22] У диатомовых водорослей ι-CA необходим для CO.2-концентрирующие механизмы и - в отличие от других классов CA - может использовать марганец вместо цинка в качестве металлического кофактора.[22] Гомологи ι-CA были также подтверждены у грамотрицательных бактерий, которые могут присутствовать в виде гомодимера белка.[23]
Структура и функции
В природе встречается несколько форм карбоангидразы. В наиболее изученных α-карбоангидраза формы, присутствующей у животных, ион цинка координируется имидазол кольца из 3 гистидин остатки His94, His96 и His119.[нужна цитата ]
Основная функция фермента у животных - взаимное преобразование диоксида углерода и бикарбоната для поддержания кислотно-щелочной баланс в крови и других тканях и помогает транспортировать углекислый газ из тканей.
У млекопитающих существует не менее 14 различных изоформ. Растения содержат другую форму, называемую β-карбоангидраза, который с эволюционной точки зрения является отдельным ферментом, но участвует в той же реакции, а также использует ион цинка в своем активном центре. В растениях карбоангидраза помогает повысить концентрацию CO.2 в пределах хлоропласт для увеличения скорости карбоксилирования фермента RuBisCO. Это реакция, при которой CO2 в органический углерод сахара во время фотосинтез, и может использовать только CO2 форма углерода, а не угольная кислота или бикарбонат.[нужна цитата ]
Кадмий-содержащая карбоангидраза
морской диатомеи было обнаружено, что они экспрессируют новую форму ζ карбоангидразы. Т. weissflogii, разновидность фитопланктон общий для многих морских экосистем, было обнаружено, что он содержит карбоангидразу с кадмий ион вместо цинка.[24] Раньше считалось, что кадмий - токсичный металл, не имеющий никакой биологической функции. Однако этот вид фитопланктона, похоже, адаптировался к низким уровням цинка в океане за счет использования кадмия, когда цинка недостаточно.[25] Хотя концентрация кадмия в морской воде тоже невысока (около 1х10−16 коренной зуб ), есть экологические преимущества в возможности использовать любой металл в зависимости от того, какой из них более доступен в данный момент. Таким образом, этот тип карбоангидразы является камбиалистическим, что означает, что он может заменять металл в своем активном центре на другие металлы (а именно, цинк и кадмий).[26]
Сходства с другими углекислыми ангидразами
Механизм карбоангидразы кадмия (CDCA) по существу такой же, как и у других карбоангидраз, в превращении диоксида углерода и воды в бикарбонат и протон.[27] Кроме того, как и другие угольные ангидразы, CDCA заставляет реакцию идти почти так же быстро, как скорость диффузии ее субстратов, и она может быть ингибирована сульфонамид и сульфамат производные.[27]
Отличия от других углекислых ангидраз
В отличие от большинства других угольных ангидраз, ион металла активного центра не связан тремя остатками гистидина и ионом гидроксида. Вместо этого он связан двумя цистеин остатки, один остаток гистидина и ион гидроксида, что характерно для β-CA.[27][28] В связи с тем, что кадмий является мягкая кислота, он будет более тесно связан мягкая база лиганды.[26] В сера атомы на остатках цистеина являются мягкими основаниями, таким образом связывая кадмий более прочно, чем азот на остатках гистидина. CDCA также имеет трехмерную складчатую структуру, которая не похожа на любую другую карбоангидразу, и ее аминокислотная последовательность не похожа на другие карбоангидразы.[27] Это мономер с тремя доменами, каждый из которых идентичен по аминокислотной последовательности и каждый содержит активный сайт с ионом металла.[28]
Еще одно ключевое различие между CDCA и другими углеангидразами заключается в том, что CDCA имеет механизм замены своего иона кадмия на ион цинка в случае, если цинк становится более доступным для фитопланктона, чем кадмий. Активный сайт CDCA по существу «закрыт» цепочкой из девяти аминокислоты с глицин остатки в положениях 1 и 9. Обычно этот вентиль остается закрытым, и ион кадмия задерживается внутри. Однако из-за гибкости и положения остатков глицина этот вентиль можно открыть для удаления иона кадмия. Затем на его место можно поместить ион цинка, и ворота за ним закроются.[27] Как пограничная кислота, цинк не будет связываться с лигандами цистеина так же прочно, как кадмий, но фермент по-прежнему будет активен и достаточно эффективен. Металл в активном центре может переключаться между цинком и кадмием в зависимости от того, какой из них более распространен в данный момент. Способность CDCA использовать кадмий или цинк, вероятно, дает Т. weissflogii преимущество выживания.[25]
Транспорт кадмия
Кадмий по-прежнему считается смертельным для фитопланктона в больших количествах. Исследования показали, что Т. weissflogii имеет начальную токсическую реакцию на кадмий при воздействии на него. Токсичность металла снижается за счет транскрипции и перевода фитохелатин, которые являются белками, которые могут связывать и транспортировать кадмий. После связывания фитохелатином кадмий больше не токсичен и может безопасно транспортироваться к ферменту CDCA.[24] Также было показано, что поглощение кадмия через фитохелатин приводит к значительному увеличению экспрессии CDCA.[24]
CDCA-подобные белки
Другой фитопланктон из других источников воды был протестирован на наличие CDCA. Было обнаружено, что многие из них содержат белки, гомологичные CDCA, обнаруженным в Т. weissflogii.[24] Сюда входят виды из Грейт-Бэй, Нью-Джерси а также в Тихий океан недалеко от экватор. У всех протестированных видов CDCA-подобные белки показали высокий уровень экспрессии даже при высоких концентрациях цинка и в отсутствие кадмия.[24] Сходство между этими белками и CDCA, экспрессируемым Т. weissflogii варьировались, но всегда были похожи как минимум на 67%.[24]
Улавливание и связывание углерода
Карбоангидраза в принципе может оказаться полезной для улавливание углерода. Некоторые углекислые ангидразы могут выдерживать температуры до 107 ° C и экстремальную щелочность (pH> 10).[29] Пилотный запуск с более стабильным СА на потоке дымовых газов, который состоял из 12–13% мольного состава CO₂, имел степень улавливания 63,6% за 60-часовой период без заметного влияния на производительность ферментов. CA был помещен в раствор N-метилдиэтаноламина (MDEA), где он служил для увеличения разницы концентраций (движущей силы) CO.2 между дымовым потоком электростанции и жидкой фазой в контакторе жидкость-газ.[29]
Смотрите также
Рекомендации
- ^ Барсук М.Р., Прайс Г.Д. (1994). «Роль карбоангидразы в фотосинтезе». Анну. Rev. Plant Physiol. Завод Мол. Биол. 45: 369–392. Дои:10.1146 / annurev.pp.45.060194.002101.
- ^ а б c «PDB101: молекула месяца: карбоангидраза». RCSB: PDB-101. Получено 3 декабря 2018.
- ^ Supuran CT (27 мая 2004 г.). Карбоангидразы: каталитические и ингибирующие механизмы, распределение и физиологическая роль. Тейлор и Фрэнсис. Дои:10.1201/9780203475300-5 (неактивно 11 ноября 2020 г.). ISBN 9780203475300.CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- ^ «Эффект Бора». www.pathwaymedicine.org. Получено 23 ноября 2019.
- ^ «Принцип Ле Шателье». www.chemguide.co.uk. Получено 23 ноября 2019.
- ^ а б "Британский словарь".
- ^ Марен Т.Х. (октябрь 1967 г.). «Карбоангидраза: химия, физиология и ингибирование». Физиологические обзоры. 47 (4): 595–781. Дои:10.1152 / Physrev.1967.47.4.595. PMID 4964060. S2CID 19954840.
- ^ Биологическая неорганическая химия. Структура и реакционная способность. pp. раздел IX.1.3.1. п. 180.
- ^ Линдског С (1997). «Строение и механизм карбоангидразы». Фармакология и терапия. 74 (1): 1–20. Дои:10.1016 / S0163-7258 (96) 00198-2. PMID 9336012.
- ^ Тэтчер Б.Дж., Доэрти А.Е., Орвиски Э., Мартин Б.М., Хенкин Р.И. (сентябрь 1998 г.). «Густин из околоушной слюны человека - карбоангидраза VI». Сообщения о биохимических и биофизических исследованиях. 250 (3): 635–41. Дои:10.1006 / bbrc.1998.9356. PMID 9784398.
- ^ Паркин Г. (февраль 2004 г.). «Синтетические аналоги, имеющие отношение к структуре и функциям ферментов цинка». Химические обзоры. 104 (2): 699–767. Дои:10.1021 / cr0206263. PMID 14871139. S2CID 9857226.
- ^ Бретон С (июль 2001 г.). «Клеточная физиология углеангидраз». JOP. 2 (4 Дополнение): 159–64. PMID 11875253.
- ^ Лавджой Д.А., Хьюетт-Эммет Д., Портер Калифорния, Сепои Д., Шеффилд А., Вейл В.В., Ташиан Р.Э. (декабрь 1998 г.). «Эволюционно консервативный,« акаталитический »белок XI, родственный карбоангидразе, содержит мотив последовательности, присутствующий в нейропептиде саувагине: ген CA-RP XI человека (CA11) встроен между кластером секреторного гена и геном DBP по адресу 19q13.3». Геномика. 54 (3): 484–93. Дои:10.1006 / geno.1998.5585. PMID 9878252.
- ^ Boriack-Sjodin PA, Zeitlin S, Chen HH, Crenshaw L, Gross S, Dantanarayana A, et al. (Декабрь 1998 г.). «Структурный анализ связывания ингибитора карбоангидразы II человека». Белковая наука. 7 (12): 2483–9. Дои:10.1002 / pro.5560071201. ЧВК 2143894. PMID 9865942.
- ^ а б Если не указано иное: Бор WF (2005). Медицинская физиология: клеточный и молекулярный подход. Elsevier / Saunders. ISBN 978-1-4160-2328-9. Стр. Решебника 638
- ^ а б Хилво М., Баранаускене Л., Сальцано А.М., Скалони А., Матулис Д., Инноченти А. и др. (Октябрь 2008 г.). «Биохимическая характеристика CA IX, одного из наиболее активных изоферментов карбоангидразы». Журнал биологической химии. 283 (41): 27799–809. Дои:10.1074 / jbc.M800938200. PMID 18703501.
- ^ Лехтонен Дж., Шен Б., Вихинен М., Казини А., Скоццафава А., Супуран К. Т. и др. (Январь 2004 г.). «Характеристика CA XIII, нового члена семейства изоферментов карбоангидразы». Журнал биологической химии. 279 (4): 2719–27. Дои:10.1074 / jbc.M308984200. PMID 14600151.
- ^ Хилво М., Толванен М., Кларк А., Шен Б., Шах Г. Н., Вахид А. и др. (Ноябрь 2005 г.). «Характеристика CA XV, новой формы карбоангидразы, заякоренной в GPI». Биохимический журнал. 392 (Pt 1): 83–92. Дои:10.1042 / BJ20051102. ЧВК 1317667. PMID 16083424.
- ^ а б Sawaya MR, Cannon GC, Heinhorst S, Tanaka S, Williams EB, Yeates TO, Kerfeld CA (март 2006 г.). «Структура бета-карбоангидразы карбоксисомной оболочки выявляет отдельный подкласс с одним активным центром по цене двух». Журнал биологической химии. 281 (11): 7546–55. Дои:10.1074 / jbc.M510464200. PMID 16407248.
- ^ Итак, AK, Espie GS, Williams EB, Shively JM, Heinhorst S, Cannon GC (февраль 2004 г.). «Новая эволюционная линия карбоангидразы (класс эпсилон) является компонентом карбоксисомной оболочки». Журнал бактериологии. 186 (3): 623–30. Дои:10.1128 / JB.186.3.623-630.2004. ЧВК 321498. PMID 14729686.
- ^ Дель Прете С., Вулло Д., Фишер Г.М., Эндрюс К.Т., Поулсен С.А., Капассо С., Супуран С.Т. (сентябрь 2014 г.). «Открытие нового семейства углекислых ангидраз у возбудителя малярии Plasmodium falciparum - η-углекислых ангидраз». Письма по биоорганической и медицинской химии. 24 (18): 4389–4396. Дои:10.1016 / j.bmcl.2014.08.015. HDL:10072/63103. PMID 25168745.
- ^ а б Дженсен Э.Л., Клемент Р., Коста А., Маберли СК, Гонтеро Б. (август 2019 г.). «Новый широко распространенный подкласс карбоангидразы в морском фитопланктоне». Журнал ISME. 13 (8): 2094–2106. Дои:10.1038 / с41396-019-0426-8. ЧВК 6776030. PMID 31024153.
- ^ Del Prete S, Nocentini A, Supuran CT, Capasso C (декабрь 2020 г.). "Буркхолдерия территории". Журнал ингибирования ферментов и медицинской химии. 35 (1): 1060–1068. Дои:10.1080/14756366.2020.1755852. ЧВК 7191908. PMID 32314608.
- ^ а б c d е ж Пак Х., Макгинн П.Дж., More FM (19 мая 2008 г.). «Экспрессия карбоангидразы кадмия диатомовых водорослей в морской воде». Экология водных микробов. 51: 183–193. Дои:10.3354 / ame01192.
- ^ а б Лейн Т.В., Сайто Массачусетс, Джордж Г.Н., Пикеринг И.Дж., Принц Р.К., Морел FM (май 2005 г.). «Биохимия: фермент кадмий из морских диатомовых водорослей». Природа. 435 (7038): 42. Bibcode:2005Натура 435 ... 42л. Дои:10.1038 / 435042a. PMID 15875011. S2CID 52819760.
- ^ а б Бертини I, Грей Х, Штифель Э, Валентайн Дж (2007). Биологическая неорганическая химия: структура и реакционная способность (Первое изд.). Саусалито, Калифорния: Научные книги университета. ISBN 978-1-891389-43-6.
- ^ а б c d е Сигель А, Сигель Х, Сигель РК (2013). Кадмий от токсичности к эссенциальности. Дордрехт: Спрингер. ISBN 978-94-007-5179-8.
- ^ а б Сюй И, Фэн Л., Джеффри П.Д., Ши И, Морел Ф.М. (март 2008 г.). «Структура и металлообмен в карбоангидразе кадмия морских диатомовых водорослей». Природа. 452 (7183): 56–61. Bibcode:2008Натура 452 ... 56X. Дои:10.1038 / природа06636. PMID 18322527. S2CID 4420280.
- ^ а б Альвизо О., Нгуен Л.Дж., Савил К.К., Брессон Дж. А., Лакхапатри С.Л., Солис Е.О. и др. (Ноябрь 2014 г.). «Направленная эволюция сверхстабильной карбоангидразы для высокоэффективного улавливания углерода из дымовых газов». Труды Национальной академии наук Соединенных Штатов Америки. 111 (46): 16436–41. Bibcode:2014ПНАС..11116436А. Дои:10.1073 / pnas.1411461111. ЧВК 4246266. PMID 25368146.
дальнейшее чтение
- Lyall V, Alam RI, Phan DQ, Ereso GL, Phan TH, Malik SA и др. (Сентябрь 2001 г.). «Снижение внутриклеточного pH вкусовых рецепторов крыс является ближайшим стимулом для преобразования кислого вкуса». Американский журнал физиологии. Клеточная физиология. 281 (3): C1005-13. Дои:10.1152 / ajpcell.2001.281.3.C1005. PMID 11502578.



