F-соотношение - F-ratio

В океанический биогеохимия, то f-соотношение это доля от общего основное производство подпитывается нитрат (в отличие от подпитываемых другими азот соединения Такие как аммоний ). Соотношение было первоначально определено Ричардом Эппли и Брюсом Петерсоном в одном из первых документы оценка мирового производства в океане.[1] Первоначально эта доля считалась значительной, потому что она имела прямое отношение к тонущий (экспортный) флюс из органический морской снег от поверхность океана посредством биологический насос. Однако эта интерпретация основывалась на предположении о сильном разбиении параллельного процесса по глубине, нитрификация, что поставили под сомнение более поздние измерения.[2]
Обзор
Гравитационный опускание организмы (или останки организмов) переносит углерод от поверхностных вод океана до его глубокий интерьер. Этот процесс известен как биологический насос, и его количественная оценка представляет интерес для ученых, потому что это важный аспект земной шар с цикл углерода. По сути, это связано с тем, что углерод, переносимый в глубокие глубины океана, изолирован от атмосферы, что позволяет океану действовать как резервуар углерода. Этот биологический механизм сопровождается физико-химическим механизмом, известным как насос растворимости который также переносит углерод в глубину океана.
Измерение потока тонущего материала (так называемого морского снега) обычно выполняется путем развертывания отстойники которые перехватывают и хранят материал по мере его опускания столб воды. Однако это относительно сложный процесс, поскольку ловушки могут быть неудобными для развертывания или восстановления, и их необходимо оставлять. на месте в течение длительного периода для интеграции падающего потока. Кроме того, известно, что они подвержены смещению и объединяют как горизонтальные, так и вертикальные потоки из-за водных течений.[3][4] По этой причине ученых интересуют свойства океана, которые легче измерить, и которые действуют как доверенное лицо для тонущего флюса. Коэффициент f - один из таких прокси.
«Новая» и «регенерированная» продукция
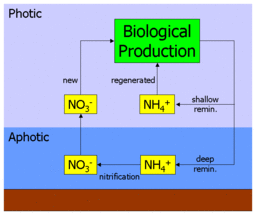
Биодоступный азот встречается в океане в нескольких формах, включая простые ионные формы, такие как нитрат (NO3−), нитрит (НЕТ2−) и аммония (NH4+) и более сложные органические формы, такие как мочевина ((NH2)2CO). Эти формы используются автотрофный фитопланктон для синтеза органических молекул, таких как аминокислоты (строительные блоки белки ). Выпас фитопланктона зоопланктон и более крупные организмы переносят этот органический азот вверх пищевая цепочка и по всему морскому пищевой сети.
Когда азотистые органические молекулы в конечном итоге метаболизированный организмом они возвращаются в толщу воды в виде аммония (или более сложных молекул, которые затем метаболизируются до аммония). Это известно как регенерация, поскольку аммоний может использоваться фитопланктоном и снова попадать в пищевую сеть. Таким образом, первичное производство, получаемое на основе аммония, называется регенерированная продукция.[5]
Однако аммоний также может быть окисленный в нитраты (через нитрит) в процессе нитрификации. Это выполняется разными бактерии в два этапа:
- NH3 + O2 → НЕТ2− + 3H+ + 2e−
- НЕТ2− + H2O → НЕТ3− + 2H+ + 2e−
Важно отметить, что этот процесс, как полагают, происходит только в отсутствие свет (или как некоторые другие функция глубины). В океане это приводит к вертикальному отделению нитрификации от основное производство, и ограничивает его афотическая зона. Это приводит к ситуации, когда любой нитрат в толще воды должен происходить из афотической зоны и должен происходить из органического материала, перенесенного туда при опускании. Таким образом, при первичном производстве за счет нитратов используется «свежий» источник питательных веществ, а не регенерированный. Производство нитратов, таким образом, называется новое производство.[5]
Рисунок в начале этого раздела иллюстрирует это. Нитраты и аммоний потребляются первичными производителями, обрабатываются через пищевую сеть, а затем регенерируются в аммоний. Часть этого возвратного потока выбрасывается на поверхность океана (где он снова становится доступным для поглощения), а часть возвращается на глубину. Аммоний, возвращаемый на глубину, нитрифицируется до нитрата и, в конечном итоге, смешанный или же поднялся в поверхность океана, чтобы повторить цикл.
Следовательно, значение нового производства заключается в его связи с проходящим материалом. В равновесие, экспортный поток органического материала, попадающего в афотическую зону, уравновешивается восходящим потоком нитрата. Измеряя, сколько нитратов потребляется при первичном производстве по сравнению с регенерированным аммонием, можно косвенно оценить экспортный поток.
Кроме того, коэффициент f может также выявить важные аспекты функции местной экосистемы.[6] Высокие значения f-ratio обычно связаны с продуктивными экосистемами, в которых преобладают крупные, эукариотический фитопланктон (например, диатомеи ), на которых пасется крупный зоопланктон (и, в свою очередь, более крупные организмы, такие как рыбы). Напротив, низкие значения f-отношения обычно связаны с низкой биомассой, олиготрофный пищевые сети, состоящие из мелких, прокариотический фитопланктон (например, Прохлорококк ), которые контролируются микрозоопланктоном.[7][8]
Предположения
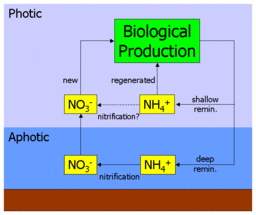
Фундаментальным предположением в этой интерпретации f-отношения является пространственное разделение первичного производства и нитрификации. Действительно, в своей оригинальной статье Eppley & Peterson отметили, что: «Чтобы связать новое производство с экспортом, необходимо, чтобы нитрификация в эвфотической зоне была незначительной».[1] Однако последующие исследования распределения нитрификации показали, что нитрификация может происходить на меньших глубинах и даже в фотической зоне.[2][9][10]
Как показано на диаграмме рядом, если аммоний действительно нитрифицирован до нитрата в поверхностных водах океана, это, по сути, "короткие замыкания «глубокий путь нитратов. На практике это привело бы к переоценке нового производства и более высокому коэффициенту f, поскольку некоторые из якобы новых производств фактически будут подпитываться недавно нитрифицированными нитратами, которые никогда не покидали поверхность океана. После включая измерения нитрификации в его параметризацию, модель экосистемы из олиготрофный субтропический круговорот регион (в частности Летучие мыши site) обнаружил, что ежегодно около 40% поверхностных нитратов недавно подвергалось нитрификации (летом повышается почти до 90%).[11] Дальнейшее исследование, объединяющее географически разнообразные измерения нитрификации, обнаружило высокую изменчивость, но не взаимосвязано с глубиной, и применило это в модели глобального масштаба для оценки того, что до половины поверхностных нитратов поступает в результате поверхностной нитрификации, а не апвеллинга.[12]
Хотя измерения скорости нитрификации все еще относительно редки, они все же предполагают, что коэффициент f не является таким прямым показателем для биологического насоса, как когда-то считалось. По этой причине некоторые исследователи предложили различать коэффициент f и отношение экспорта твердых частиц к первичному производству, которое они называют pe-ratio.[8] Хотя количественно и отличается от f-соотношения, ре-отношение демонстрирует аналогичное качественное изменение между режимами высокой продуктивности / высокой биомассы / высокого экспорта и режимов низкой продуктивности / низкой биомассы / низкого экспорта.
Кроме того, существует еще один процесс, который потенциально усложняет использование коэффициента f для оценки «новой» и «восстановленной» добычи: диссимиляционное восстановление нитрата до аммония (DNRA). В средах с низким содержанием кислорода, таких как зоны минимума кислорода и донные отложения, хемоорганогетеротрофный микробы используют нитраты как акцептор электронов за дыхание,[13] восстанавливая его до нитрита, затем до аммония. Поскольку, как и нитрификация, DNRA изменяет баланс в доступности нитрата и аммония, он может внести неточность в рассчитанный коэффициент f. Однако, поскольку возникновение DNRA ограничено анаэробными ситуациями,[14] его значение менее распространено, чем нитрификация, хотя оно может происходить вместе с первичными производителями.[15][16]
Смотрите также
- Биологический насос - Биологически обусловленное связывание углерода из атмосферы во внутренние части океана и на морское дно.
- Нитрификация - биологическое окисление аммиака или аммония до нитрита с последующим окислением нитрита до нитрата
- Основное производство - синтез органических соединений из углекислого газа биологическими организмами
Рекомендации
- ^ а б Eppley, R.W .; Петерсон, Б.Дж. (1979). «Поток твердых частиц органического вещества и новые планктонные образования в глубинах океана». Природа. 282 (5740): 677–680. Bibcode:1979Натура.282..677E. Дои:10.1038 / 282677a0.
- ^ а б Dore, J.E .; Карл, Д. (1996). «Нитрификация в эвфотической зоне как источник нитритов, нитратов и закиси азота на станции ALOHA». Лимнол. Oceanogr. 41 (8): 1619–1628. Bibcode:1996LimOc..41.1619D. Дои:10.4319 / lo.1996.41.8.1619. JSTOR 00243590.
- ^ Thomas, S .; Ридд, П.В. (2004). «Обзор методов измерения кратковременного накопления наносов». Морская геология. 207 (1–4): 95–114. Bibcode:2004MGeol.207 ... 95T. Дои:10.1016 / j.margeo.2004.03.011.
- ^ Бюсселер, К.; и другие. (2007). «Оценка использования осадочных ловушек для оценки потоков частиц в верхних слоях океана» (PDF). J. Mar. Res. 65 (3): 345–416. Дои:10.1357/002224007781567621. HDL:1912/1803. ISSN 0022-2402.
- ^ а б Dugdale, R.C .; Геринг, Дж. Дж. (1967). «Поглощение новых и регенерированных форм азота в первичной продуктивности» (PDF). Лимнол. Oceanogr. 12 (2): 196–206. Bibcode:1967LimOc..12..196D. Дои:10.4319 / lo.1967.12.2.0196. Архивировано из оригинал (PDF) на 2011-07-20.
- ^ Allen, A.E .; Howard-Jones, M.H .; Бут, M.G .; Frischer, M.E .; Verity, P.G .; Bronk, D.A .; Сандерсон, М. (2002). «Важность гетеротрофной бактериальной ассимиляции аммония и нитратов в Баренцевом море летом». Журнал морских систем. 38 (1–2): 93–108. Bibcode:2002JMS .... 38 ... 93A. Дои:10.1016 / s0924-7963 (02) 00171-9.
- ^ Laws, E.A .; Фальковски, П.Г .; Smith, W.O .; Ducklow, H .; Маккарти, Дж. Дж. (2000). «Влияние температуры на экспортную продукцию в открытом океане». Глобальные биогеохимические циклы. 14 (4): 1231–1246. Bibcode:2000GBioC..14.1231L. Дои:10.1029 / 1999GB001229.
- ^ а б Dunne, J.P .; Armstrong, R.A .; Gnanadesikan, A .; Сармьенто, J.L. (2005). «Эмпирические и механистические модели для коэффициента экспорта частиц». Глобальные биогеохимические циклы. 19 (4): GB4026. Bibcode:2005GBioC..19.4026D. Дои:10.1029 / 2004GB002390.
- ^ Raimbault, P .; Slawyk, G .; Boudjellal, B .; Коатаноан, С .; Conan, P .; Косте, В .; Garcia, N .; Moutin, T .; Пуджо-Пай, М. (1999). «Поглощение и экспорт углерода и азота в экваториальной части Тихого океана на 150 ° з. Д.: Свидетельство эффективного регенерированного производственного цикла». J. Geophys. Res. 104 (C2): 3341–3356. Bibcode:1999JGR ... 104.3341R. Дои:10.1029 / 1998JC900004.
- ^ Diaz, F .; Раймбо, П. (2000). «Регенерация азота и высвобождение растворенного органического азота весной в северо-западной прибрежной зоне Средиземного моря (Лионский залив): последствия для оценки нового производства». Mar. Ecol. Прог. Сер. 197: 51–65. Bibcode:2000MEPS..197 ... 51D. Дои:10.3354 / meps197051.
- ^ Martin, A.P .; Пондавен, П. (2006). «Новое первичное производство и нитрификация в западной субтропической части Северной Атлантики: модельное исследование». Глобальные биогеохимические циклы. 20 (4): н / д. Bibcode:2006GBioC..20.4014M. Дои:10.1029 / 2005GB002608.
- ^ Yool, A .; Martin, A.P .; Fernández, C .; Кларк, Д. (2007). «Значение нитрификации для океанической новой продукции». Природа. 447 (7147): 999–1002. Bibcode:2007Натура.447..999л. Дои:10.1038 / природа05885. PMID 17581584.
- ^ Крафт, Б. Строус, М. и Тегетмейер, Х. Э. (2011). «Микробное нитратное дыхание - гены, ферменты и распространение в окружающей среде». Журнал биотехнологии. 155 (1): 104–117. Дои:10.1016 / j.jbiotec.2010.12.025. PMID 21219945.CS1 maint: несколько имен: список авторов (связь)
- ^ Лам, Филлис и Кайперс, Марсель М. М. (2011). «Микробные азотные процессы в зонах минимального содержания кислорода». Ежегодный обзор морской науки. 3: 317–345. Bibcode:2011 ОРУЖИЕ .... 3..317Л. Дои:10.1146 / annurev-marine-120709-142814. PMID 21329208.CS1 maint: несколько имен: список авторов (связь)
- ^ Камп, Аня; Пиво, Дирк де; Nitsch, Jana L .; Лавик, Гаут; Стиф, Питер (2011-04-05). «Диатомовые водоросли дышат нитратами, чтобы выжить в темноте и бескислородных условиях». Труды Национальной академии наук. 108 (14): 5649–5654. Bibcode:2011PNAS..108.5649K. Дои:10.1073 / pnas.1015744108. ISSN 0027-8424. ЧВК 3078364. PMID 21402908.
- ^ Камп, Аня; Стиф, Питер; Knappe, Jan; Пиво, Дирк де (2013-12-02). "Ответ повсеместной пелагической диатомовой водоросли Thalassiosira weissflogii к тьме и аноксии ». PLOS ONE. 8 (12): e82605. Bibcode:2013PLoSO ... 882605K. Дои:10.1371 / journal.pone.0082605. ISSN 1932-6203. ЧВК 3846789. PMID 24312664.


