Меланин - Melanin
 | |
 | |
| Идентификаторы | |
|---|---|
| ChemSpider | |
PubChem CID | |
| Свойства | |
| C18ЧАС10N2О4 | |
| Молярная масса | 318.288 г · моль−1 |
| Плотность | От 1,6 до 1,8 г / см3 |
| Температура плавления | <-20 ° С (-4 ° F, 253 К) |
| Точка кипения | От 450 до 550 ° C (от 842 до 1022 ° F; от 723 до 823 K) |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
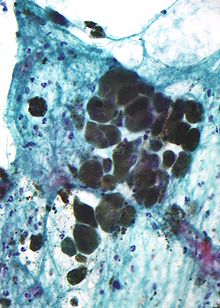

Меланин (/ˈмɛлəпɪп/ (![]() Слушать); от Греческий: μέλας мелас, "черный, темный") - широкий термин для группы естественных пигменты найдено в большинстве организмы. Меланин производится с помощью многоступенчатого химического процесса, известного как меланогенез, где окисление из аминокислота тирозин следует полимеризация. Пигменты меланина производятся в специальной группе клеток, известной как меланоциты.
Слушать); от Греческий: μέλας мелас, "черный, темный") - широкий термин для группы естественных пигменты найдено в большинстве организмы. Меланин производится с помощью многоступенчатого химического процесса, известного как меланогенез, где окисление из аминокислота тирозин следует полимеризация. Пигменты меланина производятся в специальной группе клеток, известной как меланоциты.
Есть три основных типа меланина: эумеланин, феомеланин, и нейромеланин. Самым распространенным типом является эумеланин, который бывает двух типов: коричневый эумеланин и черный эумеланин. Феомеланин - это цистеин -производное, содержащее полибензотиазин части, которые в значительной степени отвечают за цвет красные волосы, среди прочего пигментация. Нейромеланин содержится в мозг. Были проведены исследования для изучения его эффективности при лечении нейродегенеративных расстройств, таких как Болезнь Паркинсона.[1]
В коже человека меланогенез инициируется воздействием УФ-излучение, вызывая потемнение кожи. Меланин - эффективный поглотитель света; пигмент способен рассеивать более 99,9% поглощенного УФ-излучения.[2] Считается, что из-за этого свойства меланин защищает клетки кожи от UVB радиационное повреждение, снижая риск истощения фолиевой кислоты и деградации кожи, и считается, что воздействие УФ-излучения связано с повышенным риском злокачественная меланома, рак меланоцитов (меланиновых клеток). Исследования показали меньшую заболеваемость раком кожи у людей с более концентрированным меланином, т. Е. Темнее. оттенок кожи. Однако связь между пигментацией кожи и фотозащита все еще неясно.[3]
Люди
Эта секция нужны дополнительные цитаты для проверка. (Март 2015 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |

У людей меланин является основным фактором, определяющим цвет кожи. Он также встречается в волосы, пигментированная ткань, лежащая в основе Ирис глаза и сосудистая полоска из внутреннее ухо. В мозге ткани с меланином включают мозговое вещество и несущие пигмент нейроны в областях мозговой ствол, такой как голубое пятно. Это также происходит в zona reticularis из надпочечник.[4]
Меланин в коже производится меланоциты, которые находятся в базальный слой из эпидермис. Хотя в целом люди обладают одинаковой концентрацией меланоцитов в коже, у некоторых людей и этнических групп меланоциты производят различное количество меланина. У некоторых людей синтез меланина в организме очень низок или отсутствует, это состояние известно как альбинизм.[5]
Поскольку меланин представляет собой совокупность более мелких компонентных молекул, существует много различных типов меланина с разными пропорциями и схемами связывания этих компонентных молекул. И феомеланин, и эумеланин обнаруживаются в коже и волосах человека, но эумеланин является наиболее распространенным меланином у людей, а также формой, которая, скорее всего, будет дефицитной при альбинизме.[6]
Эумеланин
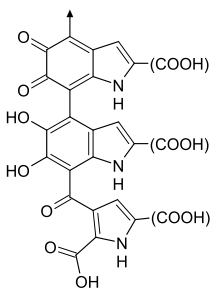
Долгое время считалось, что полимеры эумеланина содержат многочисленные поперечно-сшитые 5,6-дигидроксииндол (DHI ) и 5,6-дигидроксииндол-2-карбоновая кислота (DHICA ) полимеры.[7]
Существует два типа эумеланина: коричневый эумеланин и черный эумеланин. Эти два типа эумеланина химически отличаются друг от друга характером полимерных связей. Небольшое количество черного эумеланина при отсутствии других пигментов вызывает седину. Небольшое количество коричневого эумеланина при отсутствии других пигментов вызывает желтые (светлые) волосы. По мере старения организм продолжает вырабатывать черный эумеланин, но перестает вырабатывать коричневый эумеланин, что приводит к появлению седых волос, характерных для пожилых людей.[8]
Феомеланин
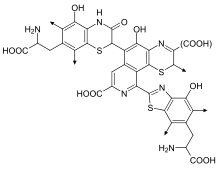
Феомеланины (или феомеланины) придают диапазон от желтоватого до красноватого цвета.[9] Феомеланины особенно сконцентрированы в губах, сосках, головке полового члена и влагалище.[10] Когда небольшое количество коричневого эумеланина в волосах, которое в противном случае привело бы к появлению светлых волос, смешивается с красным феомеланином, в результате образуются оранжевые волосы, которые обычно называют «рыжие» или «рыжие» волосы. Феомеланин также присутствует в коже, и, следовательно, у рыжих часто бывает более розоватый оттенок кожи.
С химической точки зрения феомеланины отличаются от эумеланинов тем, что в структуру олигомера входят бензотиазин и бензотиазол единицы, которые производятся,[11] вместо DHI и DHICA, когда аминокислота L-цистеин настоящее.
Трихохромы
Трихохромы (ранее называвшиеся трихосидеринами) представляют собой пигменты, полученные из тех же метаболический путь как эумеланины и феомеланины, но в отличие от этих молекул они имеют низкую молекулярную массу. Они встречаются в некоторых рыжих человеческих волосах.[12]
Нейромеланин
Нейромеланин (НМ) - это темный нерастворимый полимерный пигмент, вырабатываемый в определенных популяциях катехоламинергические нейроны в мозгу. У людей самое большое количество ЯМ, которое присутствует в меньших количествах у других приматов и полностью отсутствует у многих других видов.[13] Биологическая функция остается неизвестной, хотя было показано, что человеческий NM эффективно связывает переходные металлы такие как железо, а также другие потенциально токсичные молекулы. Следовательно, он может играть решающую роль в апоптоз и связанные болезнь Паркинсона.[14]
Другие организмы
Меланины выполняют очень разные роли и функции в разных организмах. Форма меланина составляет чернила, используемые многими головоногие моллюски (увидеть чернила головоногих ) как защитный механизм от хищников. Меланины также защищают микроорганизмы, такие как бактерии и грибы, от стрессов, вызывающих повреждение клеток, таких как УФ-излучение от солнца и активные формы кислорода. Меланин также защищает от повреждений, вызванных высокими температурами, химическими воздействиями (такими как тяжелые металлы и окислители ) и биохимические угрозы (например, защита хозяина от вторжения микробов).[15] Следовательно, у многих патогенных микробов (например, в Криптококк neoformans, гриб) меланины играют важную роль в вирулентность и патогенность защищая микроб от невосприимчивый ответы ее хозяин. У беспозвоночных основным аспектом системы врожденной иммунной защиты от вторжения патогенов является меланин. В течение нескольких минут после заражения микроб инкапсулируется в меланине (меланизация), и считается, что образование побочных продуктов свободных радикалов во время формирования этой капсулы помогает их убить.[16] Некоторые виды грибов, называемые радиотрофные грибы, похоже, могут использовать меланин в качестве фотосинтетический пигмент что позволяет им снимать гамма лучи[17] и использовать эту энергию для роста.[18]
Темнее перья из птицы обязаны своим цветом меланину и менее легко разлагаются бактериями, чем непигментированные или содержащие каротиноид пигменты.[19] Перья, содержащие меланин, также на 39% более устойчивы к истиранию, чем перья без него, потому что гранулы меланина помогают заполнить пространство между перьями. кератин пряди, образующие перья.[20][21] Синтез феомеланина у птиц подразумевает потребление цистеина, полузаменимой аминокислоты, которая необходима для синтеза антиоксидантного глутатиона (GSH), но может быть токсичной, если содержится в избытке в рационе. Действительно, хищные птицы, в рационе которых много белка, проявляют окраску на основе феомеланина.[22]
Меланин также важен для млекопитающее пигментация.[23] Рисунок шерсти млекопитающих определяется ген агути который регулирует распределение меланина.[24][25] Механизмы этого гена были тщательно изучены на мышах, чтобы дать представление о разнообразии структур шерсти млекопитающих.[26]
Меланин в членистоногие наблюдалось осаждение слоями, таким образом создавая Отражатель Брэгга переменного показателя преломления. Когда масштаб этого рисунка соответствует длине волны видимого света, структурная окраска возникает: давая ряду видов радужный цвет.[27]
Паукообразные являются одной из немногих групп, в которых меланин обнаружить нелегко, хотя исследователи обнаружили данные, свидетельствующие о том, что пауки действительно производят меланин.[28]
Некоторые виды моли, в том числе лесная тигровая моль, превращают ресурсы в меланин, чтобы улучшить их терморегуляцию. Поскольку у древесной тигровой бабочки есть популяции в большом диапазоне широт, было замечено, что более северные популяции показали более высокие темпы меланизации. Как у желтого, так и у белого мужского фенотипа лесной тигровой моли, особи с большим количеством меланина имели повышенную способность улавливать тепло, но повышенный уровень хищничества из-за более слабого и менее эффективного апосематический сигнал.[29]
Растения

Меланин, вырабатываемый растениями, иногда называют «катехоловые меланины», поскольку они могут давать катехол на плавление щелочей. Обычно это видно в ферментативное потемнение фруктов, таких как бананы. Меланин из скорлупы каштана можно использовать как антиоксидант и краситель.[30] Биосинтез включает окисление индол-5,6-хинон по типу тирозиназы полифенолоксидаза от тирозин и катехоламины приводит к образованию катехол меланина. Несмотря на это, многие растения содержат соединения, подавляющие выработку меланинов.[31]
Биосинтетические пути





Первым этапом пути биосинтеза как эумеланинов, так и феомеланинов является катализированный от тирозиназа.[32]
Допахинон может сочетаться с цистеин двумя путями к бензотиазинам и феомеланинам
- Допахинон + цистеин → 5-S-цистеинилдопа → промежуточный бензотиазин → феомеланин
- Допахинон + цистеин → 2-S-цистеинилдопа → промежуточный бензотиазин → феомеланин
Также допахинон можно преобразовать в лейкодопахром и пройдите еще два пути к эумеланинам
- Допахинон → лейкодопахром → допахром → 5,6-дигидроксииндол-2-карбоновая кислота → хинон → эумеланин
- Допахинон → лейкодопахром → допахром → 5,6-дигидроксииндол → хинон → эумеланин
Подробные метаболические пути можно найти в КЕГГ база данных (см. внешние ссылки ).
Микроскопический вид
Меланин коричневый, непреломляющий и мелкозернистый с отдельными гранулами, имеющими диаметр менее 800 нанометров. Это отличает меланин от обычного пигменты разложения крови, которые больше, массивны и преломлены, а их цвет варьируется от зеленого до желтого или красно-коричневого. В сильно пигментированных поражениях плотные агрегаты меланина могут скрывать гистологические детали. Разбавленный раствор перманганат калия эффективный отбеливатель меланина.[33]
Генетические нарушения и болезненные состояния
Существует примерно девять типов глазокожный альбинизм, которое чаще всего является аутосомно-рецессивным заболеванием. У некоторых этнических групп больше случаев различных форм. Например, наиболее распространенный тип, называемый кожно-кожным альбинизмом 2 типа (OCA2), особенно часто встречается у людей черного цвета. Африканский спуск. Это аутосомно-рецессивное заболевание, характеризующееся врожденный уменьшение или отсутствие пигмента меланина в коже, волосах и глазах. Предполагаемая частота OCA2 среди Негры составляет 1 из 10 000, что контрастирует с частотой 1 из 36 000 среди белых американцев.[34] В некоторых африканских странах частота заболевания еще выше - от 1 из 2000 до 1 из 5000.[35] Другая форма альбинизма, «желтый глазно-кожный альбинизм», по-видимому, более распространена среди Амишей, которые в первую очередь Швейцарский и Немецкий происхождение. У людей с этим вариантом IB обычно белые волосы и кожа при рождении, но в младенчестве быстро развивается нормальная пигментация кожи.[35]
Глазной альбинизм влияет не только на пигментацию глаз, но и на остроту зрения. Люди с альбинизмом обычно плохо проходят тесты, в диапазоне от 20/60 до 20/400. Кроме того, две формы альбинизма, примерно одна из 2700 наиболее распространенных среди людей пуэрториканского происхождения, связаны со смертностью, не считая смертей, связанных с меланомой.
Связь альбинизма и глухота хорошо известен, хотя плохо изучен. В своем трактате 1859 г. О происхождении видов, Чарльз Дарвин заметил, что «кошки, которые полностью белые и имеют голубые глаза, как правило, глухие».[36] У людей гипопигментация и глухота встречаются в редких случаях. Синдром Ваарденбурга, преимущественно наблюдается среди Хопи в Северная Америка.[37] Заболеваемость альбинизмом у индейцев хопи оценивается примерно в 1 из 200 человек. Подобные образцы альбинизма и глухоты были обнаружены у других млекопитающих, включая собак и грызунов. Однако недостаток меланина как таковой не несет прямой ответственности за глухоту, связанную с гипопигментацией, так как у большинства людей, лишенных ферментов, необходимых для синтеза меланина, слуховая функция нормальная.[38] Вместо отсутствия меланоциты в сосудистой полоске внутреннего уха приводит к кохлеарный обесценение,[39] правда, почему это так, до конца не понятно.
При болезни Паркинсона заболевание, поражающее нейромоторный При функционировании наблюдается снижение уровня нейромеланина в черной субстанции и голубом пятне как следствие специфического выпадения дофаминергических и норадренергических пигментированных нейронов. Это приводит к уменьшению дофамин и норэпинефрин синтез. Хотя о корреляции между расой и уровнем нейромеланина в черной субстанции не сообщалось, значительно более низкая частота болезни Паркинсона у чернокожих, чем у белых, «подтолкнула некоторых к предположению, что кожный меланин может каким-то образом служить для защиты нейромеланина в субстанции. черная от внешних токсинов ".[40]
Помимо дефицита меланина, молекулярная масса полимера меланина может быть уменьшена различными факторами, такими как окислительный стресс, воздействие света, нарушение его связи с меланосомными заболеваниями. матричные белки, изменения в pH, или в локальных концентрациях ионов металлов. Снижение молекулярной массы или снижение степени полимеризации глазной меланин было предложено превратить обычный антиоксидантный полимер в прооксидант. Предполагается, что в своем прооксидантном состоянии меланин участвует в возникновении и развитии дегенерация желтого пятна и меланома.[41] Расагилин, важный монотерапевтический препарат при болезни Паркинсона, обладает свойствами связывания меланина и свойствами уменьшения опухоли меланомы.[42]
Однако более высокие уровни эумеланина также могут быть недостатком, помимо более высокой предрасположенности к дефициту витамина D. Темная кожа - осложняющий фактор при лазерном удалении винные пятна. Как правило, лазеры эффективны для лечения белой кожи и менее успешно удаляют пятна портвейна у людей азиатского или африканского происхождения. Более высокие концентрации меланина у темнокожих людей просто рассеивают и поглощают лазерное излучение, препятствуя поглощению света тканью-мишенью. Аналогичным образом меланин может осложнить лазерное лечение других дерматологических заболеваний у людей с более темной кожей.
Веснушки и родинки образуются там, где в коже имеется локальная концентрация меланина. Они часто ассоциируются с бледной кожей.
Никотин имеет сродство к меланинсодержащим тканям из-за его функции-предшественника в синтезе меланина или необратимого связывания меланина. Было высказано предположение, что это лежит в основе увеличения никотиновая зависимость и ниже Отказ от курения ставки у лиц с более темным пигментом.[43]
Адаптация человека
Физиология
Меланоциты вставляют гранулы меланина в специализированные клеточные пузырьки называется меланосомы. Затем они переносятся в кератиноцит клетки человека эпидермис. Меланосомы в каждой реципиентной клетке накапливаются наверху ядро клетки, где они защищают ядерную ДНК от мутаций, вызванных ионизирующее излучение солнца ультрафиолетовый лучи. В общем, люди, чьи предки долгое время жили в регионах земного шара вблизи экватор в их коже содержится большее количество эумеланина. Это делает их кожу коричневой или черной и защищает их от сильного воздействия солнца, которое чаще приводит к меланомы у светлокожих людей.[44]
Не все эффекты пигментации благоприятны. Пигментация увеличивает тепловую нагрузку в жарком климате, и темнокожие люди поглощают на 30% больше тепла от солнечного света, чем очень светлокожие люди, хотя этот фактор может быть компенсирован более обильным потоотделением. В холодном климате темная кожа вызывает большие потери тепла за счет излучения. Пигментация также препятствует синтезу Витамин Д, поэтому в районах с плохим питанием темнокожие дети более склонны к рахит чем светлокожие дети. Поскольку пигментация кажется не совсем полезной для жизни в тропиках, были выдвинуты другие гипотезы о ее биологическом значении, например, вторичное явление, вызванное адаптацией к паразитам и тропическим болезням.[45]
Эволюционное происхождение
Ранние люди приобрели темный цвет кожи около 1,2 миллиона лет назад в результате адаптации к потере волос на теле, которая усилила воздействие УФ-излучения. До появления бесшерстности у древних людей под шерстью была достаточно светлая кожа, похожая на ту, что есть у других приматы.[46] Самые последние научные данные показывают, что анатомически современные люди развился в Африка от 200000 до 100000 лет,[47] а затем заселили остальной мир в результате одной миграции между 80 000 и 50 000 лет назад, в некоторых областях скрещивание с определенными архаичный человек виды (Неандертальцы, Денисовцы, и, возможно, другие).[48] Кажется вероятным, что у первых современных людей было относительно большое количество меланоцитов, продуцирующих эумеланин, которые производили более темную кожу, как у коренных жителей Африки сегодня. Поскольку некоторые из этих коренных людей мигрировали и поселились в Азия и Европа, селективное давление на производство эумеланина снижалось в климате, где солнечное излучение было менее интенсивным. В конечном итоге это привело к нынешнему диапазону цвета кожи человека. Из двух распространенных вариантов генов, связанных с бледной кожей человека, Mc1r не прошел положительный отбор,[49] в то время как SLC24A5 прошел положительный отбор.[50]
Эффекты
Как и в случае с людьми, мигрировавшими на север, люди со светлой кожей, мигрирующие к экватору, акклиматизируются к гораздо более сильному солнечному излучению. Природа выбирает меньше меланина, когда ультрафиолетовое излучение слабое. Кожа большинства людей темнеет под воздействием ультрафиолета, что дает им дополнительную защиту, когда это необходимо. Это физиологическая цель Солнечный загар. Темнокожие люди, вырабатывающие больше эумеланина, защищающего кожу, имеют лучшую защиту от солнечный ожог и развитие меланомы, потенциально смертельной формы рака кожи, а также других проблем со здоровьем, связанных с воздействием сильных солнечная радиация, в том числе фотодеградация определенных витамины такие как рибофлавины, каротиноиды, токоферол, и фолиевая кислота.[51] Немного Северо-западные европейцы существенно утратили способность загорать в результате ослабленного естественного отбора. Их кожа горит и шелушится, а не загорает. Это связано с тем, что они производят дефектную форму кожного белка Mc1r (рецептор меланокортина-1), который необходим для производства меланина. В тропических и субтропических средах они явно находятся в невыгодном положении. Они не только страдают от дискомфорта, связанного с легкостью обжигания, но и подвергаются гораздо более высокому риску рака кожи; то же самое и с альбиносами.[52]
Меланин в глазах, в Ирис и сосудистая оболочка, помогает защитить их от ультрафиолетовый и высокочастотный видимый свет; люди с серые, голубые и зеленые глаза больше подвержены риску возникновения проблем с глазами, связанных с солнцем. Кроме того, линза глаза желтеет с возрастом, обеспечивая дополнительную защиту. Однако с возрастом линза становится более жесткой, теряя большую часть своей проживание - способность изменять форму, чтобы сфокусироваться с дальнего на ближний - ущерб, вероятно, из-за белок сшивание, вызванное УФ-облучением.
Недавние исследования показывают, что меланин может выполнять не только фотозащитную функцию, но и не только для защиты от света.[53] Меланин способен эффективно хелат ионы металла через его карбоксилатные и фенольные гидроксильные группы, во многих случаях намного более эффективно, чем мощный хелатирующий лиганд этилендиаминтетраацетат (ЭДТА). Таким образом, он может служить для изоляции потенциально токсичных ионов металлов, защищая остальную часть клетки. Эта гипотеза подтверждается тем фактом, что потеря нейромеланина, наблюдаемая при болезни Паркинсона, сопровождается увеличением уровня железа в головном мозге.
Физические свойства и технологические применения
Существуют доказательства в поддержку сильно перекрестно связанного гетерополимер связанный ковалентно к матричным лесам меланопротеины.[54] Было высказано предположение, что способность меланина действовать как антиоксидант прямо пропорциональна степени полимеризации или молекулярный вес.[55] Субоптимальные условия для эффективной полимеризации меланина мономеры может привести к образованию прооксидантного меланина с более низкой молекулярной массой, который участвует в возникновении и развитии дегенерация желтого пятна и меланома.[56] Сигнальные пути это активизировать меланизация в пигментный эпителий сетчатки (RPE) также может быть причастен к подавление из стержень внешний сегмент фагоцитоз от НПП. Это явление частично объясняется фовеальный щадящий в дегенерация желтого пятна.[57]
Смотрите также
- Альбинос
- Альбинизм в биологии
- Синдром Грищелли, синдром, характеризующийся гипопигментацией
- Цвет кожи человека
- Теория меланина
- Меланизм
- Меланогенез, производство меланина
- Риски и преимущества пребывания на солнце
- Витамин Д
- Отбеливание кожи
- Феруловая кислота
использованная литература
- ^ Haining, Роберт Л .; Ахат-Мендес, Синди (март 2017 г.). «Нейромеланин, одна из самых недооцененных молекул в современной медицине, не является зрителем». Исследование нейронной регенерации. 12 (3): 372–375. Дои:10.4103/1673-5374.202928. ЧВК 5399705. PMID 28469642.
- ^ Мередит П., Рис Дж. (2004). «Квантовые выходы радиационной релаксации синтетического эумеланина». Фотохимия и фотобиология. 79 (2): 211–6. arXiv:cond-mat / 0312277. Дои:10.1111 / j.1751-1097.2004.tb00012.x. PMID 15068035.
- ^ Бреннер М., Слушающий VJ (2008). «Защитная роль меланина против УФ-повреждения кожи человека». Фотохимия и фотобиология. 84 (3): 539–49. Дои:10.1111 / j.1751-1097.2007.00226.x. ЧВК 2671032. PMID 18435612.
- ^ Солано, Ф. (2014). «Меланины: пигменты кожи и многое другое - типы, структурные модели, биологические функции и пути образования». Новый научный журнал. 2014: 1–28. Дои:10.1155/2014/498276.
- ^ Цихорек, Мирослава; Вачульска, Малгожата; Стасевич, Анета; Тиминьская, Агата (20 февраля 2013 г.). «Меланоциты кожи: биология и развитие». Достижения дерматологии и аллергологии. 30 (1): 30–41. Дои:10.5114 / pdia.2013.33376. ЧВК 3834696. PMID 24278043.
- ^ «глазокожный альбинизм». Домашний справочник по генетике. Получено 2017-09-25.
- ^ Мередит, Пол; Сарна, Тадеуш (01.12.2006). «Физико-химические свойства эумеланина». Исследование пигментных клеток. 19 (6): 572–594. Дои:10.1111 / j.1600-0749.2006.00345.x. PMID 17083485.
- ^ Ито, С .; Вакамацу, К. (декабрь 2011 г.). «Разнообразие пигментации волос человека, изученное с помощью химического анализа эумеланина и феомеланина». Журнал Европейской академии дерматологии и венерологии: JEADV. 25 (12): 1369–1380. Дои:10.1111 / j.1468-3083.2011.04278.x. ISSN 1468-3083. PMID 22077870.
- ^ Сломинский А., Тобин Д. Д., Шибахара С., Вортсман Дж. (Октябрь 2004 г.). «Пигментация меланина в коже млекопитающих и ее гормональная регуляция». Физиологические обзоры. 84 (4): 1155–228. Дои:10.1152 / физрев.00044.2003. PMID 15383650. S2CID 21168932.
- ^ «феомеланин». База данных метаболических путей MetaCyc. 2010.[требуется полная цитата ]
- ^ Greco G, Panzella L, Verotta L, d'Ischia M, Napolitano A (апрель 2011 г.). «Раскрытие структуры феомеланина рыжих волос человека: бензотиазолилтиазинодигидроизохинолины как ключевые строительные блоки». Журнал натуральных продуктов. 74 (4): 675–82. Дои:10.1021 / np100740n. PMID 21341762.
- ^ Prota, G .; Серл, А. Г. (1978). «Биохимические участки действия генов меланогенеза у млекопитающих». Анналы генетических и отборных животных. 10 (1): 1–8. Дои:10.1186/1297-9686-10-1-1. PMID 22896083.
- ^ Федоров Х, Трибл Ф, Халлидей Г, Герлах М, Ридерер П, Двойной К.Л. (2005). «Нейромеланин в нейронах дофамина человека: сравнение с периферическими меланинами и отношение к болезни Паркинсона». Прог Нейробиол. 75 (2): 109–124. Дои:10.1016 / j.pneurobio.2005.02.001. PMID 15784302. S2CID 503902.
- ^ Двойной КЛ (2006). «Функциональные эффекты нейромеланина и синтетического меланина в модельных системах». J нейронная передача. 113 (6): 751–756. Дои:10.1007 / s00702-006-0450-5. PMID 16755379. S2CID 23096297.
- ^ Гамильтон AJ, Гомес BL (март 2002 г.). «Меланины в грибковых возбудителях». Журнал медицинской микробиологии. 51 (3): 189–91. Дои:10.1099/0022-1317-51-3-189. PMID 11871612.
- ^ Cerenius L, Söderhäll K (апрель 2004 г.). «Система активации пропенолоксидазы у беспозвоночных». Иммунологические обзоры. 198: 116–26. Дои:10.1111 / j.0105-2896.2004.00116.x. PMID 15199959.
- ^ Кастельвекки, Давиде (26 мая 2007 г.). «Сила тьмы: пигмент, кажется, находит хорошее применение радиации». Новости науки. 171 (21): 325. Дои:10.1002 / scin.2007.5591712106.
- ^ Дадачева Э., Брайан Р.А., Хуанг Х и др. (2007). «Ионизирующее излучение изменяет электронные свойства меланина и усиливает рост меланизированных грибов». PLOS ONE. 2 (5): e457. Bibcode:2007PLoSO ... 2..457D. Дои:10.1371 / journal.pone.0000457. ЧВК 1866175. PMID 17520016.
- ^ Gunderson, Alex R .; Кадр, Алисия М .; Swaddle, Джон П .; Форсайт, Марк Х. (01.09.2008). «Устойчивость меланизированных перьев к бактериальной деградации: неужели все такое черно-белое?». Журнал биологии птиц. 39 (5): 539–545. Дои:10.1111 / j.0908-8857.2008.04413.x.
- ^ Бонсер, Ричард Х. С. (1995). «Меланин и устойчивость перьев к истиранию». Кондор. 97 (2): 590–591. Дои:10.2307/1369048. JSTOR 1369048.
- ^ Гальван, Исмаил; Солано, Франциско (2016-04-08). "Меланины покровов птиц: биосинтез, формы, функции и эволюция". Международный журнал молекулярных наук. 17 (4): 520. Дои:10.3390 / ijms17040520. ЧВК 4848976. PMID 27070583.
- ^ Родригес-Мартинес, Сол; Гальван, Исмаэль (2020). «Окраска оперения молоди на основе феомеланина чаще развивалась у хищных видов». Ибис. 162 (1): 238–244. Дои:10.1111 / ibi.12770. ISSN 1474-919X.
- ^ Джимбоу, К; Кеведо WC, младший; Фитцпатрик, ТБ; Сабо, Г. (июль 1976 г.). «Некоторые аспекты биологии меланина: 1950–1975». Журнал следственной дерматологии. 67 (1): 72–89. Дои:10.1111 / 1523-1747.ep12512500. PMID 819593.
- ^ Менели, Филипп (2014). Генетический анализ: гены, геномы и сети у эукариот. Издательство Оксфордского университета. ISBN 9780199681266.
- ^ Гриффитс, Энтони Дж. Ф.; Миллер, Джеффри Х .; Судзуки, Дэвид Т .; Левонтин, Ричард С .; Гелбарт, Уильям М. (2000). «Взаимодействие генов в окрасе шерсти млекопитающих». Цитировать журнал требует
| журнал =(Помогите) - ^ Millar, S.E .; Miller, M. W .; Стивенс, М. Э .; Барш, Г. С. (октябрь 1995 г.). «Экспрессия и трансгенные исследования гена агути у мышей дают представление о механизмах, с помощью которых генерируются образцы окраски шерсти млекопитающих». Развитие. 121 (10): 3223–3232. PMID 7588057.
- ^ Невилл, А. С. (2012). Биология кутикулы членистоногих. Springer Science & Business Media. ISBN 9783642809101.
- ^ Hsiung, B.-K .; Blackledge, T. A .; Шоуки, М. Д. (2015). "У пауков все-таки есть меланин". Журнал экспериментальной биологии. 218 (22): 3632–3635. Дои:10.1242 / jeb.128801. PMID 26449977.
- ^ Hegna, Роберт Х .; Нокелайнен, Осси; Hegna, Jonathan R .; Маппс, Джоанна (2013). «Дрожь или дрожь: усиление меланизации способствует терморегуляции, но снижает эффективность предупреждающих сигналов у лесной тигровой бабочки». Proc. R. Soc. B. 280 (1755): 20122812. Дои:10.1098 / rspb.2012.2812. ЧВК 3574392. PMID 23363631.
- ^ Яо, Цзэн-Ю; Ци, Цзянь-Хуа (22 апреля 2016 г.). «Сравнение антиоксидантной активности фракций меланина из скорлупы каштана». Молекулы. 21 (4): 487. Дои:10.3390 / молекулы21040487. ЧВК 6273334. PMID 27110763.
- ^ Kim, Y.-J .; Уяма, Х. (15 мая 2005 г.). «Ингибиторы тирозиназы из природных и синтетических источников: структура, механизм ингибирования и перспективы на будущее». Клеточные и молекулярные науки о жизни. 62 (15): 1707–1723. Дои:10.1007 / s00018-005-5054-у. PMID 15968468. S2CID 8280251.
- ^ Заиди Камаль Уддин; Али, Аиша С .; Али, Шарик А .; Нааз, Ишрат (2014). «Микробные тирозиназы: многообещающие ферменты для фармацевтики, пищевой биотехнологии и экологической промышленности». Biochemistry Research International. 2014: 1–16 (см. Рис. 3). Дои:10.1155/2014/854687. ЧВК 4033337. PMID 24895537.
- ^ «Меланин». pubchem.ncbi.nlm.nih.gov. Получено 2017-09-25.
- ^ «Глазокожный альбинизм». Архивировано из оригинал 23 декабря 2008 г.
- ^ а б «Глазные проявления альбинизма: история вопроса, патофизиология, эпидемиология». 18 июня 2018 г. - через eMedicine. Цитировать журнал требует
| журнал =(Помогите) - ^ «Причины изменчивости». Архивировано из оригинал 23 сентября 2006 г.. Получено 18 сентября, 2006.
- ^ EntrezGene 300700
- ^ EntrezGene 606933
- ^ Cable J, Huszar D, Jaenisch R, Steel KP (февраль 1994 г.). «Влияние мутаций в локусе W (c-kit) на пигментацию внутреннего уха и функцию у мышей». Исследование пигментных клеток. 7 (1): 17–32. Дои:10.1111 / j.1600-0749.1994.tb00015.x. PMID 7521050.
- ^ «Болезнь тельцов Леви». Архивировано из оригинал 21 июля 2009 г.
- ^ Meyskens FL, Farmer P, Fruehauf JP (июнь 2001 г.). «Редокс-регуляция меланоцитов и меланомы человека» (PDF). Исследование пигментных клеток. 14 (3): 148–54. Дои:10.1034 / j.1600-0749.2001.140303.x. PMID 11434561.
- ^ Мейер-Дэвис С.Р., Динес К., Арджманд Ф.М. и др. (Декабрь 2012 г.). «Сравнение перорального и трансдермального введения мезилата разагилина на рост опухоли меланомы человека in vivo». Кожная и глазная токсикология. 31 (4): 312–7. Дои:10.3109/15569527.2012.676119. PMID 22515841. S2CID 30344869.
- ^ Король Г., Йергер В.Б., Вемболуа Г.Л., Бендель Р.Б., Киттлс Р., Мулчан Э.Т. (июнь 2009 г.). «Связь между факультативным меланином и употреблением табака среди афроамериканцев». Фармакология, биохимия и поведение. 92 (4): 589–96. Дои:10.1016 / j.pbb.2009.02.011. PMID 19268687. S2CID 3070838.
- ^ «Изменение цвета кожи человека». Программа Смитсоновского института "Происхождение человека". 2012-06-20. Получено 2019-08-24.
- ^ Берт-Джонс, Дж. (2010), «Основная пигментация, пигментация человека и реакция на воздействие солнца», Тони Бернс; Стивен Бретнах; Нил Кокс; Кристофер Гриффитс (ред.), Учебник дерматологии Рока, 3 (8-е изд.), Wiley-Blackwell, стр. 58,9, ISBN 978-1-4051-6169-5
- ^ Уэйд, Николас (19 августа 2003 г.). "Почему люди и их мех разошлись". Нью-Йорк Таймс. ISSN 0362-4331. Получено 2019-08-24.
- ^ Тишкофф С.А., Рид Ф.А., Фридлендер Ф.Р. и др. (Май 2009 г.). «Генетическая структура и история африканцев и афроамериканцев». Наука. 324 (5930): 1035–44. Bibcode:2009Sci ... 324.1035T. Дои:10.1126 / science.1172257. ЧВК 2947357. PMID 19407144.
- ^ "Одна миграция из Африки заселила мир, как показывают исследования". Газета "Нью-Йорк Таймс. 2016-09-22.
- ^ Хардинг Р.М., Хили Э., Рэй А.Дж. и др. (Апрель 2000 г.). "Доказательства переменных избирательных давлений на MC1R". Американский журнал генетики человека. 66 (4): 1351–61. Дои:10.1086/302863. ЧВК 1288200. PMID 10733465.
- ^ Ламасон Р.Л., Мохидин М.А., Мест-Дж. Р. и др. (Декабрь 2005 г.). «SLC24A5, предполагаемый катионообменник, влияет на пигментацию у рыбок данио и людей». Наука. 310 (5755): 1782–6. Bibcode:2005Sci ... 310.1782L. Дои:10.1126 / science.1116238. PMID 16357253. S2CID 2245002.
- ^ Яблонски, Нина Г .; Чаплин, Джордж (11.05.2010). «Пигментация кожи человека как адаптация к УФ-излучению». Труды Национальной академии наук. 107 (Приложение 2): 8962–8968. Bibcode:2010PNAS..107.8962J. Дои:10.1073 / pnas.0914628107. ЧВК 3024016. PMID 20445093.
- ^ https://www2.palomar.edu/anthro/adapt/adapt_4.htm
- ^ Лю Ю., Хонг Л., Кемпф В.Р., Вакамацу К., Ито С., Саймон Дж. Д. (июнь 2004 г.). «Ионный обмен и адсорбция Fe (III) меланином сепии». Исследование пигментных клеток. 17 (3): 262–9. Дои:10.1111 / j.1600-0749.2004.00140.x. PMID 15140071.
- ^ Donatien PD, Orlow SJ (август 1995 г.). «Взаимодействие меланосомных белков с меланином». Европейский журнал биохимии. 232 (1): 159–64. Дои:10.1111 / j.1432-1033.1995.tb20794.x. PMID 7556145.
- ^ Сарангараджан Р., Апте СП (2005). «Агрегация и полимеризация меланина: возможные последствия возрастной дегенерации желтого пятна». Офтальмологические исследования. 37 (3): 136–41. Дои:10.1159/000085533. PMID 15867475. S2CID 27499198.
- ^ Мейскенс, Флорида, Фермер П.Дж., Антон-Калвер Х. (апрель 2004 г.). «Этиологический патогенез меланомы: объединяющая гипотеза об отсутствии атрибутивного риска» (PDF). Клинические исследования рака. 10 (8): 2581–3. Дои:10.1158 / 1078-0432.ccr-03-0638. PMID 15102657. S2CID 26079375.
- ^ Сарангараджан Р., Апте СП (2005). «Меланизация и фагоцитоз: последствия для возрастной дегенерации желтого пятна». Молекулярное зрение. 11: 482–90. PMID 16030499.
внешние ссылки
- «Спектр поглощения меланина». Департамент компьютерных наук и технологий.
- «Метаболизм тирозина - Контрольный путь». Киотская энциклопедия генов и геномов.
- «Меланогенез - эталонный путь». Киотская энциклопедия генов и геномов.

