Разработка препарата COVID-19 - COVID-19 drug development
| Часть серия на |
| COVID-19 пандемия |
|---|
 |
|
|
|
Разработка препарата COVID ‑ 19 это исследовательский процесс по разработке профилактических терапевтических отпускаемые по рецепту лекарства что облегчило бы тяжесть коронавирус заболевание 2019 (COVID-19). На международном уровне к ноябрю 2020 года несколько сотен фармацевтические компании, биотехнология фирмы, исследовательские группы университетов и организации здравоохранения разрабатывали более 500 потенциальных методов лечения болезни COVID ‑ 19 на различных стадиях доклинический или же клинические исследования.[1][2][3][4]
В Всемирная организация здоровья (ВОЗ),[5] Европейское агентство по лекарствам (EMA),[6] нас Управление по контролю за продуктами и лекарствами (FDA),[7] и китайское правительство и производители лекарств[8][9] координировали действия с академическими и промышленными исследователями, чтобы ускорить разработку вакцин, противовирусные препараты, и постинфекционная терапия.[10][11][12][13] В Платформа реестра международных клинических испытаний ВОЗ зарегистрировала 536 клинических исследований по разработке постинфекционных методов лечения инфекций COVID ‑ 19,[14][15] с многочисленными антивирусными препаратами для лечения других инфекций в рамках клинических исследований для перепрофилирования.[10][16][17][18][19]
В марте ВОЗ инициировала "SOLIDARITY Trial "в 10 странах с привлечением тысяч людей, инфицированных COVID ‑ 19, для оценки лечебных эффектов четырех существующих противовирусных препаратов с наибольшей надеждой на эффективность.[5][20] В апреле 2020 года был учрежден динамический систематический обзор для отслеживания прогресса зарегистрированных клинических испытаний вакцины COVID ‑ 19 и терапевтических лекарственных препаратов-кандидатов.[15]
Разработка лекарств - это многоступенчатый процесс, обычно требующий более пяти лет для обеспечения безопасности и эффективности нового соединения.[21] Несколько национальных регулирующих органов, таких как EMA и FDA, одобрили процедуры для ускорения клинических испытаний.[7][22] К ноябрю десятки потенциальных постинфекционных методов лечения находились на заключительной стадии тестирования на людях.[1][5][18] – Клинические испытания III – IV фазы. - и 13 кандидатов на вакцины имели вошли во второй или третий этап оценки безопасности, дозирования и эффективности для человека, Фаза II и Фаза III.[23]
Процесс
Разработка лекарств это процесс внедрения новой вакцины против инфекционного заболевания или терапевтический препарат на рынок однажды соединение свинца был идентифицирован в процессе открытие лекарств.[21] Это включает в себя лабораторное исследование на микроорганизмы и животных, подача заявки на получение нормативного статуса, например, через FDA, для исследуемый новый препарат инициировать клинические испытания на людях, и может включать этап получения одобрение регулирующих органов с применение нового препарата продавать препарат.[24][25] Весь процесс - от концепции до доклинических испытаний в лаборатории до разработки клинических испытаний, включая испытания фаз I – III - до одобренной вакцины или препарата, обычно занимает более десяти лет.[21][24][25]
Новые химические образования
Разработка вакцины против COVID ‑ 19 или терапевтического противовирусного препарата начинается с сопоставления химической концепции с потенциальным профилактическим механизмом будущей вакцины или противовирусной активности. in vivo.[24][25][26]
Дизайн лекарств и лабораторные испытания
Новые химические образования (НКП, также известные как новые молекулярные образования или NME) представляют собой соединения, которые возникают в процессе открытие лекарств для определения вакцины или противовирусного терапевтического кандидата, обещающего активность против биологической мишени, связанной с заболеванием COVID ‑ 19.[28] В начале разработки вакцины или лекарственного средства мало что известно о безопасности, токсичность, фармакокинетика, и метаболизм НПП у человека.[21][24][25] Функция и обязанность разработки лекарств - оценить все эти параметры до клинических испытаний на людях, чтобы доказать безопасность и эффективность. Еще одна важная цель разработки лекарств - рекомендовать дозу и график для первого использования в клинических испытаниях на людях ("первый человек «[FIH] или Первая доза для человека [FHD], ранее также известная как« первый человек »[FIM]).
Кроме того, при разработке лекарств необходимо установить физико-химические свойства NCE: его химический состав, стабильность и растворимость. Производители должны оптимизировать процесс, который они используют для производства химического вещества, чтобы они могли масштабироваться с медицинский химик производство миллиграммов, производство по килограмму и тонна шкала.[24][25] Они дополнительно исследуют продукт на пригодность для упаковки в капсулы, таблетки, аэрозольный, внутримышечный инъекционный, подкожный инъекционный или внутривенный составы. Вместе эти процессы известны в доклинических и клинических исследованиях как химия, производство и контроль (CMC).[24]
Многие аспекты разработки лекарств сосредоточены на удовлетворении нормативные требования органов лицензирования лекарственных средств.[21] Как правило, они представляют собой тесты, предназначенные для определения основных токсичностей нового соединения перед первым применением у людей.[21][24] Согласно нормативным требованиям проводится оценка токсичности основных органов (воздействие на сердце и легкие, мозг, почки, печень и пищеварительную систему), а также воздействия на другие части тела, на которые может повлиять препарат ( например, кожа, если новая вакцина должна вводиться путем кожной инъекции). Все чаще эти тесты проводятся с использованием in vitro методы (например, с изолированными клетками), но многие тесты можно провести только с использованием экспериментальных животных, чтобы продемонстрировать сложное взаимодействие метаболизма и воздействия лекарственного средства на токсичность.[24][29]
Информация собирается из этого доклинического тестирования, а также информация о CMC и передается в регулирующие органы (в США - в Управление по контролю за продуктами и лекарствами (FDA)), как Новый исследуемый препарат (IND) или Заявление на получение лицензии на биологические препараты (BLA) заявка на вакцину.[21][24][25][26] Если IND одобрен, разработка переходит в клиническую фазу,[21] и прогресс эффективности у людей - если вакцина находится в стадии разработки в Соединенных Штатах - контролируется FDA в «процессе утверждения вакцины».[30]
Усилия по оптимизации открытия лекарств
В течение 2018–2020 гг. Новые инициативы по стимулированию разработки вакцин и противовирусных препаратов включали партнерство между правительственными организациями и промышленностью, такими как европейские Инициатива инновационных лекарственных средств,[31] Соединенные штаты Инициатива критического пути для повышения инноваций в разработке лекарств,[32] и Прорыв в терапии назначение для ускорения разработки и регулятивного анализа перспективных лекарственных препаратов-кандидатов.[33] Для ускорения доработки диагностика для выявления инфекции COVID ‑ 19 сформирован глобальный диагностический конвейер-трекер.[34]
В марте 2020 г. Коалиция за инновации в обеспечении готовности к эпидемиям (CEPI) инициировал международный фонд разработки вакцины COVID ‑ 19 с целью собрать 2 миллиарда долларов США для исследований и разработок вакцин,[35] и привержены инвестициям 100 миллионов долларов США в разработке вакцины в нескольких странах.[36] В Канадское правительство объявил 275 млн канадских долларов в финансировании 96 исследовательских проектов по медицинским мерам противодействия COVID ‑ 19, включая многочисленные вакцины-кандидаты в канадских университетах,[37][38] с планами создать «банк вакцин» новых вакцин для внедрения в случае новой вспышки коронавируса.[38][39] В Фонд Билла и Мелинды Гейтс вложил АМЕРИКАНСКИЙ ДОЛЛАР$150 миллионов в апреле на разработку вакцин, средств диагностики и лечения COVID ‑ 19.[40]
Компьютерное исследование
Этот раздел должен быть обновлено. (Ноябрь 2020) |
В марте 2020 г. Министерство энергетики США, Национальный фонд науки, НАСА, промышленность и девять университетов объединили ресурсы для доступа к суперкомпьютерам из IBM в сочетании с ресурсами облачных вычислений от Hewlett Packard Enterprise, Amazon, Microsoft, и Google, за открытие лекарств.[41][42] Консорциум высокопроизводительных вычислений COVID ‑ 19 также нацелен на прогнозирование распространения заболеваний, моделирование возможных вакцин и скрининг тысяч химических соединений для разработки вакцины или терапии COVID ‑ 19.[41][42]
Институт цифровой трансформации C3.ai, дополнительный консорциум Microsoft, шесть университетов (включая Массачусетский Институт Технологий, член первого консорциума), а Национальный центр суперкомпьютерных приложений в Иллинойсе, работая под эгидой C3.ai, компании по разработке программного обеспечения для искусственного интеллекта, объединяют суперкомпьютерные ресурсы для открытия лекарств, разработки медицинских протоколов и улучшения стратегии общественного здравоохранения, а также предоставляют большие гранты исследователям, которые к маю предложили использовать ИИ. выполнять аналогичные задачи.[43][44]
В марте 2020 г. распределенных вычислений проект Складной @ дома запустила программу помощи разработчикам лекарств, первоначально моделируя белковые мишени из SARS-CoV-2 и родственного вируса SARS-CoV, который был изучен ранее.[45][46][47]
Проект распределенных вычислений Rosetta @ home также присоединился к усилиям в марте. В проекте используются компьютеры добровольцев для моделирования белков вируса SARS-CoV-2, чтобы обнаружить возможные мишени для лекарств или создать новые белки для нейтрализации вируса. Исследователи обнаружили, что с помощью Rosetta @ home им удалось «точно предсказать атомную структуру важного белка коронавируса за несколько недель до того, как ее можно будет измерить в лаборатории».[48]
В мае 2020 года партнерство OpenPandemics - COVID ‑ 19 между Scripps Research и IBM Сетка мирового сообщества был запущен. Партнерство представляет собой проект распределенных вычислений, который «автоматически запустит моделируемый эксперимент в фоновом режиме [подключенных домашних компьютеров], который поможет предсказать эффективность конкретного химического соединения в качестве возможного лечения COVID ‑ 19».[49]
Этапы клинических испытаний
Клинические испытания программы включают три многолетних этапа до утверждения продукта и четвертый этап после утверждения для постоянного мониторинга безопасности вакцины или лекарственной терапии:[21][50]
- Исследования фазы I, обычно на здоровых добровольцах, определяют безопасность и дозировку.
- Испытания фазы II используются для определения первоначальной оценки эффективности и дальнейшего изучения безопасности у небольшого числа людей, страдающих заболеванием, на которое нацелена NCE.
- Испытания фазы III крупные, ключевые испытания для определения безопасности и эффективности у достаточно большого числа людей с инфекцией COVID ‑ 19. Если безопасность и эффективность будут надлежащим образом доказаны, клинические испытания могут остановиться на этом этапе и NCE перейдет к следующему этапу. применение нового препарата (NDA) этап, чтобы начать маркетинг.[21]
- Испытания фазы IV - это испытания после утверждения, которые могут быть условием, прикрепленным FDA, также называемым послепродажное наблюдение исследования. Пока вакцина не будет предоставлена населению в целом, все потенциальные неблагоприятные события остаются неидентифицированными, требуя, чтобы вакцины проходили исследования фазы IV с регулярными отчетами производителя в Система сообщений о побочных эффектах вакцины (VAERS) для выявления проблем после начала использования у населения.[30]
Процесс определения характеристик лекарственного средства не прекращается после того, как NCE переходит в клинические испытания на людях. В дополнение к тестам, необходимым для подачи новой вакцины или противовирусного препарата в клинику в первый раз, производители должны гарантировать, что любые долгосрочные или хронические токсические эффекты четко определены, включая воздействие на системы, которые ранее не контролировались (фертильность, репродуктивность, иммунная система, среди прочего).[24][30] Если вакцина-кандидат или противовирусное соединение выявляются в результате этих испытаний с приемлемым профилем токсичности и безопасности, и производитель может дополнительно продемонстрировать, что они обладают желаемым эффектом в клинических испытаниях, тогда портфель доказательств NCE может быть представлен для утверждения на рынке в различных странах. где производитель планирует его продавать.[21] В США этот процесс называется "применение нового препарата "или NDA.[21][24]
Адаптивный дизайн для исследований COVID ‑ 19
Дизайн незавершенного клинического исследования может быть изменен как «адаптивный дизайн», если накопление данных в ходе исследования дает ранние сведения о положительной или отрицательной эффективности лечения.[51][52] В глобальных испытаниях «Солидарность» и «Европейское открытие» с участием госпитализированных людей с тяжелой инфекцией COVID ‑ 19 применяется адаптивный дизайн для быстрого изменения параметров испытания по мере появления результатов четырех экспериментальных терапевтических стратегий.[14][53][54] Адаптивные дизайны в рамках продолжающихся фаз II – III клинических испытаний терапевтических кандидатов могут сократить продолжительность испытаний и использовать меньшее количество субъектов, возможно, ускорить принятие решений о досрочном прекращении или успехе, а также координировать изменения дизайна для конкретного испытания во всех странах мира.[52][55][56]
Интенсивность отказов
Большинство новых лекарственных препаратов-кандидатов (НКЭ) терпят неудачу во время разработки лекарств либо потому, что они обладают неприемлемой токсичностью, либо потому, что они просто не доказывают свою эффективность в отношении целевого заболевания, как показано в клинических испытаниях фазы II – III.[21][24] Критические обзоры программ разработки лекарственных средств показывают, что клинические испытания фазы II – III терпят неудачу в основном из-за неизвестных токсичных веществ. побочные эффекты (50% сбоев фазы II кардиология клинических испытаний), а также из-за недостаточного финансирования, недостатков дизайна испытаний или неудовлетворительного проведения испытаний.[55][57]
Исследование, охватывающее клинические исследования 1980–90-х годов, показало, что только 21,5% кандидатов в лекарства, которые начали испытания фазы I, в конечном итоге были одобрены для продажи.[58] В течение 2006–15 годов показатель успешности получения одобрения от фазы I для успешных испытаний фазы III был в среднем менее 10% и 16% специально для вакцин.[59] Высокий процент неудач, связанный с разработкой фармацевтических препаратов, называется «показателем истощения», требующим принятия решений на ранних стадиях разработки лекарств, чтобы «закрыть» проекты на раннем этапе, чтобы избежать дорогостоящих неудач.[59][60]
Расходы
Одно исследование 2010 года оценило как капитализированные, так и наличные затраты на вывод на рынок одного нового препарата примерно в 1,8 млрд долларов США и 870 млн долларов США соответственно.[61] А медиана смета расходов на исследования по разработке 10 противораковых препаратов в 2015–16 годах составила 648 миллионов долларов.[62] В 2017 году средняя стоимость основного исследования по всем клиническим показаниям составила 19 миллионов долларов.[63]
Средняя стоимость (2013 г.) каждый этап клинических исследований составила 25 миллионов долларов США для исследования безопасности фазы I, 59 миллионов долларов США для фазы II. рандомизированное контролируемое исследование эффективности, и 255 миллионов долларов за основное испытание фазы III чтобы продемонстрировать его эквивалентность или превосходство над существующим одобренным лекарственным средством,[64] возможно, до 345 миллионов долларов.[63] Средняя стоимость проведения основного исследования фазы III на 2015–2016 гг. На кандидате от инфекционного заболевания составила 22 миллиона долларов.[63]
Полная стоимость доставки нового препарата (т. Е. новое химическое соединение ) на рынок - от открытия через клинические испытания до утверждения - сложный и противоречивый.[24][25][63][65] В обзоре, проведенном в 2016 г. по 106 кандидатам в лекарственные препараты, оцененным в ходе клинических испытаний, общее капитальные затраты для производителя, имеющего лекарство, одобренное в результате успешных испытаний фазы III, составила 2,6 миллиарда долларов (в долларах 2013 года), и эта сумма увеличивается ежегодно на 8,5%.[64] В период 2003–2013 гг. Для компаний, которые одобрили 8–13 препаратов, стоимость одного препарата может вырасти до 5,5 млрд долларов, в основном из-за международной географической экспансии на маркетинг и текущих затрат на Испытания фазы IV для непрерывного наблюдения за безопасностью.[66]
Альтернативы разработке традиционных лекарств направлены на сотрудничество университетов, правительств и фармацевтической промышленности и оптимизацию ресурсов.[67]
Обзор клинических испытаний COVID-19: сроки в 2020 г.
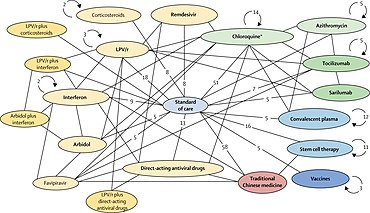
По данным двух организаций, отслеживающих прогресс клинических испытаний потенциальных терапевтических препаратов от инфекций COVID ‑ 19, 29 испытаний эффективности II – IV фаз были завершены в марте или должны были предоставить результаты в апреле в больницах Китая, где произошла первая вспышка COVID ‑ 19. в конце 2019 года.[1][2] В семи испытаниях оценивались лекарственные препараты, уже одобренные для лечения малярия, включая четыре исследования гидроксихлорохина или хлорохинфосфата.[1] Перепрофилированные противовирусные препараты составляют большую часть китайских исследований: к концу апреля должны быть представлены результаты 9 исследований фазы III ремдесивира в нескольких странах.[1] Другими потенциальными терапевтическими кандидатами в рамках основных клинических испытаний, завершающихся в марте – апреле, являются: вазодилататоры, кортикостероиды, иммунотерапия, липоевая кислота, бевацизумаб, и рекомбинантный ангиотензин-превращающий фермент 2, среди прочего.
Коалиция клинических исследований COVID ‑ 19 преследует следующие цели: 1) способствовать быстрому рассмотрению предложений по клиническим испытаниям комитеты по этике и национальные регулирующие органы; 2) ускоренное получение разрешений на терапевтические соединения-кандидаты; 3) обеспечение стандартизированного и быстрого анализа новых данных об эффективности и безопасности; 4) содействие обмену результатами клинических испытаний перед публикацией.[14] По состоянию на апрель проводился динамический обзор клинических разработок вакцины COVID ‑ 19 и лекарственных препаратов-кандидатов.[15]
К марту 2020 г. Коалиция за инновации в обеспечении готовности к эпидемиям (CEPI) обязалась инвестировать 100 миллионов долларов США в исследования в нескольких странах,[36] и выступил с настоятельным призывом собрать и быстро инвестировать 2 миллиарда долларов в разработку вакцины.[68] Во главе с Фонд Билла и Мелинды Гейтс с партнерами, инвестирующими 125 долларов США миллионов и координируясь с Всемирной организацией здравоохранения, ускоритель терапии COVID ‑ 19 начал свою работу в марте, помогая исследователям в области разработки лекарств быстро выявлять, оценивать, разрабатывать и увеличить масштаб потенциальные методы лечения.[69] Коалиция клинических исследований COVID ‑ 19 сформирована для координации и ускорения результатов международных клинических испытаний наиболее перспективных методов лечения после инфицирования.[14] В начале 2020 года многочисленные проверенные противовирусные препараты для лечения других инфекций были перепрофилированы или разработаны в рамках новых клинических исследований, направленных на облегчение заболевания COVID ‑ 19.[1][10][16][17]
Терапевтические кандидаты
Испытания фазы III – IV
Основные испытания фазы III оценить эффективность лекарственного препарата-кандидата конкретно против заболевания и - в случае госпитализации людей с тяжелой инфекцией COVID ‑ 19 - проверить уровень эффективной дозы перепрофилированного или нового лекарственного препарата-кандидата для лечения заболевания (в первую очередь пневмонии) от COVID ‑19 инфекция.[5][14][71] Для уже одобренного препарата (например, гидроксихлорохин от малярии), Испытания фазы III – IV определить для сотен и тысяч людей, инфицированных COVID ‑ 19, возможное расширенное использование уже одобренного препарата для лечения инфекции COVID ‑ 19.[71] По состоянию на август 2020 года более 500 терапевтических кандидатов находились на доклинической стадии или в стадии разработки I – IV фазы.[2] с объявлением о новых испытаниях фаз II – III для сотен терапевтических кандидатов в течение 2020 г.[1][2][3][4]
Международная солидарность и испытания открытий
В марте Всемирная организация здравоохранения (ВОЗ) начала скоординированное «испытание солидарности» в 10 странах по пяти континенты для быстрой оценки тысяч людей, инфицированных COVID ‑ 19, потенциальной эффективности существующих противовирусных и противовоспалительное средство агенты, еще не прошедшие специальную оценку на заболевание COVID ‑ 19.[5][20] К концу апреля в испытании были задействованы больницы более чем 100 стран.[72]
Индивидуальные или комбинированные препараты, подлежащие первоначальному изучению: 1) лопинавир –ритонавир в сочетании, 2) лопинавир – ритонавир в сочетании с интерферон-бета, 3) Ремдесивир или 4) (гидрокси)хлорохин в отдельных исследованиях и больницах по всему миру.[5][20] По результатам исследования, опубликованного Ланцет в связи с проблемами безопасности гидроксихлорохина ВОЗ приостановила его использование в ходе исследования Солидарности в мае 2020 года,[73][74] восстановил его после того, как исследование было отозвано,[75] затем отказались от дальнейшего использования препарата для лечения COVID ‑ 19, когда анализ в июне показал, что он не приносит пользы.[76]
Около 15% людей, инфицированных COVID ‑ 19, имеют тяжелые заболевания, а больницы перегружены во время пандемии, ВОЗ признала необходимость быстрой клинической проверки и перепрофилирования этих препаратов в качестве средств, уже одобренных для лечения других заболеваний и признанных безопасными.[5] Проект «Солидарность» предназначен для быстрого понимания ключевых клинических вопросов:[5][77]
- Снижают ли какие-либо препараты смертность?
- Сокращает ли какой-либо из препаратов время госпитализации пациента?
- Влияет ли лечение на потребность людей с пневмонией, вызванной COVID ‑ 19, в вентиляции или поддержании в стационаре? интенсивная терапия ?
- Можно ли использовать такие препараты для минимизации заболеваемости инфекцией COVID ‑ 19 в медицинский персонал а люди с высоким риском развития тяжелых заболеваний?
Регистрация людей с инфекцией COVID ‑ 19 упрощается за счет ввода данных, в том числе информированное согласие на веб-сайте ВОЗ.[5] После того, как персонал исследования определит, какие лекарства доступны в больнице, веб-сайт ВОЗ рандомизирует госпитализированный субъект, принимающий один из исследуемых препаратов или больничный стандарт лечения COVID ‑ 19. Врач исследования регистрирует и отправляет последующую информацию о статусе субъекта и лечении, завершая ввод данных через веб-сайт солидарности ВОЗ.[5] Судебный процесс солидарности двойной слепой - что обычно является стандартом для высококачественных клинических испытаний, - но ВОЗ нуждалась в скорости и качестве для исследования во многих больницах и странах.[5] Глобальный Совет по контролю безопасности врачей ВОЗ исследовать промежуточные результаты для принятия решений по безопасности и эффективности исследуемых препаратов, а также для изменения дизайна исследования или рекомендации эффективной терапии.[5][77] Аналогичное интернет-исследование «Солидарности» под названием «Открытие» было инициировано в марте в семи странах компанией INSERM (Париж, Франция ).[5][53]
Испытание «Солидарность» направлено на координацию работы сотен больниц в разных странах, в том числе с плохо развитой инфраструктурой для клинических испытаний, но его необходимо проводить быстро. В соответствии с Джон-Арне Рёттинген, исполнительный директор Исследовательский совет Норвегии и председатель Международного суда солидарности руководящий комитет, испытание будет считаться эффективным, если терапия будет направлена на «сокращение доли пациентов, нуждающихся в аппаратах искусственной вентиляции легких, скажем, на 20%, что может оказать огромное влияние на наши национальные системы здравоохранения».[4]
В марте финансирование судебного процесса «Солидарности» достигло 108 долларов США миллионов от 203 000 частных лиц, организаций и правительств, из 45 стран, участвующих в финансировании или управлении исследованиями.[78]
Пробное восстановление
В течение апреля британское исследование RECOVERY (рандомизированная оценка терапии COVid-19) было запущено первоначально в 132 больницах Великобритании.[79] расширяется, чтобы стать одним из крупнейших в мире клинических исследований COVID ‑ 19 с участием 5400 инфицированных людей, проходящих лечение в 165 больницах Великобритании, по состоянию на середину апреля.[80] В исследовании изучаются различные возможные методы лечения тяжелой инфекции COVID ‑ 19: лопинавир / ритонавир в низких дозах. дексаметазон (противовоспалительное стероидный препарат ), гидроксихлорохин и азитромицин (обычный антибиотик ).[81] В июне экспериментальная группа с использованием гидроксихлорохина была прекращена, когда анализы показали, что он не приносит пользы.[82]
16 июня испытательная группа опубликовала заявление о том, что дексаметазон снижает смертность у пациентов, получающих респираторную поддержку.[83] В контролируемое испытание дексаметазон вводили около 2000 пациентов в больницах, по сравнению с более чем 4000 пациентов, которые его не принимали. Для пациентов, находящихся на искусственной вентиляции легких, это снизило риск смерти с 40% до 28% (1 из 8). Для пациентов, нуждающихся в кислороде, это снижает риск смерти с 25% до 20% (1 из 5).[84]
Испытание адаптивного лечения COVID-19
Соединенные штаты Национальный институт аллергии и инфекционных заболеваний (NIAID) инициировало международное исследование фазы III с адаптивным дизайном (так называемое «ACTT»), в котором приняли участие до 800 госпитализированных пациентов с COVID ‑ 19 в 100 центрах в разных странах.[85] Начиная с использования ремдесивира в качестве основного лечения в течение 29 дней, в испытательном определении его адаптивного протокола говорится, что «будет проводиться временный мониторинг для внедрения новых групп и возможности раннего прекращения лечения из-за бесполезности, эффективности или безопасности. эффективен, тогда это лечение может стать контрольной группой для сравнения (й) с новым экспериментальным лечением (ами) ».[85]
Составление таблицы кандидатов на лечение на поздних стадиях
Многочисленные лекарственные препараты-кандидаты изучаются в качестве «поддерживающих» методов лечения для облегчения дискомфорта во время болезни, такие как НПВП или же бронходилататоры, не включены в приведенную ниже таблицу. Другие в исследованиях фазы II ранней стадии или многочисленные кандидаты на лечение в исследованиях фазы I,[1][2] также исключены. Лекарственные препараты-кандидаты в исследованиях фазы I – II имеют низкий уровень успеха (менее 12%) для прохождения всех этапов испытаний для получения в конечном итоге одобрения.[24][55] Достигнув фазы III испытаний, кандидаты на лечение заболеваний, связанных с инфекцией COVID ‑ 19 - заразный и респираторные заболевания - имеют показатель успеха около 72%.[59]
| COVID ‑ 19: лекарственные препараты-кандидаты в исследованиях фазы III – IV | ||||||
|---|---|---|---|---|---|---|
| Кандидат в наркотики | Описание | Подтверждение существующего заболевания | Спонсор (-ы) исследования | Местоположение (а) | Ожидаемые результаты | Примечания, Рекомендации |
| Ремдесивир | противовирусное средство; аденозин нуклеотидный аналог подавление РНК синтез в коронавирусы | следственный[86] | Галаад, ВОЗ, INSERM, НИАИД | Китай, Япония изначально; расширен на международном уровне в испытаниях Global Solidarity and Discovery Trials и US NIAID ACTT Trial | Середина 2020 г. (испытания в Китае и Японии) | [1][53][87] выборочно предоставляется компанией Gilead для аварийного доступа в связи с COVID ‑ 19;[88][89] как многообещающие, так и отрицательные эффекты сообщили в апреле[85][90][91] |
| Гидроксихлорохин или же хлорохин | противопаразитарный и противоревматический; общий сделано многими производителями | малярия, ревматоидный артрит, волчанка (Международный)[92][93] | CEPI, ВОЗ, INSERM | Несколько сайтов в Китае; глобальные испытания солидарности и открытий | Июнь 2020 г. (снято с производства ВОЗ) | множественные побочные эффекты; возможные неблагоприятные рецептурный препарат взаимодействия;[92][93] прекращено в июне из исследования ВОЗ Solidarity и UK Recovery как «не имеющее клинической пользы для госпитализированных пациентов с COVID ‑ 19»;[76][82] испытания[1][53] |
| Фавипиравир | противовирусный против гриппа | грипп (Китай)[94] | Fujifilm | Китай | Апрель 2020 | [1][11][95] |
| Лопинавир / ритонавир без или с интерферон бета-1а | противовирусное, подавление иммунитета | исследовательская комбинация; лопинавир / ритонавир одобрен[96] | CEPI, ВОЗ, Правительство Великобритании, Univ. Оксфорда, INSERM | Глобальные испытания солидарности и открытий, несколько стран | середина 2020 года | [1][53] |
| Сарилумаб | человек моноклональное антитело против рецептор интерлейкина-6 | ревматоидный артрит (США, Европа)[97] | Регенерон -Санофи | Несколько стран | Весна 2020 | [1][98] |
| ASC-09 + ритонавир | противовирусное средство | комбинация не утверждена; ритонавир одобрен для ВИЧ[96] | Асклетис Фарма | Несколько сайтов в Китае | Весна 2020 | [1][99] |
| Тоцилизумаб | человеческое моноклональное антитело против рецептора интерлейкина-6 | иммуносупрессия, ревматоидный артрит (США, Европа)[100] | Genentech -Hoffmann-La Roche | Несколько стран | середина 2020 года | [1][2][101] В конце июля компания Roche объявила, что ее испытание фазы III тоцилизумаба для лечения пневмонии у госпитализированных людей с инфекцией COVID-19 было неэффективным.[102] |
| Лензилумаб | очеловеченный моноклональное антитело для снятия пневмонии | новый кандидат в наркотики | Humanigen, Inc. | Несколько сайтов в США | Сентябрь 2020 | [1][103] |
| Дапаглифлозин | ингибитор натрий-глюкозного котранспортера 2 | гипогликемия агент[104] | Среднеамериканский институт сердца Святого Луки, АстраЗенека | Несколько стран | Декабрь 2020 г. | [1][105] |
| CD24Fc | противовирусное средство иммуномодулятор против воспалительной реакции | новый кандидат в наркотики | OncoImmune, Inc. | Несколько сайтов в США | 2021 | [1][106] |
Хлорохин и гидроксихлорохин
Хлорохин является противомалярийный лекарство, которое также используется против некоторых аутоиммунный болезни. Гидроксихлорохин более доступен, чем хлорохин в Соединенных Штатах.[89] Хотя несколько стран первоначально использовали хлорохин или гидроксихлорохин для лечения пациентов, госпитализированных с COVID ‑ 19 (по состоянию на март 2020 г.), препарат не получил официального одобрения в ходе клинических испытаний.[89][107] и его использование было прекращено в качестве возможного лечения инфекции COVID-19, когда было доказано, что он не приносит пользы госпитализированным пациентам с тяжелым заболеванием COVID-19 в международном масштабе. Суд солидарности и Великобритания ВОССТАНОВЛЕНИЕ.[76][82]
В Соединенных Штатах экспериментальное лечение было сначала разрешено только для экстренного использования для людей, госпитализированных, но неспособных получить лечение в клинических испытаниях.[108] но это разрешение было отозвано FDA в июне, заявив, что «больше неразумно полагать», что препарат эффективен против COVID ‑ 19 или что его преимущества перевешивают «известные и потенциальные риски».[109] Гидроксихлорохин используется как профилактический в Индии.[110][111]
В ноябре 2020 г. Национальные институты здоровья (NIH) клиническое исследование по оценке безопасности и эффективности гидроксихлорохина для лечения взрослых с коронавирусной болезнью 2019 (COVID-19) официально пришло к выводу, что препарат не приносит клинической пользы госпитализированным пациентам.[112][113]
Фон
Первоначально хлорохин был рекомендован органами здравоохранения Индии, Китая, Южной Кореи и Италии для лечения COVID ‑ 19,[114] хотя эти агентства и CDC США отметили противопоказания для людей с сердечное заболевание или же сахарный диабет.[89][115] В феврале 2020 года было показано, что оба препарата эффективно уменьшают заболевание COVID ‑ 19, но дальнейшее исследование показало, что гидроксихлорохин более эффективен, чем хлорохин, и имеет более переносимый профиль безопасности.[116][117] 18 марта ВОЗ объявила, что хлорохин и родственные ему гидроксихлорохин будет среди четырех лекарств, изученных в рамках клинических испытаний Солидарности.[118]
Гидроксихлорохин и хлорохин обладают множеством потенциально серьезных, побочные эффекты, Такие как ретинопатия, гипогликемия, или опасный для жизни аритмия и кардиомиопатия.[92] Оба препарата имеют обширные взаимодействия с лекарствами, отпускаемыми по рецепту, влияющими на терапевтическую дозу и смягчение болезни.[92][93] У некоторых людей есть аллергические реакции к этим препаратам.[92][93] Национальный институт здоровья не рекомендовал использовать комбинацию гидроксихлорохина и азитромицина из-за повышенного риска внезапной сердечной смерти.[119]
Фавипиравир
Китайские клинические испытания в Ухань и Шэньчжэнь утверждал, чтобы показать, что фавипиравир был «явно эффективным».[120] Из 35 пациентов в Шэньчжэне тесты дали отрицательный результат в среднем через 4 дня, в то время как продолжительность болезни составила 11 дней у 45 пациентов, которые его не получили.[121] В исследовании, проведенном в Ухане с участием 240 пациентов с пневмонией, половине давали фавипиравир, а половине - умифеновир. Исследователи обнаружили, что пациенты быстрее выздоравливали от кашля и лихорадки при лечении фавипиравиром, но не было изменений в том, сколько пациентов в каждой группе прогрессировало до более поздних стадий заболевания, требующих лечения с помощью аппарата ИВЛ.[122]
22 марта 2020 года Италия одобрила препарат для экспериментального использования против COVID ‑ 19 и начала проводить испытания в трех регионах, наиболее пострадавших от болезни.[123] Итальянское фармацевтическое агентство напомнило общественности, что имеющиеся доказательства в поддержку препарата являются скудными и предварительными.[124]
30 мая 2020 года Минздрав России утвердил общий версия фавипиравира названа Авифавир, который оказался очень эффективным на первом этапе клинические испытания.[125][126][127]
В июне 2020 года Индия одобрила использование генерической версии фавиправира под названием FabiFlu, разработанной Glenmark Pharmaceuticals, при лечении легких и умеренных случаев COVID ‑ 19.[128]
Ремдесивир
А нуклеотидный аналог Ремдесивир - это противовирусный препарат кандидат изначально разработан для лечения Болезнь, вызванная вирусом Эбола.[129] Это конкретно аденозин аналог, который вставляется в популярный Цепи РНК, вызывая преждевременное разрушение цепей.[130] Он изучался как возможное постинфекционное лечение COVID-19.[5] В мае 2020 года в нескольких странах было проведено девять исследований фазы III ремдесивира.[1][86] В ноябре 2020 года Всемирная организация здравоохранения обновила свое руководство по терапевтическим средствам от COVID-19, включив в него условную рекомендацию против использования ремдесивира на основании результатов, полученных от ВОЗ. Суд солидарности.[131][132]
Побочные эффекты
Наиболее частыми побочными эффектами у людей, получавших ремдесивир, были: нарушение дыхания и кровь биомаркеры из орган обесценение, в том числе низкий альбумин, низкий калий, низкий уровень эритроцитов, низкое количество тромбоцитов, и повышенный билирубин (желтуха).[91] Другие зарегистрированные побочные эффекты включают: желудочно-кишечные расстройства, повышенный трансаминаза уровни в крови (ферменты печени ), настой реакции сайта, и отклонения электрокардиограммы.[133] Ремдесивир может вызвать связанный с инфузией реакции, включая низкое кровяное давление, тошноту, рвоту, потоотделение или дрожь.[134]
Казиривимаб / имдевимаб
21 ноября 2020 года США Управление по контролю за продуктами и лекарствами (FDA) выдало разрешение на использование в чрезвычайных ситуациях (EUA) для казиривимаб и имдевимаб назначать вместе для лечения COVID-19 легкой и средней степени тяжести у людей в возрасте двенадцати лет и старше с массой тела не менее 40 килограммов (88 фунтов) с положительными результатами прямого тестирования на вирус SARS-CoV-2 и имеющих высокий риск прогрессирует до тяжелой формы COVID-19.[135] Сюда входят лица в возрасте 65 лет и старше или лица, имеющие определенные хронические заболевания.[135]
Стратегии
Перепрофилирование одобренных препаратов
Репозиционирование препарата (также называемое перепрофилированием лекарств) - исследование существующих лекарств для новых терапевтических целей - это одно из направлений научных исследований, используемых для разработки безопасных и эффективных методов лечения COVID ‑ 19.[19][136] Несколько существующих противовирусных препаратов, ранее разработанных или используемых для лечения Острое респираторное заболевание (SARS), Ближневосточный респираторный синдром (MERS), ВИЧ / СПИД, и малярия, исследуются как препараты для лечения COVID ‑ 19, а некоторые из них уже проходят клинические испытания.[137]
Во время вспышки COVID ‑ 19 перепрофилирование лекарств является клинические исследования процесс быстрого скрининга и определения безопасности и эффективности существующих лекарств, уже одобренных для лечения других заболеваний, которые будут использоваться для людей с инфекцией COVID ‑ 19.[16][19][138] В обычном процессе разработки лекарств[21] Подтверждение перепрофилирования для лечения нового заболевания потребует многих лет клинических исследований, включая основные клинические испытания фазы III - о лекарственном препарате-кандидате, чтобы гарантировать его безопасность и эффективность специально для лечения инфекции COVID ‑ 19.[16][138] В условиях чрезвычайной ситуации, вызванной растущей пандемией COVID ‑ 19, в марте 2020 года ускорился процесс перепрофилирования лекарств для лечения людей, госпитализированных с COVID ‑ 19.[5][16][19]
Клинические испытания с использованием перепрофилированных, в целом безопасных существующих препаратов для госпитализированных людей с COVID ‑ 19 могут занять меньше времени и иметь более низкие общие затраты на получение конечных точек, подтверждающих безопасность (отсутствие серьезных побочные эффекты ) и постинфекционной эффективности, а также может быстро получить доступ к существующим лекарствам каналы поставок для производства и распространения по всему миру.[5][16][139] В рамках международных усилий по использованию этих преимуществ ВОЗ в середине марта 2020 г. начала ускоренную международную Испытания фазы II – III по четырем многообещающим вариантам лечения - испытание СОЛИДАРНОСТЬ[5][140][141] - с множеством других препаратов, которые могут быть использованы в различных стратегиях лечения заболеваний, например, противовоспалительные, кортикостероид, антитело, невосприимчивый, и фактор роста методы лечения, среди прочего, переходят в фазу II или III испытаний в течение 2020 года.[1][16][17][138][142]
В марте США Центры по контролю и профилактике заболеваний (CDC) выпустили рекомендации врача относительно ремдесивира для людей, госпитализированных с пневмония вызванных COVID ‑ 19: «Хотя клинические испытания имеют решающее значение для установления безопасности и эффективности этого препарата, клиницисты, не имеющие доступа к клиническим испытаниям, могут запросить ремдесивир для сострадательное использование через производителя для пациентов с клинической пневмонией ».[89]
Кандидаты в лекарства от COVID ‑ 19 на ранней стадии
Предварительные клинические исследования: исследования фазы II
Испытания фазы I тестируют в первую очередь безопасность и предварительное дозирование у нескольких десятков здоровых субъектов, в то время как испытания фазы II - после успеха в фазе I - оценивают терапевтическую эффективность против болезни COVID ‑ 19 при возрастающих уровнях доз (эффективность основана на биомаркеры ), внимательно оценивая возможные побочные эффекты кандидатуры терапии (или комбинированной терапии), как правило, у сотен людей.[143] Обычный дизайн исследования возможных препаратов от COVID ‑ 19 фазы II: рандомизированный, плацебо -управляемый, ослепленный, и проводились в нескольких местах, при этом определялись более точные, эффективные дозы и контролировались побочные эффекты.[143]
Вероятность перехода испытаний фазы II к фазе III (для всех болезней) составляет около 31%, а конкретно для инфекционных болезней - около 43%.[59] В зависимости от продолжительности (дольше - дороже) - обычно от нескольких месяцев до двух лет.[143] - средние затраты на исследование фазы II 57 долларов США млн (долларов 2013 г., включая доклинические затраты и затраты на Фазу I).[64] Успешное завершение исследования фазы II не дает надежного прогноза, что лекарство-кандидат будет успешным в исследовании фазы III.[55]
В исследованиях фазы III COVID ‑ 19 участвуют от сотен до тысяч госпитализированных участников, и они проверяют эффективность лечения для уменьшения последствий болезни, одновременно отслеживая побочные эффекты при оптимальной дозе, например, в многонациональных исследованиях Solidarity и Discovery.[4][5][21]
13 октября 2020 года в фазе II-III испытания кандидата на лечение с использованием моноклональное антитело технология, разработанная AbCellera Biologics и Эли Лилли, бамланивимаб (LY-CoV555) был приостановлен из соображений безопасности.[144][145][146]
26 октября 2020 года Eli Lilly объявила, что клиническое испытание ACTIV-3 Национального института здравоохранения (NIH) по оценке его моноклонального антитела, бамланивимаба (LYCoV555), показало, что бамланивимаб неэффективен для лечения людей, госпитализированных с COVID-19.[147] В других исследованиях, включая исследование NIH ACTIV-2 и собственное исследование BLAZE-1, будет продолжена оценка бамланивимаба.[147]
Согласно источнику, сообщающему о ранних клинических испытаниях потенциальных постинфекционных методов лечения COVID ‑ 19, их было более 230 Испытания фазы II в процессе или планируется начать к октябрю 2020 года.[3]
Разрешение на использование в экстренных случаях
7 октября 2020 года Eli Lilly and Company подали запрос на Разрешение на использование в чрезвычайных ситуациях (EUA) в США Управление по контролю за продуктами и лекарствами (FDA) для монотерапии LY-CoV555 у людей с высоким риском, которым был поставлен диагноз COVID-19 от легкой до умеренной степени.[148] Бамланивимаб (LY-CoV555) представляет собой нейтрализующее моноклональное антитело (mAb) IgG1, направленное против шипового белка SARS-CoV-2.[148] Он проходит испытания в испытаниях BLAZE-1, BLAZE-2 и ACTIV-3.[148]
9 ноября 2020 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США выдало разрешение на экстренное использование исследуемой терапии моноклональными антителами. бамланивимаб для лечения COVID-19 легкой и средней степени тяжести.[149] Бамланивимаб разрешен для людей с положительными результатами прямого тестирования на вирус SARS-CoV-2 в возрасте от двенадцати лет и старше, весом не менее 40 кг (88 фунтов) и имеющих высокий риск развития тяжелой формы COVID-19 или госпитализации. .[149] Сюда входят лица в возрасте 65 лет и старше или лица с определенными хроническими заболеваниями.[149]
Категории потенциальных терапевтических средств против COVID-19
Согласно одному источнику (по состоянию на август 2020 года), различные категории доклинических или ранних клинических исследований для разработки терапевтических кандидатов COVID ‑ 19 включали:[1]
- антитела (81 кандидат)
- противовирусные препараты (31 кандидат)
- соединения на основе клеток (34 кандидата)
- РНК соединения на основе (6 кандидатов)
- сканирующие соединения для перепрофилирования (18 кандидатов)
- различные другие категории терапии, такие как противовоспалительное, противомалярийный, интерферон, на белковой основе, антибиотики, и рецептор-модулирующий соединений, среди прочего, всего около 511 соединений в стадии разработки в августе.[2]
Ингибиторы протеазы

В марте 2020 года основные протеаза (3CLpro ) вируса SARS-CoV-2 был идентифицирован как мишень для постинфекционных препаратов. В фермент необходим для обработки полипротеин, связанный с репликацией. Чтобы найти фермент, ученые использовали геном опубликовано китайскими исследователями в январе 2020 года для выделения основной протеазы.[150] Ингибиторы протеазы одобрен для лечения вирусы иммунодефицита человека (ВИЧ) - лопинавир и ритонавир - имеют предварительные доказательства активности против коронавирусы, SARS и MERS.[5][16] В качестве потенциальной комбинированной терапии они используются вместе в двух частях Фазы III глобального проекта Солидарности 2020 года по COVID ‑ 19.[5][4] Предварительное исследование комбинации лопинавира и ритонавира в Китае не обнаружило эффекта у людей, госпитализированных с COVID ‑ 19.[151] Новые ингибиторы протеазы, которые специально нацелены на протеазу 3CLpro, исследуются и разрабатываются в лаборатории, например: CLpro-1, GC376, и Рупинтривир.[152][153][154]
Доклинические исследования
Термин «доклинические исследования» определяется лабораторными исследованиями. in vitro и in vivo, что указывает на начальную стадию разработки профилактической вакцины, противовирусных или других постинфекционных методов лечения,[10] например, эксперименты по определению эффективные дозы и токсичность у животных, прежде чем соединение-кандидат будет предложено для оценки безопасности и эффективности у людей.[155] Завершение доклинической стадии разработки лекарств, а затем их тестирование на безопасность и эффективность на достаточном количестве людей, инфицированных COVID ‑ 19 (от сотен до тысяч в разных странах), для COVID ‑ 19, вероятно, займет 1-2 года. терапии, согласно нескольким отчетам в начале 2020 года.[12][156][157][158] Несмотря на эти усилия, вероятность того, что кандидаты в лекарственные препараты будут в конечном итоге одобрены регулирующими органами, на протяжении всего процесса разработки лекарств для лечения инфекционные заболевания составляет всего 19%.[59]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты «Отслеживание вакцины и лечения COVID-19 (выберите вкладку вакцины или лечения, примените фильтры для просмотра выбранных данных)». Институт Милкена. 2020-11-03. Получено 2020-11-03. Сложить резюме.
- ^ а б c d е ж грамм «Продукты Biopharma в разработке для COVID-19». BioWorld. 2020-11-02. Получено 2020-11-03.
- ^ а б c «Трекер вакцины и терапии COVID-19». BioRender. 2020-10-30. Получено 2020-11-03.
- ^ а б c d е Mullard A (апрель 2020 г.). «Торрент залит: наркопровод COVID-19». Ланцет. 395 (10232): 1245–1246. Дои:10.1016 / S0140-6736 (20) 30894-1. ЧВК 7162641. PMID 32305088.
- ^ а б c d е ж грамм час я j k л м п о п q р s т Купфершмидт К., Коэн Дж. (22 марта 2020 г.). «ВОЗ запускает глобальное исследование четырех самых многообещающих препаратов для лечения коронавируса». Научный журнал. Дои:10.1126 / science.abb8497. Получено 27 марта 2020.
- ^ «Первый нормативный семинар по COVID-19 способствует глобальному сотрудничеству в разработке вакцин». Европейское агентство по лекарственным средствам. 18 марта 2020 г.. Получено 21 марта 2020.
- ^ а б «Обновление коронавируса (COVID-19): FDA продолжает способствовать разработке методов лечения» (Пресс-релиз). НАС. Управление по контролю за продуктами и лекарствами (FDA). 19 марта 2020 г.. Получено 21 марта 2020.
- ^ «Китай одобрил первый противовирусный препарат против коронавируса Covid-19». Арена клинических испытаний. 18 февраля 2020 г.. Получено 21 марта 2020.
- ^ «Китайская вакцина одобрена для тестирования на людях в вирусном эпицентре». Новости Bloomberg. 19 марта 2020 г.. Получено 21 марта 2020.
- ^ а б c d Дхама К., Шарун К., Тивари Р., Дадар М., Малик Ю.С., Сингх К.П., Чайкумпа В. (март 2020 г.). «COVID-19, новая коронавирусная инфекция: достижения и перспективы в разработке и разработке вакцин, иммунотерапевтических и терапевтических средств». Человеческие вакцины и иммунотерапевтические препараты. 16 (6): 1232–1238. Дои:10.1080/21645515.2020.1735227. ЧВК 7103671. PMID 32186952.
- ^ а б Чжан Л., Лю И (май 2020 г.). «Возможные меры по борьбе с новым коронавирусом в Китае: систематический обзор». Журнал медицинской вирусологии. 92 (5): 479–490. Дои:10.1002 / jmv.25707. ЧВК 7166986. PMID 32052466.
- ^ а б Fox M (19 марта 2020 г.). «Производители лекарств спешат разработать иммунотерапию от Covid-19. Будут ли они готовы вовремя?». Стат. Получено 21 марта 2020.
- ^ Чан М (19 марта 2020 г.). «Китайские военные ученые приказали выиграть глобальную гонку по разработке вакцины от коронавируса». Южно-Китайская утренняя почта. Получено 22 марта 2020.
- ^ а б c d е Коалиция клинических исследований COVID-19 (апрель 2020 г.). «Глобальная коалиция для ускорения клинических исследований COVID-19 в условиях ограниченных ресурсов». Ланцет. 395 (10233): 1322–1325. Дои:10.1016 / с0140-6736 (20) 30798-4. ЧВК 7270833. PMID 32247324.
- ^ а б c Магуайр Б.Дж., Герен П.Дж. (2 апреля 2020 г.). «Живой протокол систематического обзора регистраций клинических испытаний COVID-19». Wellcome Open Research. 5: 60. Дои:10.12688 / wellcomeopenres.15821.1. ISSN 2398-502X. ЧВК 7141164. PMID 32292826.
- ^ а б c d е ж грамм час Ли Джи, Де Клерк Э. (март 2020 г.). «Варианты лечения нового коронавируса 2019 г. (2019-nCoV)». Обзоры природы. Открытие наркотиков. 19 (3): 149–150. Дои:10.1038 / d41573-020-00016-0. PMID 32127666.
- ^ а б c Ли Джи, Де Клерк Э. (март 2020 г.). «Варианты лечения нового коронавируса 2019 г. (2019-nCoV)». Обзоры природы. Открытие наркотиков. 19 (3): 149–150. Дои:10.1038 / d41573-020-00016-0. PMID 32127666.
- ^ а б Донг Л., Ху С., Гао Дж. (29 февраля 2020 г.). «Открытие лекарств для лечения коронавирусной болезни 2019 (COVID-19)». Открытия лекарств и терапия. 14 (1): 58–60. Дои:10.5582 / ddt.2020.01012. PMID 32147628.
- ^ а б c d Харрисон С (февраль 2020 г.). «Коронавирус ускоряет перепрофилирование лекарств». Природа Биотехнологии. 38 (4): 379–381. Дои:10.1038 / d41587-020-00003-1. PMID 32205870.
- ^ а б c Ченг МП, Ли ТК, Тан Д.Х., Мурти С. (26 марта 2020 г.). «Создание доказательств рандомизированного исследования для оптимизации лечения пандемии COVID-19» (PDF). Журнал Канадской медицинской ассоциации. 192 (15): E405 – E407. Дои:10.1503 / cmaj.200438. ISSN 0820-3946. ЧВК 7162442. PMID 32336678. Получено 27 марта 2020.
- ^ а б c d е ж грамм час я j k л м п о п «Процесс разработки лекарств». НАС. Управление по контролю за продуктами и лекарствами (FDA). 4 января 2018 г.. Получено 21 марта 2020.
- ^ «Призыв объединить исследовательские ресурсы в крупные многоцентровые клинические испытания с несколькими группами для получения надежных доказательств лечения COVID-19». Европейское агентство по лекарственным средствам. 19 марта 2020 г.. Получено 21 марта 2020.
- ^ «Разработка вакцины против COVID-19 (обновите URL, чтобы обновить)». Центр вакцин Лондонской школы гигиены и тропической медицины. 2020-11-02. Получено 2020-11-03.
- ^ а б c d е ж грамм час я j k л м п о Стровел Дж., Ситтампалам С., Куссенс Н.П., Хьюз М., Инглезе Дж., Курц А. и др. (1 июля 2016 г.). «Руководство по открытию и разработке первых лекарств: для академических исследователей, сотрудников и начинающих компаний». Руководство по анализу. Eli Lilly & Company и Национальный центр развития переводческих наук. PMID 22553881.
- ^ а б c d е ж грамм Тейлор Д. (2015). «Фармацевтическая промышленность и будущее разработки лекарств». Проблемы экологической науки и технологий. Королевское химическое общество: 1–33. Дои:10.1039/9781782622345-00001. ISBN 978-1-78262-189-8.
- ^ а б «Тестирование вакцины и процесс утверждения». Центры США по контролю и профилактике заболеваний. 1 мая 2014 г.. Получено 21 марта 2020.
- ^ Кесслер Д.А., Фейден К.Л. (март 1995 г.). «Ускоренная оценка жизненно важных лекарств». Scientific American. 272 (3): 48–54. Bibcode:1995SciAm.272c..48K. Дои:10.1038 / scientificamerican0395-48. PMID 7871409.
- ^ «Программа ускорения лечения коронавируса (CTAP)». НАС. Управление по контролю за продуктами и лекарствами (FDA). 2020-04-20. Получено 2020-04-27.
- ^ Джон Рид Блэквелл и Майкл Марц. «Ричмондский стартап получил федеральный контракт на сумму 354 миллиона долларов на производство ингредиентов для лекарств от COVID-19» (видео). Ричмонд Таймс-Диспетч. Получено 21 мая 2020.CS1 maint: использует параметр авторов (связь)
- ^ а б c «Процесс утверждения вакцинного продукта». НАС. Управление по контролю за продуктами и лекарствами (FDA). 30 января 2018 г.. Получено 21 марта 2020.
- ^ «Об инициативе в области инновационных лекарственных средств». Европейская инициатива в области инновационных лекарственных средств. 2020 г.. Получено 24 января 2020.
- ^ «Инициатива критического пути». НАС. Управление по контролю за продуктами и лекарствами (FDA). 23 апреля 2018 г.. Получено 24 января 2020.
- ^ «Терапия прорыва». НАС. Управление по контролю за продуктами и лекарствами (FDA). 4 января 2018 г.. Получено 24 января 2020.
- ^ «Диагностический трубопровод SARS-CoV-2». Фонд инновационной новой диагностики. 2020 г.. Получено 4 апреля 2020.
- ^ «CEPI приветствует финансирование правительства Великобритании и подчеркивает необходимость в 2 миллиарда долларов для разработки вакцины против COVID-19». Коалиция за инновации в обеспечении готовности к эпидемиям, Осло, Норвегия. 6 марта 2020 г.. Получено 23 марта 2020.
- ^ а б Келланд К. (10 марта 2020 г.). «Группа реагирования на эпидемии увеличивает финансирование вакцины против коронавируса до 23,7 миллиона долларов». Рейтер. Получено 21 марта 2020.
- ^ «Правительство Канады финансирует 49 дополнительных исследовательских проектов COVID-19 - Подробная информация о финансируемых проектах». Правительство Канады. 23 марта 2020 г.. Получено 23 марта 2020.
- ^ а б Абеди М (23 марта 2020 г.). «Канада потратит 192 миллиона долларов на разработку вакцины против COVID-19». Глобальные новости. Получено 24 марта 2020.
- ^ О'Брайен С. (31 марта 2020 г.). «Наблюдение за вакцинами: это усилия, предпринимаемые во всем мире». Новости CTV. Получено 1 апреля 2020.
- ^ «Фонд Гейтса усиливает свою приверженность борьбе с COVID-19, призывает к международному сотрудничеству». Фонд Билла и Мелинды Гейтс. 2020-04-15. Получено 2020-04-27.
- ^ а б Шенкленд, Стивен (23 марта 2020 г.). «Шестнадцать суперкомпьютеров борются с лечением коронавируса в США». CNET. ViacomCBS. Получено 27 апреля 2020.
- ^ а б «Консорциум высокопроизводительных вычислений COVID-19». Консорциум высокопроизводительных вычислений COVID-19. 2020 г.. Получено 2020-04-27.
- ^ «C3.ai, Microsoft и ведущие университеты запускают институт цифровой трансформации C3.ai». C3.ai. 2020-03-26. Получено 27 апреля 2020.
- ^ Броуд, Уильям (26 марта 2020 г.). «ИИ против коронавируса». Нью-Йорк Таймс. Компания New York Times. Получено 27 апреля 2020.
- ^ Брукхейсен, Нильс (3 марта 2020 г.). «Помогите вылечить коронавирус с помощью оставшейся вычислительной мощности вашего ПК». Оборудование Тома. Получено 12 марта 2020.
- ^ Боуман, Грег (27 февраля 2020 г.). «Folding @ home начинает борьбу с COVID-19/2019-nCoV». Складной @ дома. Получено 12 марта 2020.
- ^ «Folding @ home превращает свою массовую краудсорсинговую компьютерную сеть против COVID-19». 16 марта 2020.
- ^ "Rosetta @ home сплачивает легион компьютеров против коронавируса". HPCwire. 2020-03-24. Получено 2020-11-04.
- ^ «OpenPandemics - COVID-19». IBM. 2020 г.. Получено 18 мая 2020.
- ^ Kaiser J A (1 апреля 2018 г.). «Обновление FDA (2018 г.) - Новый процесс утверждения лекарственных средств FDA: приложения для разработки и премаркета». Разработка и доставка лекарств. Получено 25 марта 2020.
- ^ «Адаптивные дизайны для клинических испытаний лекарственных средств и биопрепаратов: руководство для промышленности» (PDF). НАС. Управление по контролю за продуктами и лекарствами (FDA). 1 ноября 2019 г.. Получено 3 апреля 2020.
- ^ а б Pallmann P, Bedding AW, Choodari-Oskooei B, Dimairo M, Flight L, Hampson LV и др. (Февраль 2018). «Адаптивные дизайны в клинических испытаниях: зачем их использовать, как проводить и сообщать о них». BMC Медицина. 16 (1): 29. Дои:10.1186 / s12916-018-1017-7. ЧВК 5830330. PMID 29490655.
- ^ а б c d е «Запуск европейского клинического испытания против COVID-19». INSERM. 22 марта 2020 г.. Получено 5 апреля 2020.
Большая сила этого испытания - его «адаптивный» характер. Это означает, что от неэффективных экспериментальных методов лечения можно очень быстро отказаться и заменить их другими молекулами, полученными в результате исследовательских усилий. Таким образом, мы сможем вносить изменения в режиме реального времени в соответствии с последними научными данными, чтобы найти лучшее лечение для наших пациентов.
- ^ Коток А (19 марта 2020 г.). «ВОЗ начинает испытания терапии Covid-19». Новости технологий: наука и предпринимательство. Получено 7 апреля 2020.
- ^ а б c d Ван Норман Г.А. (июнь 2019 г.). «Фаза II испытаний в разработке лекарств и адаптивном дизайне испытаний». JACC. Основы переводческой науки. 4 (3): 428–437. Дои:10.1016 / j.jacbts.2019.02.005. ЧВК 6609997. PMID 31312766.
- ^ Сато А., Шимура М., Гошо М. (апрель 2018 г.). «Практические характеристики адаптивного дизайна во 2-й и 3-й фазах клинических испытаний». Журнал клинической фармации и терапии. 43 (2): 170–180. Дои:10.1111 / jcpt.12617. PMID 28850685. S2CID 3704071.
- ^ Fogel DB (сентябрь 2018 г.). «Факторы, связанные с клиническими испытаниями, которые потерпели неудачу, и возможности повышения вероятности успеха: обзор». Сообщения о современных клинических испытаниях. 11: 156–164. Дои:10.1016 / j.conctc.2018.08.001. ЧВК 6092479. PMID 30112460.
- ^ «Затраты на НИОКР растут». Медицинский маркетинг и СМИ. 38 (6): 14. 1 июня 2003 г. Архивировано с оригинал 18 октября 2016 г.
- ^ а б c d е «Показатели успешности клинических разработок: 2006–2015 гг.» (PDF). БИО отраслевой анализ. Июнь 2016 г.
- ^ Ван И (2012). «Извлечение знаний из неудачных программ развития». Фармацевтическая медицина. 26 (2): 91–96. Дои:10.1007 / BF03256897. S2CID 17171991.
- ^ Пол С.М., Мителка Д.С., Данвидди К.Т., Персингер С.К., Мунос Б.Н., Линдборг С.Р., Шахт А.Л. (март 2010 г.). «Как повысить продуктивность НИОКР: великая задача фармацевтической отрасли». Обзоры природы. Открытие наркотиков. 9 (3): 203–214. Дои:10.1038 / nrd3078. PMID 20168317. S2CID 1299234.
- ^ Прасад V, Майланкоди С. (ноябрь 2017 г.). «Затраты на исследования и разработки для вывода на рынок одного лекарства от рака и доходы после утверждения». JAMA Internal Medicine. 177 (11): 1569–1575. Дои:10.1001 / jamainternmed.2017.3601. ЧВК 5710275. PMID 28892524.
- ^ а б c d Мур Т.Дж., Чжан Х., Андерсон Г., Александр Г.К. (ноябрь 2018 г.). «Ориентировочная стоимость основных испытаний новых терапевтических агентов, утвержденных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, 2015–2016 гг.». JAMA Internal Medicine. 178 (11): 1451–1457. Дои:10.1001 / jamainternmed.2018.3931. ЧВК 6248200. PMID 30264133.
- ^ а б c ДиМази Я., Грабовски Х. Г., Хансен Р. В. (май 2016 г.). «Инновации в фармацевтической отрасли: новые оценки затрат на НИОКР». Журнал экономики здравоохранения. 47: 20–33. Дои:10.1016 / j.jhealeco.2016.01.012. HDL:10161/12742. PMID 26928437.
- ^ Серткая А., Вонг Х. Х., Джессап А., Белече Т. (апрель 2016 г.). «Ключевые факторы затрат на фармацевтические клинические испытания в США». Клинические испытания. 13 (2): 117–26. Дои:10.1177/1740774515625964. PMID 26908540. S2CID 24308679.
- ^ Herper M (11 августа 2013 г.). «Стоимость создания нового препарата сейчас составляет 5 миллиардов долларов, что подтолкнет Big Pharma к изменениям». Forbes. Получено 17 июля 2016.
- ^ Максмен А (август 2016 г.). «Разрушая миф о миллиардных долларах: как сократить расходы на разработку лекарств». Природа. 536 (7617): 388–90. Bibcode:2016Натура.536..388М. Дои:10.1038 / 536388a. PMID 27558048.
- ^ «Ответ CEPI на COVID-19». Коалиция за инновации в обеспечении готовности к эпидемиям, Осло, Норвегия. 1 марта 2020 г.. Получено 25 марта 2020.
- ^ «Ускоритель лечения COVID-19: Фонд Билла и Мелинды Гейтс, Wellcome и Mastercard запускают инициативу по ускорению разработки и доступа к методам лечения COVID-19». Фонд Билла и Мелинды Гейтс. 10 марта 2020 г.. Получено 4 апреля 2020.
- ^ а б Торлунд, Кристиан; Дрон, Луи; Парк, Джей; Сюй, Грейс; Форрест, Джейми I; Миллс, Эдвард Дж (2020-04-24). «Панель мониторинга клинических испытаний COVID-19 в режиме реального времени». Цифровое здоровье Lancet. 2 (6): e286 – e287. Дои:10.1016 / S2589-7500 (20) 30086-8. ЧВК 7195288. PMID 32363333.
- ^ а б «Каковы этапы клинических испытаний?». Американское онкологическое общество. 2020 г.. Получено 4 апреля 2020.
- ^ "'Клиническое исследование солидарности для лечения COVID-19 ». Всемирная организация здоровья. 2020-04-27. Получено 2020-05-01.
- ^ «Вступительное слово Генерального директора ВОЗ на брифинге для СМИ по COVID-19». Всемирная организация здоровья. 2020-05-25. Получено 2020-05-27.
- ^ Мария Ченг, Джейми Китен (25 мая 2020 г.). «ВОЗ приостанавливает испытания коронавируса гидроксихлорохина из соображений безопасности». Глобальные новости. Ассошиэйтед Пресс. Получено 2020-05-27.CS1 maint: использует параметр авторов (связь)
- ^ Гош, Абантика; Маскареньяс, Анурадха (4 июня 2020 г.). «ВОЗ возобновляет испытание HCQ после того, как Lancet обеспокоена бумагой, которая его испортила». indianexpress.com. Индийский экспресс.
Когда с ними связались, Сумья Сваминатан, главный научный сотрудник ВОЗ, сказал The Indian Express: «Наша комиссия по мониторингу безопасности данных рассмотрела данные о смертности в« Солидарности »... У них не было проблем, связанных со смертностью между HCQ и стандартом лечения. Следовательно, мы решили возобновить судебное разбирательство.
- ^ а б c Томас Мюльер (17.06.2020). «Гидроксихлорохин остановлен в исследованиях COVID-19, спонсируемых ВОЗ». Bloomberg. Получено 2020-06-17.
- ^ а б Branswell H (18 марта 2020 г.). «ВОЗ запускает международное испытание, чтобы начать поиск лекарств от коронавируса». СТАТ. Получено 28 марта 2020.
- ^ «Вступительное слово Генерального директора ВОЗ на брифинге для СМИ по COVID-19». Организация Объединенных Наций, Всемирная организация здравоохранения. 27 марта 2020 г.. Получено 28 марта 2020.
- ^ «Испытание RECOVERY развернуто по всей Великобритании». Департамент здравоохранения Наффилда. 2020-04-03. Получено 2020-04-18.
- ^ Бозли, Сара (2020-04-17). «Коронавирус: в Великобритании начинается крупнейшее в мире испытание препарата для лечения Covid-19». Хранитель. ISSN 0261-3077. Получено 2020-04-18.
- ^ "ВОССТАНОВЛЕНИЕ". Департамент здравоохранения Наффилда. 2020-04-03. Получено 2020-04-18.
- ^ а б c «Отсутствие клинической пользы от применения гидроксихлорохина у госпитализированных пациентов с COVID-19». Испытание на выздоровление, Департамент здравоохранения Наффилда, Оксфордский университет, Великобритания. 5 июнь 2020. Получено 7 июн 2020.
- ^ «Недорогой дексаметазон снижает смертность до одной трети госпитализированных пациентов с тяжелыми респираторными осложнениями COVID-19» (PDF). 2020-06-16. Получено 2020-06-21.
- ^ Робертс, Мишель (16 июня 2020 г.). «Коронавирус: дексаметазон оказался первым лекарством, спасающим жизнь». BBC News Online.
- ^ а б c Номер клинического исследования NCT04280705 для "Испытания адаптивного лечения COVID-19 (ACTT)" в ClinicalTrials.gov
- ^ а б «Статус рассмотрения Ремдесивир». Drugs.com. 24 марта 2020 г.. Получено 6 апреля 2020.
- ^ Pagliarulo N (5 марта 2020 г.). «Более пристальный взгляд на препарат от Эболы, который стал главной надеждой на лечение коронавируса». BioPharma Dive. Получено 19 марта 2020.
Сейчас есть только одно лекарство, которое, как мы думаем, может иметь реальную эффективность. И это ремдесивир », - сказал Брюс Эйлвард, старший советник и международный лидер совместной миссии Всемирной организации здравоохранения в Китае.
- ^ «Экстренный доступ к ремдесивиру вне клинических испытаний». Gilead Sciences. 1 апреля 2020 г.. Получено 7 апреля 2020.
- ^ а б c d е «Информация для врачей о вариантах лечения пациентов с COVID-19». Центры США по контролю и профилактике заболеваний. 21 марта 2020 г.. Получено 22 марта 2020.
- ^ «Клиническое исследование NIH показывает, что ремдесивир ускоряет выздоровление от распространенного COVID-19» (Пресс-релиз). Национальный институт аллергии и инфекционных заболеваний США. 2020-04-29. Получено 2020-04-29.
- ^ а б Ван, Йемин; Чжан, Динъюй; Ду, Гуаньхуа; Ду, Ронгхуэй; Чжао, Цзяньпин; Джин, Ян; Фу, Шоучжи; Гао, Линь; Ченг, Чжэньшунь; Лу, Киаофа; Ху, И (2020-04-29). «Ремдесивир у взрослых с тяжелой формой COVID-19: рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование». Ланцет. 395 (10236): 1569–1578. Дои:10.1016 / S0140-6736 (20) 31022-9. ЧВК 7190303. PMID 32423584.
- ^ а б c d е «Гидроксихлорохина сульфат». Drugs.com. 31 марта 2020 г.. Получено 5 апреля 2020.
- ^ а б c d «Хлорохинфосфат». Drugs.com. 31 марта 2020 г.. Получено 5 апреля 2020.
- ^ «Fujifilm объявляет о начале фазы III клинических испытаний противовирусного препарата от гриппа Avigan (фавипиравир) против COVID-19 в Японии и обязуется увеличивать производство». Drugs.com через Fujifilm Toyama Chemical Co., Ltd. 31 марта 2020 г.. Получено 6 апреля 2020.
- ^ Грегори А. (18 марта 2020 г.). «Коронавирус: японский противовирусный препарат, эффективный при лечении пациентов, - заявил китайский чиновник». Независимый. Получено 19 марта 2020.
- ^ а б «Ритонавир». Drugs.com. 2020 г.. Получено 6 апреля 2020.
- ^ «Кевзара». Drugs.com. 7 марта 2019 г.. Получено 6 апреля 2020.
- ^ Staines R (31 марта 2020 г.). «Санофи начинает судебное разбирательство по делу Кевзара в отношении осложнений COVID-19». ФармаФорум. Получено 6 апреля 2020.
- ^ McGrath J (2 апреля 2020 г.). «Все вакцины и препараты против COVID-19 в настоящее время проходят клинические испытания». Цифровые тенденции. Получено 6 апреля 2020.
- ^ «Тоцилизумаб». Drugs.com. 7 июн 2019. Получено 6 апреля 2020.
- ^ Slater H (26 марта 2020 г.). «FDA одобряет III фазу клинических испытаний тоцилизумаба при пневмонии COVID-19». Онкологическая сеть, MJH Life Sciences. Получено 28 марта 2020.
- ^ «Рош представляет обновленную информацию об исследовании фазы III COVACTA препарата Actemra / RoActemra у госпитализированных пациентов с тяжелой пневмонией, связанной с COVID-19». Хоффманн-Ла Рош. 29 июля 2020 г.. Получено 2020-08-18.
- ^ Номер клинического исследования NCT04351152 для «Фаза 3 исследования по оценке эффективности и безопасности лензилумаба у госпитализированных пациентов с пневмонией COVID-19» в ClinicalTrials.gov
- ^ «Дапаглифлозин: информация о препарате MedlinePlus». medlineplus.gov. 2020-04-20. Получено 2020-04-27.
- ^ Номер клинического исследования NCT04350593 на «Дапаглифлозин при респираторной недостаточности у пациентов с COVID-19 (DARE-19)» в ClinicalTrials.gov
- ^ Номер клинического исследования NCT04317040 для «CD24Fc как неантивирусный иммуномодулятор при лечении COVID-19 (SAC-COVID)» в ClinicalTrials.gov
- ^ Hinton DM (28 марта 2020 г.). «Запрос на выдачу разрешения на экстренное использование хлорохинфосфата или гидроксихлорохинсульфата, поставляемых из стратегических национальных запасов для лечения коронавирусной болезни 2019 года» (PDF). НАС. Управление по контролю за продуктами и лекарствами (FDA). Получено 30 марта 2020.
- ^ «Информационный бюллетень для пациентов и родителей / лиц, осуществляющих уход за разрешением на экстренное использование (EUA) хлорохинфосфата для лечения COVID-19 у некоторых госпитализированных пациентов» (PDF). FDA.
- ^ Беркли Лавлейс-младший (15 июня 2020 г.). «FDA отменяет экстренное применение гидроксихлорохина». CNBC.
- ^ «Пересмотренные рекомендации по использованию гидроксихлорохина (HCQ) в качестве профилактики инфекции SARS-CoV-2 (в замене предыдущей рекомендации от 23 марта 2020 г.)» (PDF). icmr.gov.in. Индийский совет медицинских исследований. 22 мая 2020. В архиве (PDF) из оригинала 23 мая 2020 г.. Получено 3 июля 2020.
- ^ Гудман, Джек; Джайлз, Кристофер (1 июля 2020 г.). «Коронавирус и гидроксихлорохин: что мы знаем?». bbc.com. BBC. В архиве из оригинала на 3 июля 2020 г.. Получено 3 июля 2020.
- ^ «Гидроксихлорохин не приносит пользы взрослым, госпитализированным с COVID-19». Национальные институты здоровья (НАЦИОНАЛЬНЫЕ ИНСТИТУТЫ ЗДРАВООХРАНЕНИЯ США) (Пресс-релиз). 9 ноября 2020 г.. Получено 9 ноября 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ Self WH, Semler MW, Leither LM, Casey JD, Angus DC, Brower RG и др. (Ноябрь 2020 г.). «Влияние гидроксихлорохина на клинический статус через 14 дней у госпитализированных пациентов с COVID-19». JAMA. Дои:10.1001 / jama.2020.22240. PMID 33165621.
- ^ Сун-Сун К. (13.02.2020). «Врачи разрабатывают рекомендации по лечению коронавируса». Корея Биомедицинский обзор. Получено 2020-03-18.
- ^ "Доза плаквенила (гидроксихлорохина сульфата), показания, побочные эффекты, взаимодействия ... от PDR.net". Справочник врача. Получено 2020-03-19.
- ^ Cortegiani A, Ingoglia G, Ippolito M, Giarratano A, Einav S (март 2020 г.). «Систематический обзор эффективности и безопасности хлорохина для лечения COVID-19». Журнал интенсивной терапии. 57: 279–283. Дои:10.1016 / j.jcrc.2020.03.005. ЧВК 7270792. PMID 32173110.
- ^ Яо X, Е Ф, Чжан М., Цуй Ц., Хуан Б., Ниу П и др. (Март 2020 г.). «Противовирусная активность in vitro и прогноз оптимальной схемы дозирования гидроксихлорохина для лечения тяжелого острого респираторного синдрома, вызванного коронавирусом 2 (SARS-CoV-2)». Клинические инфекционные болезни. 71 (15): 732–739. Дои:10.1093 / cid / ciaa237. ЧВК 7108130. PMID 32150618.
- ^ «Каковы перспективы лечения COVID-19?». Хранитель. 19 марта 2020.
- ^ Палка, Джо (21 апреля 2020 г.). «Группа NIH не рекомендует использовать комбинацию лекарств, продвигаемую Трампом, против COVID-19». энергетический ядерный реактор.
- ^ «Препарат от японского гриппа« явно эффективен »в лечении коронавируса, - заявляет Китай». 18 марта 2020.
- ^ «Коронавирус: японский противовирусный препарат, эффективный при лечении пациентов, - заявил китайский чиновник». Независимый.
- ^ «Какие препараты против Covid-19 работают лучше всего?». MIT Technology Review.
- ^ "Coronavirus, il Veneto sperimenta l'antivirale giapponese Favipiravir. Ma l'Aifa:" Ci sono scarse Evidenze Scientifiche su efficacia"". Il Fatto Quotidiano (на итальянском). 2020-03-22. Получено 2020-03-23.
- ^ "AIFA Precisa, uso favipiravir per COVID-19 non autorizzato in Europa e USA, scse scise Scientifiche sull'efficacia". aifa.gov.it (на итальянском). Получено 2020-03-23.
- ^ «Минздрав России одобрил первый препарат против COVID-19 Авифавир производства СП РФПИ и ХимРар». РФПИ. 30 мая 2020. Получено 31 мая 2020.
- ^ «Минздрав России одобрил антикоронавирусный препарат Авифавир». BNN Bloomberg. 31 мая 2020. Получено 31 мая 2020.
- ^ «В России через две недели планируется провести клинические испытания вакцины против коронавируса». Рейтер. 30 мая 2020. Получено 31 мая 2020.
- ^ «FabiFlu компании Glenmark, одобренный для лечения коронавируса в Индии, стоит 103 рупий за таблетку». Индия сегодня. 20 июня 2020 г.. Получено 30 июн 2020.
- ^ Уоррен Т.К., Джордан Р., Ло МК, Рэй А.С., Макман Р.Л., Соловьева В. и др. (Март 2016 г.). «Терапевтическая эффективность небольшой молекулы GS-5734 против вируса Эбола у макак-резусов». Природа. 531 (7594): 381–385. Bibcode:2016 Натур.531..381Вт. Дои:10.1038 / природа17180. ЧВК 5551389. PMID 26934220.
- ^ Ло МК, Джордан Р., Арви А., Судхамсу Дж., Шривастава-Ранджан П., Хотард А.Л. и др. (Март 2017 г.). «GS-5734 и его родительский аналог нуклеозидов ингибируют фило-, пневмо- и парамиксовирусы». Научные отчеты. 7: 43395. Bibcode:2017НатСР ... 743395Л. Дои:10.1038 / srep43395. ЧВК 5338263. PMID 28262699.
- ^ Всемирная организация здравоохранения (2020 г.). Терапия и COVID-19: руководство по жизни, 20 ноября 2020 г. Всемирная организация здоровья (ВОЗ) (Отчет). HDL:10665/336729. WHO / 2019-nCov / remdesivir / 2020.1.
- ^ Ламонтань Ф., Агорицас Т., Макдональд Х., Лео Ю.С., Диаз Дж., Агарвал А. и др. (Сентябрь 2020 г.). «Действующее руководство ВОЗ по лекарствам от covid-19». BMJ. 370: m3379. Дои:10.1136 / bmj.m3379. PMID 32887691. Сложить резюме.
- ^ Мехта Н., Мазер-Амиршахи М., Алькинди Н. (апрель 2020 г.). «Фармакотерапия при COVID-19; повествовательный обзор для поставщиков неотложной помощи». Американский журнал неотложной медицины. 38 (7): S0735-6757 (20) 30263-1. Дои:10.1016 / j.ajem.2020.04.035. ЧВК 7158837. PMID 32336586.
- ^ «Часто задаваемые вопросы о разрешении на экстренное использование Ремдесивира для некоторых госпитализированных пациентов с COVID ‐ 19» (PDF). НАС. Управление по контролю за продуктами и лекарствами (FDA). 1 мая 2020. Получено 1 мая 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ а б «Обновление по коронавирусу (COVID-19): FDA разрешает моноклональные антитела для лечения COVID-19». НАС. Управление по контролю за продуктами и лекарствами (FDA) (Пресс-релиз). 21 ноября 2020 г.. Получено 21 ноября 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ «Перепрофилирование наркотиков». Национальный центр развития переводческих наук (NCATS). 7 ноября 2017 г.. Получено 26 марта 2020.
- ^ Ли Джи, Де Клерк Э. (март 2020 г.). «Варианты лечения нового коронавируса 2019 г. (2019-nCoV)». Обзоры природы. Открытие наркотиков. 19 (3): 149–150. Дои:10.1038 / d41573-020-00016-0. PMID 32127666.
- ^ а б c Kruse RL (31 января 2020 г.). «Терапевтические стратегии в сценарии вспышки для лечения нового коронавируса, происходящего из Ухани, Китай». F1000 Исследования. 9: 72. Дои:10.12688 / f1000research.22211.1. ЧВК 7029759. PMID 32117569.
- ^ Митжа О, Clotet B (Март 2020 г.). «Использование противовирусных препаратов для снижения передачи COVID-19». Ланцет. Глобальное здоровье. Elsevier BV. 8 (5): e639 – e640. Дои:10.1016 / s2214-109x (20) 30114-5. ЧВК 7104000. PMID 32199468.
- ^ «Глава здравоохранения ООН объявляет о глобальном« испытании солидарности », чтобы дать толчок поиску лечения COVID-19». Организация Объединенных Наций - Новости. Всемирная организация здоровья. 18 марта 2020 г.. Получено 29 марта 2020.
- ^ Купфершмидт К., Коэн Дж. (Март 2020 г.). «Гонка за методами лечения COVID-19 ускоряется». Наука. 367 (6485): 1412–1413. Bibcode:2020Научный ... 367.1412K. Дои:10.1126 / science.367.6485.1412. PMID 32217705.
- ^ «Разработка препарата COVID-19: ландшафтный анализ терапии (таблица)» (PDF). Организация Объединенных Наций, Всемирная организация здравоохранения. 21 марта 2020 г.. Получено 29 марта 2020.
- ^ а б c «Процесс разработки препарата: клинические исследования». НАС. Управление по контролю за продуктами и лекарствами (FDA). 4 января 2018 г.. Получено 28 апреля 2020.
- ^ Райли Гриффин (13 октября 2020 г.). «Испытание антител против Covid от Eli Lilly приостановлено из соображений безопасности». Bloomberg. Получено 13 октября 2020.
- ^ Кэтрин Дж. Ву, Кэти Томас (13 октября 2020 г.). «Испытание антител Эли Лилли приостановлено из-за потенциальной проблемы безопасности». Нью-Йорк Таймс. Получено 26 октября 2020.CS1 maint: использует параметр авторов (связь)
- ^ «Заявление Lilly по поводу решения NIAID приостановить участие в клиническом испытании ACTIV-3». Эли Лилли и компания. 14 октября 2020 г.. Получено 26 октября 2020.
- ^ а б "Заявление Lilly относительно клинического испытания ACTIV-3 NIH". Эли Лилли и компания (Пресс-релиз). 26 октября 2020 г.. Получено 26 октября 2020.
- ^ а б c «Lilly предоставляет исчерпывающую информацию о ходе реализации программ нейтрализующих антител против SARS-CoV-2». Эли Лилли и компания. 7 октября 2020 г.. Получено 26 октября 2020.
- ^ а б c «Обновление коронавируса (COVID-19): FDA разрешает моноклональные антитела для лечения COVID-19». НАС. Управление по контролю за продуктами и лекарствами (FDA) (Пресс-релиз). 9 ноября 2020 г.. Получено 9 ноября 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ Zhang L, Lin D, Sun X, Curth U, Drosten C, Sauerhering L и др. (Март 2020 г.). «Кристаллическая структура основной протеазы SARS-CoV-2 является основой для создания улучшенных ингибиторов α-кетоамида». Наука. 368 (6489): 409–412. Bibcode:2020Sci ... 368..409Z. Дои:10.1126 / science.abb3405. ЧВК 7164518. PMID 32198291.
- ^ Цао Б., Ван И, Вэнь Д., Лю В., Ван Дж., Фань Г. и др. (Март 2020 г.). «Испытание лопинавира-ритонавира у взрослых, госпитализированных с тяжелым Covid-19». Медицинский журнал Новой Англии. 382 (19): 1787–1799. Дои:10.1056 / nejmoa2001282. ЧВК 7121492. PMID 32187464.
- ^ Морс Дж. С., Лалонд Т., Сюй С., Лю В. Р. (март 2020 г.). «Уроки прошлого: возможные неотложные варианты профилактики и лечения тяжелых острых респираторных инфекций, вызванных 2019-nCoV». ChemBioChem. 21 (5): 730–738. Дои:10.1002 / cbic.202000047. ЧВК 7162020. PMID 32022370.
- ^ Лю Ц., Чжоу К., Ли И, Гарнер Л.В., Уоткинс С.П., Картер Л.Дж. и др. (Март 2020 г.). «Исследования и разработки терапевтических агентов и вакцин против COVID-19 и связанных с ним заболеваний, связанных с коронавирусом человека». ACS Central Science. 6 (3): 315–331. Дои:10.1021 / acscentsci.0c00272. ЧВК 7094090. PMID 32226821.
- ^ Рамаджаям Р., Тан К.П., Лян PH (октябрь 2011 г.). «Недавняя разработка ингибиторов протеазы 3C и 3CL для открытия лекарств против коронавируса и пикорнавируса». Сделки Биохимического Общества. 39 (5): 1371–1375. Дои:10.1042 / BST0391371. PMID 21936817.
- ^ «Шаг 2: Доклинические исследования». НАС. Управление по контролю за продуктами и лекарствами (FDA). 4 января 2018 г.. Получено 23 марта 2020.
- ^ Гренфелл Р., Дрю Т. (14 февраля 2020 г.). «Вот почему ВОЗ утверждает, что до вакцины от коронавируса осталось 18 месяцев». Разговор. Получено 11 ноября 2020.
- ^ Престон Э. (19 марта 2020 г.). "Почему вакцина против коронавируса займет так много времени?". Бостонский глобус. Получено 21 марта 2020.
- ^ Gates B (февраль 2020 г.). «Реагирование на Covid-19 - пандемию, возникающую раз в столетие?». Медицинский журнал Новой Англии. 382 (18): 1677–1679. Дои:10.1056 / nejmp2003762. PMID 32109012.
дальнейшее чтение
- МакКрири EK, Pogue JM (апрель 2020 г.). «Лечение коронавирусной болезни 2019: обзор ранних и новых вариантов». Открытый форум по инфекционным заболеваниям. 7 (4): офаа105. Дои:10.1093 / ofid / ofaa105. ЧВК 7144823. PMID 32284951.
внешняя ссылка
- План НИОКР и COVID-19, Всемирная организация здоровья
- COVID-19 (Вопросы и ответы ) посредством Центры США по контролю и профилактике заболеваний (CDC)
- Коронавирусы от Национального института аллергии и инфекционных заболеваний США
- COVID-19 (Вопросы и ответы ) посредством Европейский центр профилактики и контроля заболеваний
- Трекер терапии COVID-19 Общество специалистов по нормативным вопросам