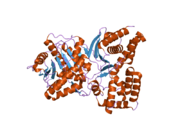Холина ацетилтрансфераза - Choline acetyltransferase
| Холина ацетилтрансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 2.3.1.6 | ||||||||
| Количество CAS | 9012-78-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Холина ацетилтрансфераза (обычно сокращенно ЧАТ, но иногда КОТ) это трансфераза фермент отвечает за синтез нейротрансмиттер ацетилхолин. ЧАТ катализирует перенос ацетил группа из кофермент ацетил-КоА к холин с образованием ацетилхолина (ACh). ChAT находится в высокой концентрации в холинергический нейроны, как в Центральная нервная система (ЦНС) и периферическая нервная система (ПНС). Как и большинство белков нервных окончаний, ChAT вырабатывается в организме нейрон и транспортируется в нервный терминал, где его концентрация максимальна. Присутствие ChAT в нервной клетке классифицирует эту клетку как «холинергический» нейрон. У человека фермент холинацетилтрансфераза кодируется ЧАТ ген.[5]
История
Холинацетилтрансфераза была впервые описана Дэвид Нахмансон и А. Л. Мачадо в 1943 г.[6] Немецкий биохимик Нахмансон изучал процесс проведения нервных импульсов и использование энергоемких химических реакций в клетках, расширяя работы нобелевских лауреатов. Отто Варбург и Отто Мейерхоф на ферментация, гликолиз, и сокращение мышц. Основываясь на предыдущих исследованиях, показывающих, что «действие ацетилхолина на структурные белки» отвечает за нервные импульсы, Нахмансон и Мачадо исследовали происхождение ацетилхолина.[7]
Из мозга и нервной ткани был извлечен фермент, который образует ацетилхолин. Формирование происходит только при наличии аденозинтрифосфат (АТФ). Фермент называется холинацетилаза.
— Нахмансон и Мачадо, 1943 г.[6]
В ацетил трансфераза механизм действия был неизвестен во время этого открытия, однако Нахмансон выдвинул гипотезу о возможности обмена ацетилфосфата или фосфорилхолина на фосфат (от АТФ ) для холина или ацетат-иона.[6] Только в 1945 году Коэнзим А (CoA) был открыт одновременно и независимо в трех лабораториях,[8][9][10] Нахмансон - один из них. Впоследствии в 1951 году был открыт ацетил-КоА, в то время называемый «активным ацетатом».[11] Трехмерная структура крысиного ChAT не была решена почти 60 лет спустя, в 2004 году.[12]
Структура
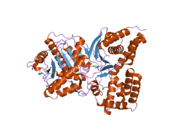
Трехмерная структура ChAT была решена методом рентгеновской кристаллографии. PDB: 2FY2. Холин связывается в активном центре ChAT нековалентными взаимодействиями между положительно заряженным амином холина и гидроксильной группой Tyr552, в дополнение к водородная связь между холином гидроксил группа и гистидин остаток, His324.
Холиновый субстрат помещается в карман внутри ChAT, в то время как ацетил-КоА помещается в карман на поверхности белка. 3D Кристальная структура показывает, что ацетильная группа ацетил-КоА примыкает к карману связывания холина - минимизируя расстояние между донором ацетильной группы и приемником.
- Структура сайтов связывания холинацетилтрансферазы
Гомология
ChAT очень консервативен в геноме животных. В частности, среди млекопитающих наблюдается очень высокое сходство последовательностей. Человек и кошка (Felis catus) ChAT, например, имеет 89% идентичности последовательности. Дрозофила составляет около 30%.[13]
Формы ЧАТ
Существует две формы ChAT: растворимая форма и мембраносвязанная форма.[14] Растворимая форма обеспечивает 80-90% общей активности фермента, в то время как мембраносвязанная форма отвечает за остальные 10-20% активности.[15] Однако уже давно ведутся споры о том, как последняя форма ChAT связывается с мембраной.[16] Мембраносвязанная форма ChAT связана с синаптическими пузырьками.[17]
Общие и периферические изоформы ChAT
Существуют две изоформы ChAT, обе кодируются одной и той же последовательностью. Общий тип ChAT (cChAT) присутствует как в ЦНС, так и в ПНС. ChAT периферического типа (pChAT) преимущественно экспрессируется в PNS у людей и возникает из пропуск экзона (экзоны 6-9) во время посттранскрипционная модификация. Следовательно аминокислотная последовательность очень похож, однако в pChAT отсутствуют части последовательности, присутствующей в cChAT. Изоформа pChAT была открыта в 2000 году на основании наблюдений, что полученные из мозга антитела к ChAT не могут окрашивать периферические холинергические нейроны, как те, что обнаруживаются в головном мозге. Эта сплайсинг генов Механизм, который приводит к различиям cChAT и pChAT, был обнаружен у разных видов, включая как позвоночных млекопитающих, так и беспозвоночных моллюсков, предполагая, что этот механизм ведет к некоторым еще не идентифицированным эволюционным преимуществам.
Функция
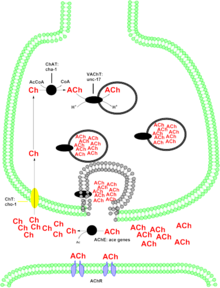
Холинергический системы участвуют в многочисленных неврологических функциях. Изменения в некоторых холинергических нейронах могут объяснять нарушения болезнь Альцгеймера. Белок, кодируемый этим геном, синтезирует нейромедиатор. ацетилхолин. Ацетилхолин действует на два класса рецепторов в Центральная нервная система – мускариновый и никотиновый - каждый из которых связан с разными физиологическими реакциями. Роль ацетилхолина в никотиновых рецепторах все еще исследуется. Скорее всего, это связано с путями вознаграждения / подкрепления, на что указывает аддиктивный характер никотин, который также связывается с никотиновым рецептором. Мускариновое действие ацетилхолина на ЦНС связано с обучением и памятью. Утрата холинергической иннервации в неокортекс связан с потерей памяти, что подтверждается запущенными случаями болезни Альцгеймера. в периферическая нервная система холинергические нейроны участвуют в контроле висцеральных функций, таких как, помимо прочего, сокращение сердечной мышцы и функция желудочно-кишечного тракта.
Часто используется в качестве иммуногистохимического маркера для двигательные нейроны (мотонейроны).
Мутации
Мутанты ChAT были выделены у нескольких видов, включая C. elegans, Дрозофила, и люди. Большинство нелетальных мутантов с фенотипом недикого типа проявляют некоторую активность, но значительно меньшую, чем у дикого типа.
В C. elegansнесколько мутаций в ChAT были связаны с геном cha-1. Все мутации приводят к значительному снижению активности ChAT. Процент потери активности в некоторых случаях может превышать 98%. Фенотипические эффекты включают замедленный рост, уменьшение размера, нескоординированное поведение и отсутствие чувствительности к ингибиторы холинэстеразы.[19] Изолированные термочувствительные мутанты в Дрозофила все были смертельными. Перед смертью пораженные мухи демонстрируют изменение поведения, включая неконтролируемые движения и изменение поведения. электроретинограмма Мероприятия.[20]
Человеческий ген, ответственный за кодирование ChAT, - это CHAT. Мутации в ЧАТе были связаны с врожденный миастенический синдром, заболевание, которое приводит к нарушению общей двигательной функции и слабости. Другие симптомы включают летальный исход. апноэ. Было показано, что из десяти изолированных мутантов у 1 активность полностью отсутствует, у 8 активность значительно снижена, а функция у 1 неизвестна.[21]
Клиническое значение
Болезнь Альцгеймера
В Болезнь Альцгеймера (AD) вызывает проблемы с памятью и познанием. Концентрации ацетилхолина и ChAT заметно снижаются в неокортексе головного мозга и гиппокампе.[22] Хотя потеря клеток и дисфункция холинергических нейронов считается причиной болезни Альцгеймера, обычно это не считается основным фактором развития этого заболевания. Предполагается, что агрегация и отложение Бета амилоид белок, вмешивается в метаболизм нейронов и далее повреждает холинэргические аксоны в коре и холинэргические нейроны в базальной части переднего мозга.[23]
Боковой амиотрофический склероз
В боковой амиотрофический склероз (БАС) - одно из наиболее распространенных заболеваний двигательных нейронов. Значительная потеря иммунореактивности ChAT обнаруживается при БАС.[24] Предполагается, что холинергическая функция участвует в неконтролируемом повышении концентрации внутриклеточного кальция, причина которого до сих пор остается неясной.[25]
Наркотики
Неостигмин метилсульфат, антихолинэстеразный агент, использовался для нацеливания на ChAT. В частности, было показано, что использование неостигмина метилсульфата оказывает положительное влияние на врожденный миастенический синдром.[26]
Контакт с эстрадиол было показано, что увеличивает ChAT у самок крыс.[27]
Смотрите также
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000070748 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000021919 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Штраус В.Л., Кемпер Р.Р., Джаякар П., Конг С.Ф., Херш Л.Б., Хилт, округ Колумбия, Рабин М. (февраль 1991 г.). «Ген холинацетилтрансферазы человека отображается в области 10q11-q22.2 путем гибридизации in situ». Геномика. 9 (2): 396–8. Дои:10.1016 / 0888-7543 (91) 90273-Н. PMID 1840566.
- ^ а б c Нахмансон Д., Мачадо А.Л. (1943). «Образование ацетилхолина. Новый фермент: холинацетилаза». J. Neurophysiol. 6 (5): 397–403. Дои:10.1152 / jn.1943.6.5.397.
- ^ Берман Р., Уилсон И.Б., Нахмансон Д. (сентябрь – октябрь 1953 г.). «Специфичность холинацетилазы в отношении биологической функции». Biochimica et Biophysica Acta. 12 (1–2): 315–24. Дои:10.1016/0006-3002(53)90150-4. PMID 13115440.
- ^ Липманн Ф., Каплан Н.О. (1946). «Общий фактор ферментативного ацетилирования сульфаниламида и холина». J. Biol. Chem. 162: 743–744.
- ^ Липтон М.А. (1946). «Механизм ферментативного синтеза ацетилхолина». Кормили. Proc. 5 (1 Пет 2): 145. PMID 21066687.
- ^ Нахмансон Д., Берман М. (1946). «Исследования холинацетилазы; получение кофермента и его влияние на фермент». J. Biol. Chem. 165 (2): 551–63. PMID 20276121.
- ^ Джонс Д.Х., Нельсон В.Л. (1968). «Способ выделения продуктов кофермента А». Анальный. Биохим. 26 (3): 350–7. Дои:10.1016/0003-2697(68)90195-4. PMID 5716187.
- ^ Говиндасами Л., Педерсен Б., Лиан В., Кукар Т., Гу И, Джин С., Агбандже-МакКенна М., Ву Д., МакКенна Р. (ноябрь 2004 г.). «Структурные идеи и функциональные последствия холинацетилтрансферазы». Журнал структурной биологии. 148 (2): 226–35. Дои:10.1016 / j.jsb.2004.06.005. PMID 15477102.
- ^ Ода Y (ноябрь 1999 г.). «Холинацетилтрансфераза: структура, распределение и патологические изменения в центральной нервной системе». Патология Интернэшнл. 49 (11): 921–37. Дои:10.1046 / j.1440-1827.1999.00977.x. PMID 10594838. S2CID 23621617.
- ^ Тандон А, Бачу М., Велдон П., Полоса С., Кольер Б. (1996). «Влияние применения колхицина на преганглионарные аксоны на активность холина ацетилтрансферазы и содержание и высвобождение ацетилхолина в верхнем шейном ганглии». J. Neurochem. 66 (3): 1033–41. Дои:10.1046 / j.1471-4159.1996.66031033.x. PMID 8769864. S2CID 44586742.
- ^ Пахуд Дж., Салем Н., ван де Гур Дж., Медилански Дж., Пеллегринелли Н., Эдер-Колли Л. (25 мая 1998 г.). «Изучение субклеточной локализации мембраносвязанной холинацетилтрансферазы в центральной нервной системе Drosophila и ее связи с мембранами». Европейский журнал нейробиологии. 10 (5): 1644–53. Дои:10.1046 / j.1460-9568.1998.00177.x. PMID 9751137. S2CID 24196247.
- ^ Брюс Г., Херш Л. Б. (декабрь 1987 г.). «Исследования детергента высвободили холинацетилтрансферазу из мембранных фракций головного мозга крысы и человека». Neurochem Res. 12 (12): 1059–66. Дои:10.1007 / bf00971705. PMID 2450285. S2CID 4336737.
- ^ Кэрролл П. Т. (1994). «Связанная с мембраной холин-O-ацетилтрансфераза в ткани гиппокампа крысы связана с синаптическими пузырьками». Brain Res. 633 (1–2): 112–8. Дои:10.1016/0006-8993(94)91529-6. PMID 8137149. S2CID 1139292.
- ^ Рэнд, Джеймс. «Ацетилхолин». WormBook.
- ^ Рэнд Дж. Б., Рассел Р. Л. (февраль 1984 г.). «Мутанты нематоды Caenorhabditis elegans с дефицитом холинацетилтрансферазы». Генетика. 106 (2): 227–48. ЧВК 1202253. PMID 6698395.
- ^ Гринспен Р. Дж. (1980). «Мутации холина ацетилтрансферазы и связанные с ней нервные дефекты». Журнал сравнительной физиологии. 137 (1): 83–92. Дои:10.1007 / BF00656920. S2CID 45897606.
- ^ Оно К., Цуджино А., Бренгман Дж. М., Харпер С. М., Байзер З., Удд Б., Бейринг Р., Робб С., Киркхэм Ф. Дж., Энгель АГ (13 февраля 2001 г.). «Мутации холинацетилтрансферазы вызывают миастенический синдром, связанный с эпизодическим апноэ у людей». Труды Национальной академии наук. 98 (4): 2017–2022. Bibcode:2001PNAS ... 98.2017O. Дои:10.1073 / пнас.98.4.2017. ЧВК 29374. PMID 11172068.
- ^ Бартус Р.Т., Дин Р.Л., Бир Б., Липпа А.С. (30 июля 1982 г.). «Холинергическая гипотеза гериатрической дисфункции памяти». Наука. 217 (4558): 408–14. Bibcode:1982Научный ... 217..408B. Дои:10.1126 / science.7046051. PMID 7046051.
- ^ Геула К., Месулам М.М., Сарофф Д.М., Ву К.К. (январь 1998 г.). «Связь между бляшками, клубками и потерей корковых холинергических волокон при болезни Альцгеймера». J Neuropathol Exp Neurol. 57 (1): 63–75. Дои:10.1097/00005072-199801000-00008. PMID 9600198.
- ^ Ода Й, Имаи С., Наканиши И., Итикава Т., Дегучи Т. (декабрь 1995 г.). «Иммуногистохимическое исследование холина ацетилтрансферазы в спинном мозге пациентов с боковым амиотрофическим склерозом». Патол Инт. 45 (12): 933–9. Дои:10.1111 / j.1440-1827.1995.tb03418.x. PMID 8808298. S2CID 23763400.
- ^ Моррисон Б.М., Моррисон Дж. Х. (январь 1999 г.). «Боковой амиотрофический склероз, связанный с мутациями супероксиддисмутазы: предполагаемый механизм дегенерации». Brain Res Brain Res Rev. 29 (1): 121–35. Дои:10.1016 / s0165-0173 (98) 00049-6. PMID 9974153. S2CID 28937351.
- ^ Грир М., Шотланд М. (июль 1960 г.). «Миастения у новорожденных». Педиатрия. 26: 101–8. PMID 13851666.
- ^ Луине В.Н. (август 1985 г.). «Эстрадиол увеличивает активность холинацетилтрансферазы в определенных базальных ядрах переднего мозга и проекционных областях самок крыс». Экспериментальная неврология. 89 (2): 484–90. Дои:10.1016/0014-4886(85)90108-6. PMID 2990988. S2CID 1525252.
дальнейшее чтение
- Ода Y (2000). «Холинацетилтрансфераза: структура, распределение и патологические изменения в центральной нервной системе». Патол. Int. 49 (11): 921–37. Дои:10.1046 / j.1440-1827.1999.00977.x. PMID 10594838. S2CID 23621617.
- Ван Дж, Фу Х, Чжан Д., Ю Л, Ли Н, Лу З., Гао Й, Ван М, Лю Х, Чжоу Ц., Хань В, Ян Б., Ван Дж. (2017). «ChAT-позитивные нейроны участвуют в нейрогенезе субвентрикулярной зоны после окклюзии средней мозговой артерии у мышей». Behav. Brain Res. 316: 145–151. Дои:10.1016 / j.bbr.2016.09.007. ЧВК 5048585. PMID 27609645.
- Ода Й, Наканиши И., Дегучи Т. (1993). «Комплементарная ДНК для холинацетилтрансферазы человека индуцирует две формы фермента с разной молекулярной массой в культивируемых клетках». Brain Res. Мол. Brain Res. 16 (3–4): 287–94. Дои:10.1016 / 0169-328X (92) 90237-6. PMID 1337937.
- Ван Дж, Лу З., Фу Х, Чжан Д, Ю Л, Ли Н, Гао И, Лю Х, Инь Ц, Кэ Дж, Ли Л, Чжай М, Ву С, Фан Дж, Ур Л, Лю Дж, Чен Х , Ян Кью, Ван Дж (2017). «Путь передачи сигналов никотинового рецептора альфа-7 участвует в нейрогенезе, индуцированном ChAT-положительными нейронами в субвентрикулярной зоне». Перевод Stroke Res. 8 (5): 484–493. Дои:10.1007 / s12975-017-0541-7. ЧВК 5704989. PMID 28551702.
- Туссент Дж. Л., Жоффруа В., Шмитт М., Вернер А., Гарнье Дж. М., Симони П., Кемпф Дж. (1992). «Холинацетилтрансфераза человека (ЧАТ): частичная последовательность гена и потенциальные контрольные области». Геномика. 12 (2): 412–6. Дои:10.1016/0888-7543(92)90395-9. PMID 1339386.
- Лоренци М.В., Тринидад А.С., Чжан Р., Штраус В.Л. (1992). «Две мРНК транскрибируются из человеческого гена холинацетилтрансферазы». ДНК клетки биол. 11 (8): 593–603. Дои:10.1089 / dna.1992.11.593. PMID 1388731.
- Мисава Х., Исии К., Дегучи Т. (1992). «Экспрессия гена холина ацетилтрансферазы мыши. Альтернативный сплайсинг и идентификация высокоактивной промоторной области». J. Biol. Chem. 267 (28): 20392–9. PMID 1400357.
- Червини Р., Рокки М., ДиДонато С., Финоккиаро Г. (1992). «Выделение и субхромосомная локализация фрагмента ДНК гена холинацетилтрансферазы человека». Neurosci. Латыш. 132 (2): 191–4. Дои:10.1016/0304-3940(91)90299-9. PMID 1784419. S2CID 23030200.
- Штраус В.Л., Кемпер Р.Р., Джаякар П., Конг С.Ф., Херш Л.Б., Хилт, округ Колумбия, Рабин М. (1991). «Ген холинацетилтрансферазы человека отображается в области 10q11-q22.2 путем гибридизации in situ». Геномика. 9 (2): 396–8. Дои:10.1016 / 0888-7543 (91) 90273-Н. PMID 1840566.
- Вьегас-Пекиньо Э, Беррар С., Брис А., Апиу Ф, Малле Дж. (1991). «Локализация фрагмента гена холинацетилтрансферазы человека длиной 900 п.н. в 10q11.2 посредством нерадиоактивной гибридизации in situ». Геномика. 9 (1): 210–2. Дои:10.1016/0888-7543(91)90242-7. PMID 2004764.
- Ито Н., Слеммон Дж. Р., Хоук Д. Х., Уильямсон Р., Морита Е., Итакура К., Робертс Е., Шивели Дж. Е., Кроуфорд Г. Д., Сальватерра П. М. (1986). «Клонирование кДНК холинацетилтрансферазы дрозофилы». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 83 (11): 4081–5. Bibcode:1986ПНАС ... 83.4081И. Дои:10.1073 / пнас.83.11.4081. ЧВК 323670. PMID 3086876.
- Херш Л. Б., Такане К., Гилис К., Мумау С., Слотер С. (1988). «Сохранение аминокислотных последовательностей холинацетилтрансферазы человека и свиньи». J. Neurochem. 51 (6): 1843–5. Дои:10.1111 / j.1471-4159.1988.tb01166.x. PMID 3183663. S2CID 24613238.
- Беррард С., Брайс А., Лоттспайх Ф., Браун А., Барде Ю.А., Маллет Дж. (1988). «Клонирование кДНК и полная последовательность холинацетилтрансферазы свиньи: трансляция in vitro соответствующей РНК дает активный белок». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 84 (24): 9280–4. Дои:10.1073 / пнас.84.24.9280. ЧВК 373252. PMID 3480542.
- Chireux MA, Le Van Thai A, Weber MJ (1995). «Ген холинацетилтрансферазы человека: локализация альтернативных первых экзонов». J. Neurosci. Res. 40 (4): 427–38. Дои:10.1002 / младший 490400402. PMID 7616604. S2CID 42856768.
- Басеро П., Шмитт М., Туссент Дж. Л., Симони П., Жоффруа В., Кёш Д., Дюкло С., Кемпф Дж., Квирин-Стрикер С. (1993). «Идентификация и анализ промотора гена холина ацетилтрансферазы человека». NeuroReport. 4 (3): 287–90. Дои:10.1097/00001756-199303000-00015. PMID 7682855.
- Квирин-Стрикер С., Наппей В., Симони П., Туссен Дж. Л., Шмитт М. (1994). «Трансактивация рецепторами тироидных гормонов 5'-фланкирующей области гена ChAT человека». Brain Res. Мол. Brain Res. 23 (3): 253–65. Дои:10.1016 / 0169-328X (94) 90232-1. PMID 8057782.
- Эриксон Дж. Д., Вароки Х., Шефер М. К., Моди В., Диблер М. Ф., Вейхе Е., Рэнд Дж., Эйден Л. Е., Боннер Т. И., Усдин Т. Б. (1994). «Функциональная идентификация везикулярного переносчика ацетилхолина и его экспрессия из локуса« холинергического »гена». J. Biol. Chem. 269 (35): 21929–32. PMID 8071310.
- Кенгаку М, Мисава Х, Дегучи Т. (1993). «Множественные виды мРНК холина ацетилтрансферазы из спинного мозга крысы». Brain Res. Мол. Brain Res. 18 (1–2): 71–6. Дои:10.1016 / 0169-328X (93) 90174-N. PMID 8479291.
- Мисава Х., Мацуура Дж., Ода Й, Такахаши Р., Дегучи Т. (1997). «МРНК холинацетилтрансферазы человека с различными 5'-участками продуцируют основной продукт трансляции массой 69 кДа». Brain Res. Мол. Brain Res. 44 (2): 323–33. Дои:10.1016 / S0169-328X (96) 00231-8. PMID 9073174.
- Лённерберг П., Ибаньес К.Ф. (1999). «Новые, специфичные для семенников транскрипты мРНК, кодирующие усеченную на N-конце холинацетилтрансферазу». Мол. Репродукция. Dev. 53 (3): 274–81. Дои:10.1002 / (SICI) 1098-2795 (199907) 53: 3 <274 :: AID-MRD3> 3.0.CO; 2-8. PMID 10369388.
- Сакакибара А., Хаттори С. (2000). «Chat, адаптерный белок, связанный с Cas / HEF1, который объединяет несколько сигнальных путей». J. Biol. Chem. 275 (9): 6404–10. Дои:10.1074 / jbc.275.9.6404. PMID 10692442.
внешние ссылки
- Холин + ацетилтрансфераза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)