Триптофангидроксилаза - Tryptophan hydroxylase
| триптофан 5-монооксигеназа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
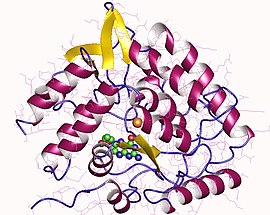 мономер триптофана 5-монооксигеназы, человек | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.14.16.4 | ||||||||
| Количество CAS | 9037-21-2 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| триптофангидроксилаза 1 (триптофан-5-монооксигеназа) | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | TPH1 | ||||||
| Альт. символы | TPRH, TPH | ||||||
| Ген NCBI | 7166 | ||||||
| HGNC | 12008 | ||||||
| OMIM | 191060 | ||||||
| PDB | 1MLW | ||||||
| RefSeq | NM_004179 | ||||||
| UniProt | P17752 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 1.14.16.4 | ||||||
| Locus | Chr. 11 p15.3-p14 | ||||||
| |||||||
| триптофангидроксилаза 2 | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | TPH2 | ||||||
| Ген NCBI | 121278 | ||||||
| HGNC | 20692 | ||||||
| OMIM | 607478 | ||||||
| RefSeq | NM_173353 | ||||||
| UniProt | Q8IWU9 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 12 q15 | ||||||
| |||||||
Триптофангидроксилаза (TPH) является фермент (EC 1.14.16.4 ) участвует в синтезе нейромедиатора серотонин. Тирозингидроксилаза, фенилаланингидроксилаза, и триптофангидроксилаза вместе составляют семейство биоптерин-зависимых гидроксилазы ароматических аминокислот. TPH катализирует следующую химическую реакцию
- L-триптофан + тетрагидробиоптерин + O2 5-гидрокситриптофан + дигидробиоптерин + H2О
В нем работает еще один кофактор, утюг.
Функция
Он отвечает за добавление группы -HO (гидроксилирование ) в позицию 5, чтобы сформировать аминокислота 5-гидрокситриптофан (5-HTP), который является начальной и лимитирующей стадией синтеза нейромедиатора серотонина. Это также первый фермент в синтезе мелатонина.
Триптофангидроксилаза (TPH), тирозингидроксилаза (TH) и фенилаланингидроксилаза (PAH) являются членами суперсемейства гидроксилазы ароматических аминокислот, катализируя ключевые этапы важных метаболических путей.[1] Аналогично фенилаланингидроксилаза и тирозингидроксилаза, этот фермент использует (6R) -L-эритро-5,6,7,8-тетрагидробиоптерин (BH4) и дикислород в качестве кофакторов.[2]
У людей стимуляция выработки серотонина путем введения триптофана оказывает антидепрессивный эффект.[3][4] и ингибирование триптофангидроксилазы (например, с помощью п-хлорфенилаланин ) может вызвать депрессию.[5]
В Мероприятия триптофангидроксилазы (то есть скорость, с которой она превращает L-триптофан в предшественник серотонина L-5-гидрокситриптофан) может быть увеличена, когда она подвергается фосфорилирование. Протеинкиназа А, например, может фосфорилировать триптофангидроксилазу, тем самым увеличивая ее активность.
Изоформы
У человека, как и у других млекопитающих, есть два разных гена TPH. У человека эти гены расположены на хромосомах 11 и 12 и кодируют два разных гомологичных фермента. TPH1 и TPH2 (идентичность последовательностей 71%).[6]
- TPH1 в основном экспрессируется в тканях, которые экспрессируют серотонин (нейромедиатор) на периферии (кожа, кишка, шишковидная железа ), но он также выражен в центральной нервной системе.
- С другой стороны, TPH2 выражается исключительно в нейронный типы клеток и является преобладающей изоформой в Центральная нервная система.
Дополнительные изображения
Путь синтеза серотонина из триптофана

Метаболический путь от триптофана до серотонина
Смотрите также
 Биологический портал
Биологический портал
Рекомендации
- ^ Маккинни Дж., Тейген К., Фрёйстейн Н.А., Салаун К., Кнаппског П.М., Хаавик Дж., Мартинес А. (декабрь 2001 г.). «Конформация субстрата и кофактора птерина, связанного с триптофангидроксилазой человека. Важная роль Phe313 в субстратной специфичности» (PDF). Биохимия. 40 (51): 15591–601. Дои:10.1021 / bi015722x. PMID 11747434. Архивировано из оригинал (PDF) 17 декабря 2008 г.
- ^ «тетрагидробиоптерин». Базы данных BH4. BH4.org. 2005. Архивировано с оригинал на 2006-12-06.
- ^ Линдсет Дж., Хелланд Б., Касперс Дж. (Апрель 2015 г.). «Влияние диетического триптофана на аффективные расстройства». Архив психиатрического сестринского дела. 29 (2): 102–7. Дои:10.1016 / j.apnu.2014.11.008. ЧВК 4393508. PMID 25858202.
- ^ Коппен А., Шоу Д.М., Херцберг Б., Маггс Р. (декабрь 1967 г.). «Триптофан в лечении депрессии». Ланцет. Первоначально опубликовано как Том 2, выпуск 7527. 2 (7527): 1178–80. Дои:10.1016 / с0140-6736 (67) 91894-6. PMID 4168381.
- ^ Ван Л., Эрландсен Х., Хаавик Дж., Кнаппског П.М., Стивенс Р.К. (октябрь 2002 г.). «Трехмерная структура человеческой триптофангидроксилазы и ее значение для биосинтеза нейротрансмиттеров серотонина и мелатонина». Биохимия. 41 (42): 12569–74. Дои:10.1021 / bi026561f. PMID 12379098.
- ^ Walther DJ, Bader M (ноябрь 2003 г.). «Уникальная центральная изоформа триптофангидроксилазы». Биохимическая фармакология. 66 (9): 1673–80. Дои:10.1016 / S0006-2952 (03) 00556-2. PMID 14563478.
дальнейшее чтение
- Фридман П.А., Каппельман А.Х., Кауфман С. (июль 1972 г.). «Частичная очистка и характеристика триптофангидроксилазы из заднего мозга кролика». Журнал биологической химии. 247 (13): 4165–73. PMID 4402511.
- Хамон М., Бургуан С., Арто Ф., Гловински Дж. (Ноябрь 1979 г.). «Роль интранейронального 5-HT и активации триптофангидроксилазы в контроле синтеза 5-HT в срезах мозга крыс, инкубированных в среде, обогащенной K +». Журнал нейрохимии. 33 (5): 1031–42. Дои:10.1111 / j.1471-4159.1979.tb05239.x. PMID 315449. S2CID 12415965.
- Ичияма А., Накамура С., Нисизука Ю., Хаяиши О. (апрель 1970 г.). «Ферментативные исследования биосинтеза серотонина в головном мозге млекопитающих». Журнал биологической химии. 245 (7): 1699–709. PMID 5309585.
- Жекье Э., Робинсон Д.С., Ловенберг В., Сьордсма А. (май 1969 г.). «Дальнейшие исследования триптофангидроксилазы в стволе мозга крыс и шишковидной железе говядины». Биохимическая фармакология. 18 (5): 1071–81. Дои:10.1016/0006-2952(69)90111-7. PMID 5789774.
- Ван Л., Эрландсен Х., Хаавик Дж., Кнаппског П.М., Стивенс Р.К. (октябрь 2002 г.). «Трехмерная структура человеческой триптофангидроксилазы и ее значение для биосинтеза нейротрансмиттеров серотонина и мелатонина». Биохимия. 41 (42): 12569–74. Дои:10.1021 / bi026561f. PMID 12379098.
- Windahl MS, Petersen CR, Christensen HE, Harris P (ноябрь 2008 г.). «Кристаллическая структура триптофангидроксилазы со связанным аминокислотным субстратом». Биохимия. 47 (46): 12087–94. Дои:10.1021 / bi8015263. PMID 18937498.
внешняя ссылка
- Триптофан + гидроксилаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Смотрите также триптофангидроксилаза в Протеопедия
| Этот 1.14 по К.Э. фермент -связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |


