EGLN1 - EGLN1
эта статья слишком полагается на использованная литература к основные источники. (Январь 2020) (Узнайте, как и когда удалить этот шаблон сообщения) |
Гипоксия-индуцируемый фактор пролилгидроксилазы 2 (HIF-PH2) или белок 2, содержащий домен пролилгидроксилазы (PHD2), представляет собой фермент, кодируемый EGLN1 ген. Он также известен как Egl девять гомолог 1.[5][6][7][8] PHD2 - это α-кетоглутарат / 2-оксоглутарат-зависимая гидроксилаза, суперсемейство негемных железосодержащих белков. У людей PHD2 является одним из трех изоформы из индуцируемый гипоксией фактор-пролиндиоксигеназа, который также известен как HIF пролил-гидроксилаза.
Реакция гипоксии
HIF-1α является повсеместным, постоянно синтезируемым фактор транскрипции отвечает за усиление экспрессии генов, участвующих в клеточном ответе на гипоксия. Эти генные продукты могут включать такие белки, как гликолитический ферменты и ангиогенный факторы роста.[9] При нормоксии альфа-субъединицы HIF помечены для убиквитин-протеасома путь деградации через гидроксилирование из пролин -564 и пролин-402 от PHD2. Пролилгидроксилирование имеет решающее значение для стимулирования pVHL связывание с HIF, которое нацелено на полиубиквитилирование HIF.[8]
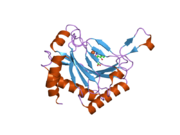
Структура

PHD2 представляет собой фермент массой 46 кДа, который состоит из N-концевой домен, гомологичный Цинковый палец MYND домены, а C-терминал домен, гомологичный 2-оксоглутарату диоксигеназы. Каталитический домен состоит из двухцепочечной β-спираль ядро, которое стабилизируется тремя α-спирали упакован по основному β-листу.[10] Активный центр, который находится в кармане между β-листами, хелатирует железо (II) за счет координации гистидина и аспартата. 2-оксоглутарат замещает молекулу воды и связывает железо.[11] Активный сайт выложен гидрофобный остатки, возможно потому, что такие остатки менее подвержены потенциальному окислительному повреждению из-за утечки реактивных частиц из центра железа.[10]
PHD2 катализирует гидроксилирование двух сайтов на HIF-α, которые называются N-концевым кислородзависимым доменом деградации (остатки 395-413, NODD) и C-концевым кислородзависимым доменом деградации (остатки 556-574, CODD).[12][13] Эти два субстрата HIF обычно представлены пептидами длиной 19 аминокислот в in vitro эксперименты.[14] Рентгеновская кристаллография и ЯМР-спектроскопия показали, что оба пептида связываются с одним и тем же сайтом связывания на PHD2, в щели на поверхности PHD2.[11][15] An индуцированный припадок Механизм был указан из структуры, в которой остатки 237-254 принимают конформацию замкнутой петли, в то время как в структуре без CODD или NODD те же остатки принимают конформацию типа открытого пальца.[11][15] Такое конформационное изменение было подтверждено ЯМР-спектроскопией.[15] Рентгеновская кристаллография[11][15] и молекулярно-динамические расчеты.[16] Недавнее исследование обнаружило второй сайт связывания пептида на PHD2, хотя связывание пептида с этим альтернативным сайтом, по-видимому, не влияло на каталитическую активность фермента.[17] Необходимы дальнейшие исследования, чтобы полностью понять биологическое значение этого второго сайта связывания пептида.
Фермент имеет высокое сродство к железу (II) и 2-оксоглутарат (также известный как α-кетоглутарат), и с этими факторами образует долгоживущий комплекс.[18] Было высказано предположение, что концентрации косубстрата и железа заставляют гидроксилазы HIF реагировать на соответствующее «гипоксическое окно» для определенного типа клеток или ткани.[19] Исследования показали, что PHD2 имеет KM для дикислород немного выше его атмосферной концентрации, и PHD2 считается наиболее важным датчиком кислородного статуса клетки.[20]
Механизм
Фермент включает один атом кислорода из дикислорода в гидроксилированный продукт и один атом кислорода в сукцинат сопродукт.[21] Его взаимодействия с HIF-1α основаны на области подвижной петли, которая помогает окружить сайт гидроксилирования и помогает стабилизировать связывание как железа, так и 2-оксиглутарата.[11] А механизм регулирования обратной связи также было предложено замещение HIF-1α гидроксилированным HIF-1α, когда 2-оксоглутарат является ограничивающим.[22]

Биологическая роль и актуальность болезни
PHD2 является основным регулятором HIF-1α. устойчивое состояние уровни в ячейке. А PHD2 сбить показали повышенные уровни HIF-1α при нормоксии и увеличение ядерной аккумуляции HIF-1α и HIF-зависимой транскрипции. Накопление в устойчивом состоянии HIF-1α зависело от количества подавления PHD, вызванного миРНК в HeLa клетки и множество других линий клеток человека.[8]
Однако, хотя может показаться, что PHD2 подавляет HIF-1α и, следовательно, также онкогенез, высказывались предположения о парадоксальной роли PHD2 в опухоль распространение. Например, одно исследование на животных показало уменьшение опухоли у мышей с дефицитом PHD2 за счет активации антипролиферативного действия. Передача сигналов TGF-β.[23] Другие модели in vivo показали подавляющую опухоль активность PHD2 в панкреатический рак а также рак печени.[24][25] Исследование 121 пациента показало, что PHD2 является сильным прогностическим маркером рак желудка, у пациентов с отрицательной реакцией на PHD2 продолжительность жизни короче по сравнению с пациентами с отрицательной реакцией на PHD2.[26]
Недавние полногеномные ассоциации исследований предположили, что EGLN1 может участвовать в низком гематокрит фенотип, присущий тибетскому населению, и, следовательно, EGLN1 может играть роль в наследственной адаптации этой популяции к жизни на большой высоте.[27]
В качестве терапевтической мишени
Важная роль HIF как гомеостатический медиатор предполагает, что PHD2 является терапевтической мишенью для ряда нарушений, связанных с ангиогенезом, эритропоэз, и клеточная пролиферация. Был интерес как к усилению, так и к подавлению активности PHD2.[9] Например, метилселеноцистеин (МСК) ингибирование HIF-1α привело к ингибированию роста опухоли в карцинома почек в зависимости от PHD. Считается, что это явление связано с PHD-стабилизацией, но механистические детали этого процесса еще не исследованы.[28] С другой стороны, скрининг низкомолекулярных хелаторов выявил гидроксипироны и гидроксипиридоны как потенциальные ингибиторы PHD2.[29] Недавно было обнаружено, что дигидропиразолы, небольшая молекула на основе триазола, являются мощным ингибитором PHD2, который активен как in vitro и in vivo.[30] Пептиды-аналоги субстрата также были разработаны для демонстрации селективности ингибирования PHD2 по сравнению с фактором, ингибирующим HIF (FIH), для которого некоторые другие ингибиторы PHD проявляют перекрывающуюся специфичность.[31]
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000135766 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000031987 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Dupuy D, Aubert I, Duperat VG, Petit J, Taine L, Stef M, Bloch B, Arveiler B (ноябрь 2000 г.). «Картирование, характеристика и анализ экспрессии человеческого гомолога SM-20, c1orf12, и идентификация нового родственного гена, SCAND2». Геномика. 69 (3): 348–54. Дои:10.1006 / geno.2000.6343. PMID 11056053.
- ^ Тейлор М.С. (2001). «Характеристика и сравнительный анализ семейства генов EGLN». Ген. 275 (1): 125–32. Дои:10.1016 / S0378-1119 (01) 00633-3. PMID 11574160.
- ^ «Ген Entrez: EGLN1 egl 9, гомолог 1 (C. elegans)».
- ^ а б c Берра Э., Бенизри Э., Жинувес А., Волмат В., Ру Д., Пуиссегюр Дж. (Август 2003 г.). «Пролилгидроксилаза 2 HIF является ключевым датчиком кислорода, устанавливающим низкие стабильные уровни HIF-1α при нормоксии». Журнал EMBO. 22 (16): 4082–4090. Дои:10.1093 / emboj / cdg392. ЧВК 175782. PMID 12912907.
- ^ а б Уильям С., Николлс Л., Рэтклифф П., Пью С., Максвелл П. (2004). «Ферменты пролилгидроксилазы, которые действуют как кислородные сенсоры, регулирующие разрушение индуцируемого гипоксией фактора α». Адван. Энзим Регул. 44: 75–92. Дои:10.1016 / j.advenzreg.2003.11.017. PMID 15581484.
- ^ а б McDonough M, Li V, Flashman E, Chowdhury R, Mohr C, Liénard ZJ, Oldham N, Clifton I., Lewis J, McNeill L, Kurzeja R, Hewitson K, Yang E, Jordan S, Syed R, Schofield C (июнь 2006 г. ). "Клеточное зондирование кислорода: кристаллическая структура индуцируемого гипоксией фактора пролилгидроксилазы (PHD2)". Proc Natl Acad Sci USA. 103 (26): 9814–9. Дои:10.1073 / pnas.0601283103. ЧВК 1502536. PMID 16782814.
- ^ а б c d е Чоудхури Р., МакДонаф М., Месинович Дж., Лоэнарз К., Флэшман Е., Хьюитсон К., Домен С., Шофилд С. (июль 2009 г.). «Структурная основа связывания фактора, индуцируемого гипоксией, с чувствительными к кислороду пролилгидроксилазами». Структура. 17 (7): 981–9. Дои:10.1016 / j.str.2009.06.002. PMID 19604478.
- ^ Иллингворт CJ, Loenarz C, Скофилд CJ, Домен C (август 2010 г.). «Химическая основа селективности опухолевого супрессора фон Хиппеля Линдау pVHL для пролил-гидроксилированного HIF-1α». Биохимия. 49 (32): 6936–6944. Дои:10.1021 / bi100358t. PMID 20695530.
- ^ Аббуд М.И., Чоудхури Р., Люнг И.К., Липпл К., Лоенарз С., Кларидж Т.Д., Шофилд С.Дж. (август 2018 г.). «Исследования субстратной селективности каталитического домена пролилгидроксилазы 2, индуцируемого гипоксией». ChemBioChem. 19 (21): 2262–2267. Дои:10.1002 / cbic.201800246. PMID 30144273. S2CID 52078684.
- ^ Флэшман Э., Багг Э.А., Чоудхури Р., Месинович Дж., Лоэнарз С., Макдонау М.А., Хьюитсон К.С., Шофилд С.Дж. (февраль 2008 г.). «Кинетическое обоснование селективности по отношению к субстратам N- и C-концевых кислородзависимых доменов деградации, опосредованных петлевой областью пролилгидроксилаз индуцируемого гипоксией фактора». J Biol Chem. 283 (7): 3808–3815. Дои:10.1074 / jbc.M707411200. PMID 18063574.
- ^ а б c d Чоудхури Р., Люнг И.К., Тиан Ю.М., Аббуд М.И., Ге В., Домен С., Кантрелл FX, Ландриу И., Харди А.П., Пью К.В., Рэтклифф П.Дж., Кларидж Т.Д., Шофилд К. «Структурная основа селективности домена деградации кислорода пролилгидроксилаз HIF». Nat Commun. 7: 12673. Дои:10.1038 / ncomms12673. ЧВК 5007464. PMID 27561929.
- ^ Wick CR, Lanig H, Jager CM, Burzlaff N, Clark T (ноябрь 2012 г.). «Структурное понимание пролилгидроксилазы PHD2: молекулярная динамика и исследование методом DFT». Eur J Inorg Chem. 2012 (31): 4973–4985. Дои:10.1002 / ejic.201200391.
- ^ McAllister TE, Yeh TL, Abboud MI, Leung IK, Hookway ES, King ON, Bhushan B, Williams ST, Hopkinson RJ, Muenzel M, Loik ND, Chowdhury R, Oppermann U, Claridge TD, Goto Y, Suga H, Schofield CJ , Кавамура А (2018). «Неконкурентные циклические пептиды для нацеливания на комплексы фермент-субстрат». Chem Sci. 9 (20): 4569–4578. Дои:10.1039 / C8SC00286J. ЧВК 5969509. PMID 29899950.
- ^ McNeill L, Flashman E, Бак M, Hewitson K, Clifton I, Jeschke G, Claridge T, Ehrismann D, Oldham N, Schofield C (октябрь 2005 г.). «Гипоксия-индуцируемый фактор пролилгидроксилаза 2 имеет высокое сродство к двухвалентному железу и 2-оксоглутарату». Мол. Биосист. 1 (4): 321–4. Дои:10.1039 / b511249b. PMID 16880998.
- ^ Эрисманн Д., Флэшман Э., Генн Д.Н., Матиудакис Н., Хьюитсон К.С., Рэтклифф П.Дж., Шофилд С.Дж. (январь 2007 г.). «Исследования активности гидроксилаз фактора, индуцируемого гипоксией, с использованием анализа потребления кислорода». Biochem. J. 401 (1): 227–34. Дои:10.1042 / BJ20061151. ЧВК 1698668. PMID 16952279.
- ^ Hirsilä M, Koivunen P, Günzler V, Kivirikko KI, Myllyharju J (август 2003 г.). «Характеристика пролил-4-гидроксилаз человека, которые изменяют фактор, индуцируемый гипоксией». J. Biol. Chem. 278 (33): 30772–80. Дои:10.1074 / jbc.M304982200. PMID 12788921.
- ^ Макнил Л.А., Хьюитсон К.С., Глидл Дж.М., Хорсфолл Л.Е., Олдхэм Нью-Джерси, Максвелл П.Х., Пью К.В., Рэтклифф П.Дж., Шофилд С.Дж. (июнь 2002 г.). «Использование диоксида пролилгидроксилазой HIF (PHD1)». Биоорг. Med. Chem. 12 (12): 1547–50. Дои:10.1016 / S0960-894X (02) 00219-6. PMID 12039559.
- ^ Аббуд М.И., Макаллистер Т.Э., Люнг И.К., Чоудхури Р., Йоргенсен С., Домен С., Месинович Дж., Липпл К., Хэнкок Р.Л., Хопкинсон Р.Дж., Кавамура А., Кларидж ТДВ, Шофилд С.Дж. (март 2018 г.). «2-оксоглутарат регулирует связывание гидроксилированного фактора, индуцируемого гипоксией, с доменом 2 пролилгидроксилазы». Chem. Сообщество. 54 (25): 3130–3133. Дои:10.1039 / C8CC00387D. ЧВК 5885369. PMID 29522057.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Амельн А.К., Муштер А., Мамлук С., Калука Дж., Прад I, Франке К., Резаи М., Пойц Д.М., Брейер Дж., Уилокс Б. (май 2011 г.). «Ингибирование пролилгидроксилазы-2 HIF блокирует рост опухоли у мышей за счет антипролиферативной активности TGFβ». Рак Res. 71 (9): 3306–16. Дои:10.1158 / 0008-5472.CAN-10-3838. PMID 21436457.
- ^ Су И, Лоос М., Гизе Н., Метцен Э, Бюхлер М. В., Фрисс Х, Корнберг А., Бюхлер П. (февраль 2012 г.). «Пролилгидроксилаза-2 (PHD2) проявляет активность по подавлению опухоли при раке поджелудочной железы». Рак. 118 (4): 960–72. Дои:10.1002 / cncr.26344. PMID 21792862. S2CID 24482234.
- ^ Heindryckx F, Kuchnio A, Casteleyn C, Coulon S, Olievier K, Colle I, Geerts A, Libbrecht L, Carmeliet P, Van Vlierberghe H (июль 2012 г.). «Влияние гаплодефицита пролилгидроксилазного домена-2 на гепатоканцерогенез у мышей». J. Hepatol. 57 (1): 61–8. Дои:10.1016 / j.jhep.2012.02.021. PMID 22420978.
- ^ Камфуэс С., Виттшибер Д., Клаушен Ф., Касадзима А., Дитель М., Шмидт С.К., Гланеманн М., Бахра М., Нойхаус П., Вайхерт В., Стензингер А. (январь 2012 г.). «Белок домена 2 пролилгидроксилазы является сильным прогностическим маркером рака желудка человека». Патобиология. 79 (1): 11–17. Дои:10.1159/000330170. PMID 22236543.
- ^ Simonson TS, Yang Y, Huff CD, Yun H, Qin G, Witherspoon DJ, Bai Z, Lorenzo FR, Xing J, Jorde LB, Prchal JT, Ge R (июль 2010 г.). «Генетические свидетельства высотной адаптации в Тибете». Наука. 329 (5987): 72–5. Дои:10.1126 / science.1189406. PMID 20466884. S2CID 45471238.
- ^ Чинтала С., Наджрана Т., Тот К., Цао С., Дуррани Ф., Пили Р., Растум И. (2012). «Зависимая от пролилгидроксилазы 2 и независимая по фон-Хиппелю-Линдау деградация индуцируемого гипоксией фактора 1 и 2 альфа селеном в светлоклеточной почечно-клеточной карциноме приводит к ингибированию роста опухоли». BMC Рак. 12: 293. Дои:10.1186/1471-2407-12-293. ЧВК 3466155. PMID 22804960.
- ^ Flagg SC, Martin CB, Taabazuing CY, Holmes BE, Knapp MJ (август 2012 г.). «Скрининг ингибиторов хелатирования HIF-пролилгидроксилазы домена 2 (PHD2) и фактора, ингибирующего HIF (FIH)». J. Inorg. Биохим. 113: 25–30. Дои:10.1016 / j.jinorgbio.2012.03.002. ЧВК 3525482. PMID 22687491.
- ^ Чан М.С., Атасойлу О, Ходсон Э., Тамбер А, Люнг И.К., Чоудхури Р., Гомес-Перес В., Деметриадес М., Рыдзик А.М., Холт-Мартин Дж., Тиан Ю.М., Бишоп Т., Кларидж Т.Д., Кавамура А., Пью К.В., Рэтклифф PJ, Schofield CJ (июль 2015 г.). «Мощные и селективные триазольные ингибиторы пролилгидроксилаз, индуцируемых гипоксией, с активностью в мозге мышей». PLOS ONE. 6 (10): e0132004. Дои:10.1371 / journal.pone.0132004. ЧВК 4492579. PMID 26147748.
- ^ Квон Х.С., Чой Ю.К., Ким Дж.В., Пак Ю.К., Ян Э.Г., Ан Д.Р. (июль 2011 г.). «Ингибирование домена пролилгидроксилазы (PHD) пептидами-аналогами субстрата». Биоорг. Med. Chem. Латыш. 21 (14): 4325–8. Дои:10.1016 / j.bmcl.2011.05.050. PMID 21665470.
дальнейшее чтение
- Семенза Г.Л. (2001). «HIF-1, O (2) и 3 PHD: как клетки животных сигнализируют ядру о гипоксии». Ячейка. 107 (1): 1–3. Дои:10.1016 / S0092-8674 (01) 00518-9. PMID 11595178. S2CID 14922615.
- Wax SD, Tsao L, Lieb ME и др. (1996). «SM-20 представляет собой новый белок массой 40 кДа, экспрессия которого в стенке артерии ограничена гладкими мышцами». Лаборатория. Вкладывать деньги. 74 (4): 797–808. PMID 8606489.
- Тейлор М.С. (2001). «Характеристика и сравнительный анализ семейства генов EGLN». Ген. 275 (1): 125–32. Дои:10.1016 / S0378-1119 (01) 00633-3. PMID 11574160.
- Эпштейн А.С., Глидл Дж. М., Макнил Л.А. и др. (2001). «C. elegans EGL-9 и гомологи млекопитающих определяют семейство диоксигеназ, которые регулируют HIF путем пролилгидроксилирования». Ячейка. 107 (1): 43–54. Дои:10.1016 / S0092-8674 (01) 00507-4. PMID 11595184. S2CID 18372306.
- Oehme F, Ellinghaus P, Kolkhof P, et al. (2002). «Сверхэкспрессия PH-4, новой предполагаемой пролин-4-гидроксилазы, модулирует активность факторов транскрипции, индуцируемых гипоксией». Biochem. Биофиз. Res. Сообщество. 296 (2): 343–9. Дои:10.1016 / S0006-291X (02) 00862-8. PMID 12163023.
- Иван М., Хабербергер Т., Герваси Д.К. и др. (2002). «Биохимическая очистка и фармакологическое ингибирование пролилгидроксилазы млекопитающих, действующей на фактор, индуцируемый гипоксией». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 99 (21): 13459–64. Дои:10.1073 / pnas.192342099. ЧВК 129695. PMID 12351678.
- Strausberg RL, Feingold EA, Grouse LH, et al. (2003). «Создание и первоначальный анализ более 15 000 полноразмерных последовательностей кДНК человека и мыши». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 99 (26): 16899–903. Дои:10.1073 / pnas.242603899. ЧВК 139241. PMID 12477932.
- Метцен Э., Берхнер-Пфанншмидт У., Стенгель П. и др. (2003). «Внутриклеточная локализация альфа-гидроксилаз HIF-1 человека: влияние на восприятие кислорода». J. Cell Sci. 116 (Пт 7): 1319–26. Дои:10.1242 / jcs.00318. PMID 12615973.
- Cioffi CL, Liu XQ, Kosinski PA и др. (2003). «Дифференциальная регуляция генов HIF-1 альфа-пролил-4-гидроксилазы путем гипоксии в сердечно-сосудистых клетках человека». Biochem. Биофиз. Res. Сообщество. 303 (3): 947–53. Дои:10.1016 / S0006-291X (03) 00453-4. PMID 12670503.
- Апреликова О., Чандрамули Г.В., Вуд М. и др. (2004). «Регулирование пролилгидроксилаз HIF с помощью факторов, индуцируемых гипоксией». J. Cell. Биохим. 92 (3): 491–501. Дои:10.1002 / jcb.20067. PMID 15156561. S2CID 24455956.
- Аппельхофф Р.Дж., Тиан Ю.М., Раваль Р.Р. и др. (2004). «Дифференциальная функция пролилгидроксилаз PHD1, PHD2 и PHD3 в регуляции фактора, индуцируемого гипоксией». J. Biol. Chem. 279 (37): 38458–65. Дои:10.1074 / jbc.M406026200. PMID 15247232.
- Метцен Э., Штиль Д.П., Доге К. и др. (2006). «Регулирование гена белка 2 домена пролилгидроксилазы (phd2 / egln-1): идентификация функционального элемента, чувствительного к гипоксии». Biochem. J. 387 (Пт 3): 711–7. Дои:10.1042 / BJ20041736. ЧВК 1135001. PMID 15563275.
- Пэк Дж. Х., Махон П. С., О Дж. И др. (2005). «OS-9 взаимодействует с индуцируемым гипоксией фактором 1альфа и пролилгидроксилазами, способствуя кислородзависимой деградации HIF-1альфа». Мол. Ячейка. 17 (4): 503–12. Дои:10.1016 / j.molcel.2005.01.011. PMID 15721254.
- Озер А., Ву Л.К., Брюик Р.К. (2005). «Кандидат в опухолевые супрессоры ING4 подавляет активацию фактора, индуцируемого гипоксией (HIF)». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 102 (21): 7481–6. Дои:10.1073 / pnas.0502716102. ЧВК 1140452. PMID 15897452.
- Чой К.О., Ли Т., Ли Н. и др. (2006). «Ингибирование каталитической активности индуцируемого гипоксией фактора-1альфа-пролилгидроксилазы 2 цинковым пальцем MYND-типа». Мол. Pharmacol. 68 (6): 1803–9. Дои:10.1124 / моль.105.015271. PMID 16155211. S2CID 6673747.
- КК, Хуанг ЛЭ (2006). «ПОДАВЛЕНИЕ ТРАНСКРИПЦИОННОЙ АКТИВНОСТИ HIF-1α HIF PROLYL HYDROXYLASE EGLN1». J. Biol. Chem. 280 (45): 38102–7. Дои:10.1074 / jbc.M504342200. ЧВК 1307502. PMID 16157596.
- Като Х., Иноуэ Т., Асанома К. и др. (2006). «Индукция старения клеток рака эндометрия человека посредством модуляции активности HIF-1альфа с помощью EGLN1». Int. J. Рак. 118 (5): 1144–53. Дои:10.1002 / ijc.21488. PMID 16161047.