Гистидин декарбоксилаза - Histidine decarboxylase
| Гистидин декарбоксилаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Карикатура изображения C-усеченного димера HDC с PLP проживающие на активном сайте. | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 4.1.1.22 | ||||||||
| Количество CAS | 9024-61-7 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Гистидин декарбоксилаза (HDC) является фермент ответственный за катализирующий декарбоксилирование гистидин формировать гистамин. У млекопитающих гистамин является важным биогенный амин с регулирующими функциями в нейротрансмиссия, Желудочный сок секреция и иммунная реакция.[1][2] Гистидиндекарбоксилаза является единственным участником синтеза гистамина. путь, производя гистамин в одностадийной реакции. Гистамин не может быть произведен никаким другим известным ферментом.[3] Таким образом, HDC является основным источником гистамина в большинстве млекопитающие и эукариоты. Фермент использует пиридоксаль 5'-фосфат (PLP) кофактор, как и многие другие аминокислота декарбоксилазы.[4][5] Эукариоты, а также грамотрицательные бактерии использовать общий HDC, а грамположительные бактерии нанять эволюционно несвязанный пирувойл-зависимый HDC.[6] У человека гистидиндекарбоксилаза кодируется HDC ген.[2][7]
Структура

Гистидиндекарбоксилаза представляет собой пиридоксаль-зависимая декарбоксилаза группы II, вместе с декарбоксилаза ароматических L-аминокислот, и тирозиндекарбоксилаза. HDC выражается как 74 кДа полипептид который не является ферментативно функциональным.[8][9] Только после посттрансляционная обработка активизируется ли фермент. Эта обработка состоит из усечения большей части белка C-терминал цепь, восстанавливающая пептид молекулярный вес до 54 кДа.
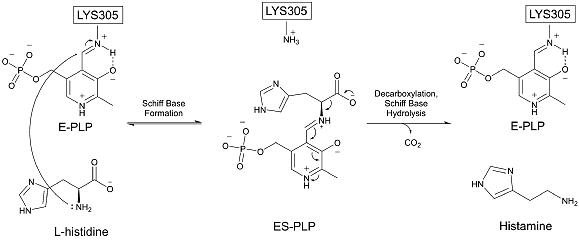
Гистидиндекарбоксилаза существует как гомодимер, с несколькими аминокислотами из соответствующей противоположной цепи, стабилизирующей HDC активный сайт. В состоянии покоя HDC PLP является ковалентно связанный в База Шиффа к лизин 305, и стабилизируется несколькими водородными связями с соседними аминокислотами. аспартат 273, серин 151 и серин 354 противоположной цепи.[8] HDC содержит несколько регионов, последовательно и структурно аналогичны таковым в ряде других пиридоксальзависимых декарбоксилаз.[10] Это особенно заметно в окрестности лизина активного центра 305.[11]
Механизм
HDC декарбоксилат гистидин за счет использования PLP кофактор первоначально связывается в основании Шиффа с лизином 305.[12] Гистидин инициирует реакция путем вытеснения лизина 305 и образования альдимин с PLP. Затем гистидин карбоксильная группа покидает субстрат, образуя углекислый газ. Это этап, ограничивающий скорость всего процесса, требующий энергии активации 17,6 ккал / моль. [13] и соответствует экспериментальному обороту 1,73 .[14] После декарбоксилирования промежуточный продукт PLP протонируется тирозином 334 из второй субъединицы. Протонирование опосредуется молекулой воды, оно очень быстрое и очень эксергоническое.[13] Наконец, PLP восстанавливает свое исходное основание Шиффа по лизину 305, и высвобождается гистамин. Этот механизм очень похож на те, которые используются другими пиридоксаль-зависимыми декарбоксилазами. В частности, промежуточный альдимин является общим признаком всех известных PLP-зависимых декарбоксилаз.[15] HDC очень специфичен для своего гистидинового субстрата.[16]
Биологическая значимость
Гистидиндекарбоксилаза является основным биологический источник гистамина. Гистамин - важный биогенный амин что сдерживает многочисленные физиологические процессы. Есть четыре разных гистамина рецепторы, ЧАС1, ЧАС2, ЧАС3, и ЧАС4,[3] каждый из которых имеет различное биологическое значение. ЧАС1 модулирует несколько функций центральный и периферическая нервная система, включая циркадный ритм, температура тела и аппетит.[17] ЧАС2 активация приводит к Желудочный сок секреция и гладкая мышца расслабление.[18][19] ЧАС3 контролирует оборот гистамина подавление обратной связи гистамина синтез и отпустить.[20] Наконец, H4 играет роль в тучных клетках хемотаксис и цитокин производство.[17]
У человека HDC в первую очередь экспрессируется в тучные клетки и базофил гранулоциты. Соответственно, эти клетки содержать высшее тело концентрации гистамина гранулы. Гистамин немастоцитов также обнаружен в мозг, где он используется как нейротрансмиттер.[21]
Торможение
HDC может быть подавленный к α-фторметилгистидин и метиловый эфир гистидина.[22][23]
Клиническое значение
Антигистаминные препараты являются классом лекарства разработан для уменьшения нежелательного воздействия гистамина на организм. Типичные антигистаминные препараты специфически блокируют гистаминовые рецепторы в зависимости от того, какой физиологической цели они служат. Например, дифенгидрамин (Бенадрил ™), нацеливается и ингибирует гистаминовый рецептор H1 для облегчения симптомы из аллергические реакции.[24] Ингибиторы гистидиндекарбоксилазы предположительно могут использоваться как атипичные антигистаминные препараты. Тритоквалин, а также различные катехины, Такие как эпигаллокатехин-3-галлат, основной компонент зеленый чай, было показано, что нацелены на HDC и гистамин-продуцирующие клетки, снижая уровень гистамина и обеспечивая противовоспалительное средство, противоопухолевый, и антиангиогенный последствия.[25]
Мутации в гене гистидиндекарбоксилазы наблюдались в одной семье с синдром Туретта (TS) и, как считается, не учитывают большинство случаев TS.[26]
Смотрите также
- Ароматическая декарбоксилаза L-аминокислот
- Тирозин декарбоксилаза
- Декарбоксилирование
- Гистамин
- Антигистаминный
- Пиридоксаль 5'-фосфат
- Тучная клетка
Рекомендации
- ^ Эппс ХМ (1945). «Исследования бактериальных декарбоксилаз аминокислот: 4. 1 (-) - гистидиндекарбоксилаза из Cl. Welchii типа A». Биохимический журнал. 39 (1): 42–6. Дои:10.1042 / bj0390042. ЧВК 1258146. PMID 16747851.
- ^ а б «Entrez Gene: гистидиндекарбоксилаза».
- ^ а б Шахид, Мохаммад (2009). «Гистамин, гистаминовые рецепторы и их роль в иммуномодуляции: обновленный систематический обзор» (PDF). Открытый журнал иммунологии. 2: 9–41. Дои:10.2174/1874226200902010009.
- ^ Райли У. Д., Снелл Э. Э. (октябрь 1968 г.). «Гистидиндекарбоксилаза Lactobacillus 30a. IV. Наличие ковалентно связанного пирувата в качестве простетической группы». Биохимия. 7 (10): 3520–8. Дои:10.1021 / bi00850a029. PMID 5681461.
- ^ Rosenthaler J, Guirard BM, Chang GW, Snell EE (июль 1965 г.). «Очистка и свойства гистидиндекарбоксилазы из Lactobacillus 30a». Труды Национальной академии наук Соединенных Штатов Америки. 54 (1): 152–8. Дои:10.1073 / пнас.54.1.152. ЧВК 285813. PMID 5216347.
- ^ Кимура Б., Такахаши Х., Хокимото С., Танака И., Фуджи Т. (август 2009 г.). «Индукция генов гистидиндекарбоксилазы Photobacterium damselae subsp. Damselae (формально P. histaminum) при низком pH». Журнал прикладной микробиологии. 107 (2): 485–97. Дои:10.1111 / j.1365-2672.2009.04223.x. PMID 19302297.
- ^ Bruneau G, Nguyen VC, Gros F, Bernheim A, Thibault J (ноябрь 1992 г.). «Получение пробы кДНК гистидиндекарбоксилазы головного мозга крысы (HDC) с помощью ПЦР и отнесение гена HDC человека к хромосоме 15». Генетика человека. 90 (3): 235–8. Дои:10.1007 / bf00220068. PMID 1487235.
- ^ а б c Комори Х., Нитта Й., Уэно Х., Хигучи Й. (август 2012 г.). «Структурное исследование показывает, что Ser-354 определяет субстратную специфичность гистидиндекарбоксилазы человека». Журнал биологической химии. 287 (34): 29175–83. Дои:10.1074 / jbc.M112.381897. ЧВК 3436558. PMID 22767596.
- ^ Нитта, Йоко (2010). «Экспрессия рекомбинантной гистидиндекарбоксилазы человека с полноразмерными и усеченными с С-конца формами в дрожжевых и бактериальных клетках» (PDF). J. Biol. Макромол. 10.
- ^ Джексон, Ф. Роб (1990-10-01). «Прокариотические и эукариотические пиридоксаль-зависимые декарбоксилазы гомологичны». Журнал молекулярной эволюции. 31 (4): 325–329. Дои:10.1007 / BF02101126. ISSN 0022-2844.
- ^ Сандмайер Э., Хейл Т.И., Кристен П. (май 1994 г.). «Множественное эволюционное происхождение пиридоксаль-5'-фосфат-зависимых декарбоксилаз аминокислот». Европейский журнал биохимии. 221 (3): 997–1002. Дои:10.1111 / j.1432-1033.1994.tb18816.x. PMID 8181483.
- ^ а б Ву Ф, Ю Дж, Геринг Х (март 2008 г.). «Ингибирующие и структурные исследования новых аналогов кофермента-субстрата гистидиндекарбоксилазы человека». Журнал FASEB. 22 (3): 890–7. Дои:10.1096 / fj.07-9566com. PMID 17965265.
- ^ а б Фернандес Х.С., Рамос М.Дж., Серкейра Н.М. (июль 2017 г.). «Каталитический механизм пиридоксаль-5'-фосфат-зависимого фермента, гистидиндекарбоксилазы: компьютерное исследование». Химия. 23 (38): 9162–9173. Дои:10.1002 / chem.201701375. PMID 28613002.
- ^ Комори Х., Нитта Й., Уэно Х., Хигучи Й. (август 2012 г.). «Структурное исследование показывает, что Ser-354 определяет субстратную специфичность гистидиндекарбоксилазы человека». Журнал биологической химии. 287 (34): 29175–83. Дои:10.1074 / jbc.m112.381897. ЧВК 3436558. PMID 22767596.
- ^ «Пиридоксальфосфат-зависимая декарбоксилаза». ИнтерПро.
- ^ Тони MD (январь 2005 г.). «Специфичность реакции пиридоксальфосфатных ферментов». Архивы биохимии и биофизики. Выделите вопрос о ферментных механизмах. 433 (1): 279–87. Дои:10.1016 / j.abb.2004.09.037. PMID 15581583.
- ^ а б Панула П., Чазот П.Л., Коварт М., Гутцмер Р., Леурс Р., Лю В.Л., Старк Х., Турмонд Р.Л., Хаас Х.Л. (июль 2015 г.). "Международный союз фундаментальной и клинической фармакологии. XCVIII. Гистаминовые рецепторы". Фармакологические обзоры. 67 (3): 601–55. Дои:10.1124 / пр.114.010249. ЧВК 4485016. PMID 26084539.
- ^ Canonica GW, Blaiss M (февраль 2011 г.). «Антигистаминные, противовоспалительные и противоаллергические свойства не вызывающего седативного эффекта антигистаминного препарата второго поколения дезлоратадина: обзор доказательств». Журнал Всемирной организации аллергии. 4 (2): 47–53. Дои:10.1097 / WOX.0b013e3182093e19. ЧВК 3500039. PMID 23268457.
- ^ Хилл, С.Дж. (1997). «Классификация гистаминовых рецепторов». Фармакологические обзоры. 49: 253–278 - через ASPET.
- ^ West RE, Zweig A, Shih NY, Siegel MI, Egan RW, Clark MA (ноябрь 1990 г.). «Идентификация двух подтипов H3-гистаминовых рецепторов». Молекулярная фармакология. 38 (5): 610–3. PMID 2172771.
- ^ Бландина П., Мунари Л., Провенси Г., Пассани МБ (01.01.2012). «Гистаминовые нейроны в туберомамиллярном ядре: целый центр или отдельные субпопуляции?». Границы системной нейробиологии. 6: 33. Дои:10.3389 / fnsys.2012.00033. ЧВК 3343474. PMID 22586376.
- ^ Август Т.Ф., Муссон Д.Г., Хван СС, Дагган Д.Е., Гук К.Ф., Роман И.Дж., Фергюсон Р.Дж., Бейн В.Ф. (август 1985 г.). «Биоанализ и утилизация альфа-фторметилгистидина, нового ингибитора гистидиндекарбоксилазы». Журнал фармацевтических наук. 74 (8): 871–5. Дои:10.1002 / jps.2600740814. PMID 4032273.
- ^ Lane RS, Manning JM, Snell EE (сентябрь 1976 г.). «Гистидиндекарбоксилаза Lactobacillus 30a: инактивация и мечение активных сайтов метиловым эфиром L-гистидина». Биохимия. 15 (19): 4180–5. Дои:10.1021 / bi00664a008. PMID 963031.
- ^ «Дифенгидрамина гидрохлорид». Drugs.com.
- ^ Мельгарехо Э., Медина М.А., Санчес-Хименес Ф., Урдиалес Ю.Л. (сентябрь 2010 г.). «Нацеливание на клетки, продуцирующие гистамин, с помощью EGCG: зеленый стрелок против воспаления?». Журнал физиологии и биохимии. 66 (3): 265–70. Дои:10.1007 / s13105-010-0033-7. PMID 20652470.
- ^ «Интернет-менделевское наследование в человеке: гистидиндекарбоксилаза».
дальнейшее чтение
- Need AC, Keefe RS, Ge D, Grossman I., Dickson S, McEvoy JP, Goldstein DB (июль 2009 г.). «Фармакогенетика антипсихотического ответа в исследовании CATIE: анализ генов-кандидатов». Европейский журнал генетики человека. 17 (7): 946–57. Дои:10.1038 / ejhg.2008.264. ЧВК 2986499. PMID 19156168.
- Мазини Е., Фабброни В., Джаннини Л., Ванначчи А., Мессерини Л., Перна Ф., Кортезини С., Чианки Ф. (апрель 2005 г.). «Повышение регуляции гистамина и гистидиндекарбоксилазы при колоректальном раке: корреляция со стадией опухоли» (PDF). Исследование воспаления. 54 Дополнение 1: S80–1. Дои:10.1007 / s00011-004-0437-3. HDL:2158/762726. PMID 15928846.
- Ли З, Лю Дж, Тан Ф, Лю Ю, Уолдум Х.Л., Цуй Джи (декабрь 2008 г.). «Экспрессия немачтовых клеток гистидиндекарбоксилазы в связанных с опухолью микрососудах в плоскоклеточных карциномах пищевода человека». APMIS. 116 (12): 1034–42. Дои:10.1111 / j.1600-0463.2008.01048.x. PMID 19133005.
- Шафрански К., Шиндлер С., Таудиен С., Хиллер М., Хусе К., Ян Н., Шрайбер С., Бакофен Р., Платцер М. (2007). «Нарушение правил сплайсинга: динуклеотиды TG функционируют как альтернативные 3'-сайты сплайсинга в U2-зависимых интронах». Геномная биология. 8 (8): R154. Дои:10.1186 / gb-2007-8-8-r154. ЧВК 2374985. PMID 17672918.
- Ай В., Лю И., Ланглуа М., Ван Т.С. (март 2004 г.). «Kruppel-подобный фактор 4 (KLF4) подавляет экспрессию гена гистидиндекарбоксилазы посредством расположенного выше сайта Sp1 и нижестоящих элементов, чувствительных к гастрину». Журнал биологической химии. 279 (10): 8684–93. Дои:10.1074 / jbc.M308278200. PMID 14670968.
- Raychowdhury R, Fleming JV, McLaughlin JT, Bulitta CJ, Wang TC (октябрь 2002 г.). «Идентификация и характеристика третьего элемента ответа гастрина (GAS-RE3) в промоторе гена гистидиндекарбоксилазы человека». Сообщения о биохимических и биофизических исследованиях. 297 (5): 1089–95. Дои:10.1016 / S0006-291X (02) 02345-8. PMID 12372397.
- Кимура К., Вакамацу А., Судзуки Ю., Ота Т., Нисикава Т., Ямасита Р., Ямамото Дж., Секин М., Цуритани К., Вакагури Х., Исии С., Сугияма Т., Сайто К., Исоно Ю., Ирие Р., Кушида Н., Йонеяма Т. , Otsuka R, Kanda K, Yokoi T, Kondo H, Wagatsuma M, Murakawa K, Ishida S, Ishibashi T, Takahashi-Fujii A, Tanase T, Nagai K, Kikuchi H, Nakai K, Isogai T, Sugano S (январь 2006 г. ). «Диверсификация транскрипционной модуляции: широкомасштабная идентификация и характеристика предполагаемых альтернативных промоторов генов человека». Геномные исследования. 16 (1): 55–65. Дои:10.1101 / гр. 4039406. ЧВК 1356129. PMID 16344560.
- Скёльдберг Ф., Портела-Гомес ГМ, Гримелиус Л., Нильссон Дж., Перхеентупа Дж., Беттерле С., Хусебай Е.С., Густафссон Дж., Рённблом А., Рорсман Ф., Кампе О. (апрель 2003 г.). «Гистидиндекарбоксилаза, пиридоксальфосфат-зависимый фермент, является аутоантигеном энтерохромаффиноподобных клеток желудка». Журнал клинической эндокринологии и метаболизма. 88 (4): 1445–52. Дои:10.1210 / jc.2002-021761. PMID 12679420.
- Brew O, Lakasing L, Sullivan M (2007). «Дифференциальная активность гистидиндекарбоксилазы в нормальной и преэкламптической плаценте». Плацента. 28 (5–6): 585–7. Дои:10.1016 / j.placenta.2006.05.003. PMID 16822545.
- Чжан Ф., Сюн Д.Х., Ван В., Шен Х., Сяо П., Ян Ф., Рекер Р.Р., Дэн Х.В. (октябрь 2006 г.). «Полиморфизм гена HDC связан с возрастом наступления естественной менопаузы у кавказских женщин». Сообщения о биохимических и биофизических исследованиях. 348 (4): 1378–82. Дои:10.1016 / j.bbrc.2006.08.008. ЧВК 1803761. PMID 16919600.
- Типпенс А.С., Gruetter CA (июнь 2004 г.). «Обнаружение мРНК гистидиндекарбоксилазы в гладких мышцах сосудов человека и эндотелиальных клетках». Исследование воспаления. 53 (6): 215–6. Дои:10.1007 / s00011-004-1252-6. PMID 15167966.
- Сизен С.Л., Бонт Л., Ходемакерс Х.М., Эрмерс М.Дж., Дорнбос Дж., Вант Слот Р., Вейменга С., Хаувелинген Х.С., Кимпен Д.Л., Кимман Т.Г., Хоби Б., Янссен Р. (апрель 2009 г.). «Генетическая предрасположенность к респираторно-синцитиальному вирусному бронхиолиту у недоношенных детей связана с генами ремоделирования дыхательных путей и генами врожденного иммунитета». Журнал детских инфекционных болезней. 28 (4): 333–5. Дои:10.1097 / INF.0b013e31818e2aa9. PMID 19258923.
- Морган Т.К., Монтгомери К., Мейсон В., Западный РБ, Ван Л., Ван де Рейн М., Хиггинс Дж. П. (июль 2006 г.). «Повышение экспрессии гистидиндекарбоксилазы в поверхностных корковых нефронах во время беременности у мышей и женщин». Kidney International. 70 (2): 306–14. Дои:10.1038 / sj.ki.5001553. PMID 16760908.
- Пападопулу Н., Калогеромитрос Д., Стаурианеас Н.Г., Тиблалекси Д., Теохаридис Т.С. (ноябрь 2005 г.). «Экспрессия рецептора-1 рилизинг-гормона кортикотропина и гистидиндекарбоксилазы при хронической крапивнице». Журнал следственной дерматологии. 125 (5): 952–5. Дои:10.1111 / j.0022-202X.2005.23913.x. PMID 16297195.
- Янссен Р., Бонт Л., Сизен С.Л., Ходемакерс Х.М., Эрмерс М.Дж., Дорнбос Г., ван 'т Слот Р., Вейменга С., Гоеман Дж.Дж., Кимпен Дж.Л., ван Хаувелинген Х.С., Кимман Т.Г., Хоби Б. (сентябрь 2007 г.). «Генетическая предрасположенность к респираторно-синцитиальному вирусному бронхиолиту преимущественно связана с генами врожденного иммунитета». Журнал инфекционных болезней. 196 (6): 826–34. Дои:10.1086/520886. PMID 17703412.
- Strausberg RL, Feingold EA, Grouse LH, Derge JG, Klausner RD, Collins FS, et al. (Декабрь 2002 г.). «Создание и первоначальный анализ более 15 000 полноразмерных последовательностей кДНК человека и мыши». Труды Национальной академии наук Соединенных Штатов Америки. 99 (26): 16899–903. Дои:10.1073 / pnas.242603899. ЧВК 139241. PMID 12477932.
- Aichberger KJ, Mayerhofer M, Vales A, Krauth MT, Gleixner KV, Bilban M, Esterbauer H, Sonneck K, Florian S, Derdak S, Pickl WF, Agis H, Falus A, Sillaber C, Valent P (ноябрь 2006 г.). «Связанный с ХМЛ онкопротеин BCR / ABL индуцирует экспрессию гистидиндекарбоксилазы (HDC) и синтез гистамина в лейкозных клетках». Кровь. 108 (10): 3538–47. Дои:10.1182 / кровь-2005-12-028456. PMID 16849647.
- Ли Дж. К., Ким Х. Т., Чо С. М., Ким К. Х., Джин Х. Дж., Рю ГМ, О Би, Пак Си, Ким К, Чо С. А., Чон С. К., Ким С., Ин SM, Ли Дж. «Характеристика 458 однонуклеотидных полиморфизмов генов-кандидатов болезней в корейской популяции». Журнал генетики человека. 48 (5): 213–6. Дои:10.1007 / s10038-003-0011-9. PMID 12768436.
- Jeong HJ, Moon PD, Kim SJ, Seo JU, Kang TH, Kim JJ, Kang IC, Um JY, Kim HM, Hong SH (апрель 2009 г.). «Активация индуцируемого гипоксией фактора-1 регулирует экспрессию гистидиндекарбоксилазы человека». Клеточные и молекулярные науки о жизни. 66 (7): 1309–19. Дои:10.1007 / s00018-009-9001-1. PMID 19266161.
внешняя ссылка
- Гистидин + декарбоксилаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
Эта статья включает текст из Национальная медицинская библиотека США, который находится в всеобщее достояние.