Тучная клетка - Mast cell
| Тучная клетка | |
|---|---|
 Тучные клетки | |
| Подробности | |
| Система | Иммунная система |
| Идентификаторы | |
| латинский | мастоцит |
| MeSH | D008407 |
| TH | H2.00.03.0.01010 |
| FMA | 66784 |
| Анатомические термины микроанатомии | |
А тучная клетка (также известный как мастоцит или лаброцит[1]) представляет собой мигрирующую клетку соединительной ткани, которая содержит много гранулы богат в гистамин и гепарин. В частности, это разновидность гранулоцит полученный из миелоидные стволовые клетки это часть невосприимчивый и нейроиммунный системы. Тучные клетки были открыты Пол Эрлих в 1877 г.[2] Хотя наиболее известен своей ролью в аллергия и анафилаксия, тучные клетки также играют важную защитную роль, принимая непосредственное участие в заживлении ран, ангиогенез, иммунная толерантность, защита от патогены и проницаемость сосудов при опухолях головного мозга.[3][4]
Тучная клетка по внешнему виду и функциям очень похожа на базофил, другой тип лейкоцит. Хотя когда-то считалось, что тучные клетки являются резидентными в тканях базофилами, было показано, что эти две клетки развиваются из разных кроветворный линии и, следовательно, не могут быть одними и теми же клетками.[5]
Структура


Тучные клетки очень похожи на базофильные гранулоциты (класс белые кровяные клетки ) в кровь. Обе гранулированные клетки содержат гистамин и гепарин, антикоагулянт. Их ядра отличаются тем, что ядро базофила долбил в то время как ядро тучных клеток круглое. В Fc регион из иммуноглобулин E (IgE) связывается с тучными клетками и базофилами, и когда паратопы IgE связываются с антигеном, это заставляет клетки высвобождать гистамин и другие медиаторы воспаления.[6] Эти сходства заставили многих предположить, что тучные клетки - это базофилы, которые «прижились» к тканям. Кроме того, у них есть общий предшественник в Костный мозг выражая CD34 молекула. Базофилы покидают костный мозг уже зрелыми, тогда как тучные клетки циркулируют в незрелой форме, созревая только один раз на участке ткани. Место, в котором поселяется незрелая тучная клетка, вероятно, определяет ее точные характеристики.[7] Первую дифференцировку и рост чистой популяции тучных клеток мышей проводили in vitro с использованием кондиционированной среды, полученной из спленоцитов, стимулированных конканавалином А.[8] Позже было обнаружено, что происходящее из Т-клеток интерлейкин 3 был компонентом, присутствующим в кондиционированной среде, который требовался для дифференцировки и роста тучных клеток.[9]
Тучные клетки у грызунов классически делятся на два подтипа: соединительная ткань -типа тучные клетки и слизистая оболочка тучные клетки. Деятельность последних зависит от Т-клетки.[10]
Тучные клетки присутствуют в большинстве тканей, характерно окружающих кровеносные сосуды и нервы, и особенно заметны вблизи границ между внешним миром и внутренней средой, например кожа, слизистая оболочка легкие, и пищеварительный тракт, так же хорошо как рот, конъюнктива, и нос.[7]
Функция

Тучные клетки играют ключевую роль в воспалительном процессе. При активации тучная клетка может либо избирательно высвобождать (частичная дегрануляция) или быстро отпустить (анафилактическая дегрануляция) "медиаторов" или соединений, вызывающих воспаление, от хранения гранулы в местную микросреду.[3][11] Тучные клетки можно стимулировать к дегранулировать к аллергены через сшивание с иммуноглобулин E рецепторы (например, FcεRI ), телесные повреждения из-за рецепторы распознавания образов за молекулярные паттерны, связанные с повреждениями (DAMPs), микробные патогены через рецепторы распознавания образов для патоген-ассоциированные молекулярные паттерны (PAMP), и различные соединения через их ассоциированные Рецепторы, сопряженные с G-белком (например, морфин через опиоидные рецепторы ) или же ионные каналы, управляемые лигандами.[3][11] Белки комплемента может активировать мембранные рецепторы на тучных клетках, чтобы также выполнять различные функции.[7]
Тучные клетки экспрессируют высокоаффинный рецептор (FcεRI ) для Fc-области IgE, наименее распространенного члена антител. Этот рецептор имеет такое высокое сродство, что связывание молекул IgE по существу необратимо. В результате тучные клетки покрываются IgE, который продуцируется плазматические клетки (продуцирующие антитела клетки иммунной системы). IgE-антитела обычно специфичны к одному конкретному антиген.
При аллергических реакциях тучные клетки остаются неактивными до аллерген связывается с IgE, уже нанесенным на клетку. Другие события активации мембраны могут либо примировать тучные клетки для последующей дегрануляции, либо действовать в синергии с передачей сигнала FcεRI.[12] Как правило, аллергены белки или же полисахариды. Аллерген связывается с антигенсвязывающими сайтами, которые расположены на вариабельных участках молекул IgE, связанных с поверхностью тучных клеток. Похоже, что связывание двух или более молекул IgE (перекрестное связывание) необходимо для активации тучной клетки. Кластеризация внутриклеточных доменов связанных с клеткой рецепторов Fc, которые связаны со сшитыми молекулами IgE, вызывает сложную последовательность реакций внутри тучной клетки, которая приводит к ее активации. Хотя эта реакция наиболее хорошо изучена с точки зрения аллергии, похоже, что она превратилась в систему защиты от паразитов и бактерий.[13]
Медиаторы тучных клеток
Уникальный, специфичный для стимула набор медиаторов тучных клеток высвобождается посредством дегрануляции после активации рецепторы клеточной поверхности на тучных клетках.[11] Примеры медиаторов, которые высвобождаются во внеклеточную среду во время дегрануляции тучных клеток, включают:[7][11][14]
- сериновые протеазы, Такие как триптаза и химаза
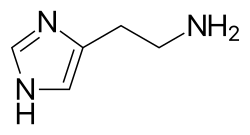
- гистамин (2–5 пикограммы на тучную клетку)
- серотонин
- протеогликаны, в основном гепарин (активен как антикоагулянт ) и немного хондроитинсульфат протеогликаны
- аденозинтрифосфат (АТФ)
- лизосомальные ферменты
- новообразованные липидные медиаторы (эйкозаноиды ):
- цитокины
- активные формы кислорода
Гистамин расширяет посткапиллярные венулы, активирует эндотелий, и увеличивает проницаемость кровеносных сосудов. Это приводит к местным отек (отек), тепло, покраснение и притяжение других воспалительных клеток к месту высвобождения. Он также деполяризует нервные окончания (ведущий к зуд или же боль ). Кожные признаки высвобождения гистамина - это «вспышка и волдырь "-реакция. Шишка и покраснение сразу после укуса комара являются хорошим примером этой реакции, которая возникает через несколько секунд после заражения тучной клетки аллергеном.[7]
Другие физиологические действия тучных клеток изучены гораздо меньше. Несколько линий доказательств предполагают, что тучные клетки могут играть довольно фундаментальную роль в врожденный иммунитет: Они способны вырабатывать широкий спектр важных цитокинов и других медиаторов воспаления, таких как TNFa; они выражают множественные «рецепторы распознавания образов», которые, как считается, участвуют в распознавании широких классов патогенов; и мыши без тучных клеток кажутся гораздо более восприимчивыми к различным инфекциям.[нужна цитата ]
Гранулы тучных клеток содержат множество биологически активных химикатов. Было обнаружено, что эти гранулы переносятся в соседние клетки иммунной системы и нейроны в процессе трансгрануляции через тучные клетки псевдоподия.[15]
В нервной системе
в отличие от других гемопоэтические клетки из иммунная система, тучные клетки естественным образом встречаются в человеческий мозг где они взаимодействуют с нейроиммунная система.[4] В головном мозге тучные клетки расположены в ряде структур, которые опосредуют висцеральные сенсорные функции (например, боль) или нейроэндокринный функции или расположенные вдоль барьер между кровью и спинномозговой жидкостью, в том числе стебель гипофиза, шишковидная железа, таламус, и гипоталамус, область пострема, сосудистое сплетение, а в дюралюминиевом слое мозговые оболочки около менингеального ноцицепторы.[4] Тучные клетки выполняют одни и те же общие функции в организме и центральной нервной системе, такие как воздействие или регулирование аллергических реакций, врожденный и адаптивный иммунитет, аутоиммунитет, и воспаление.[4][16] Во всех системах тучные клетки служат основными эффекторная клетка через которые патогены могут влиять на ось кишечник – мозг.[17][18]
В кишечнике
В желудочно-кишечном тракте тучные клетки слизистой оболочки расположены в непосредственной близости от сенсорных нервных волокон, которые взаимодействуют двунаправленно.[19][17][18] Когда эти тучные клетки первоначально дегранулируют, они выделяют медиаторы (например, гистамин, триптазу и серотонин), которые активируют, сенсибилизируют и активизировать экспрессию мембран из ноцицепторы (т.е. TRPV1 ) на висцеральном афферентные нейроны через свои рецепторы (соответственно HRH1, HRH2, HRH3, PAR2, 5-HT3 );[19] в свою очередь нейрогенное воспаление, висцеральная гиперчувствительность, и нарушение моторики кишечника (т.е. ослабленный перистальтика ) результат.[19] Активация нейронов индуцирует нейропептиды (вещество P и пептид, связанный с геном кальцитонина ) передача сигналов тучным клеткам, где они связываются с ассоциированными с ними рецепторы и запускают дегрануляцию определенного набора медиаторов (β-гексозаминидаза, цитокины, хемокины, PGD2, лейкотриены, и эоксины ).[19][11]
Физиология

Структура высокоаффинного рецептора IgE, FcεR1
FcεR1 представляет собой высокоаффинный IgE-рецептор, который экспрессируется на поверхности тучной клетки. FcεR1 представляет собой тетрамер, состоящий из одной альфа (α) цепи, одной бета (β) цепи и двух идентичных, связанных дисульфидной связью гамма (γ) цепей. Сайт привязки для IgE образован внеклеточной частью α-цепи, содержащей два домена, подобных Ig. Один трансмембранный домен содержит аспарагиновая кислота остаток, а один содержит короткий цитоплазматический хвост.[20] Β-цепь содержит единственный иммунорецепторный мотив активации на основе тирозина. ITAM, в цитоплазматической области. Каждая γ-цепь имеет одну ITAM на цитоплазматической области. Сигнальный каскад от рецептора инициируется, когда ITAM β и γ цепей фосфорилируются тирозином. Этот сигнал необходим для активации тучных клеток.[21] Т-хелперы типа 2, (Чт2 ) и многие другие типы клеток не имеют β-цепи, поэтому передача сигналов обеспечивается только γ-цепью. Это происходит из-за того, что α-цепь содержит сигналы удерживания в эндоплазматическом ретикулуме, что приводит к тому, что α-цепи остаются разрушенными в ER. Сборка α-цепи с котрансфицированными β- и γ-цепями маскирует удержание ER и позволяет экспортировать α β γ-комплекс в аппарат Гольджи к плазматической мембране у крыс. У людей только комплекс γ необходим, чтобы уравновесить удержание ER α цепи.[20]
Аллергенный процесс
Опосредованные аллергеном сигналы перекрестного связывания FcεR1 очень похожи на сигнальное событие, приводящее к связыванию антигена с лимфоциты. В Лин тирозинкиназа связан с цитоплазматическим концом β-цепи FcεR1. Антиген перекрестно связывает молекулы FcεR1, а тирозинкиназа Lyn фосфорилирует ITAM в β- и γ-цепях FcεR1 в цитоплазме. На фосфорилирование, то Сык тирозинкиназа рекрутируется в ITAM, расположенные на γ-цепях. Это вызывает активацию тирозинкиназы Syk, вызывая ее фосфорилирование.[21] Syk действует как сигнал, усиливающий киназную активность, поскольку он нацелен на несколько белков и вызывает их активацию.[22] Этот антиген стимулированное фосфорилирование вызывает активацию других белков в FcεR1-опосредованном сигнальном каскаде.[23]
Дегрануляция и синтез
Важным адаптерным белком, активируемым на стадии фосфорилирования Syk, является линкер для активации Т-клеток (LAT). LAT может быть модифицирован путем фосфорилирования для создания новых сайтов связывания.[22] Фосфолипаза C гамма (PLCγ) становится фосфорилированным после связывания с LAT, а затем используется для катализа разложения фосфатидилинозитолбисфосфата с образованием трифосфат инозита (IP3) и диациглицерин (DAG). IP3 повышает уровень кальция, а DAG активирует протеинкиназа C (PKC). Это не единственный способ создания PKC. Тирозинкиназа FYN фосфорилаты Grb2-ассоциированный связывающий белок 2 (Gab2), который связывается с фосфоинозитид-3-киназа, который активирует PKC. PKC приводит к активации движений гранул фосфорилирования легких цепей миозина, которые расщепляют актин-миозиновые комплексы, позволяя гранулы вступать в контакт с плазматической мембраной.[21] Гранула тучных клеток теперь может предохранитель с плазматической мембраной. Растворимый рецептор слитого белка, чувствительного к N-этилмалеимиду SNARE комплекс опосредует этот процесс. Различные белки SNARE взаимодействуют с образованием разных комплексов, катализирующих слияние. Rab3 гуанозинтрифосфатазы и Rab-ассоциированные киназы и фосфатазы регулируют слияние мембран гранул в покоящихся тучных клетках.
MRGPRX2 - рецептор тучных клеток
Человеческий рецептор MRGPRX2, связанный с G-белком, специфичный для тучных клеток, играет ключевую роль в распознавании молекулярных паттернов, ассоциированных с патогенами (PAMP), и инициирует антибактериальный ответ. MRGPRX2 способен связываться со стимулирующим компетентность пептидом (CSP) 1 - молекулой, чувствительной к кворуму (QSM), продуцируемой грамположительными бактериями. Это приводит к передаче сигнала к белку G и активации тучной клетки. Активация тучных клеток индуцирует высвобождение антибактериальных медиаторов, включая ROS, TNF-α и PRGD2, которые запускают рекрутирование других иммунных клеток для ингибирования роста бактерий и образования биопленок.
Рецептор MRGPRX является возможной терапевтической мишенью и может быть фармакологически активирован с использованием агониста 48/80 для борьбы с бактериальной инфекцией. Также предполагается, что другие QSM и даже грамотрицательные бактериальные сигналы могут активировать этот рецептор. Это может быть особенно важно во время Бартонелла хронические инфекции, при которых в симптоматике человека ясно видно, что у всех этих пациентов есть синдром активации тучных клеток из-за наличия еще не определенной молекулы, воспринимающей кворум (сам базальный гистамин?). Эти пациенты предрасположены к пищевой непереносимости, обусловленной другим, менее специфическим путем, чем путь рецептора IgE: безусловно, путем MRGPRX2. У этих пациентов также наблюдается циклическая патология кожи и дермографизм каждый раз, когда бактерии выходят из своего скрытого внутриклеточного местоположения.
Ферменты
| Фермент | Функция |
|---|---|
| Лин тирозинкиназа | Фосфорилирует ITAM в цепях FcεR1 β и γ в цитоплазме. Это заставляет Syk тирозинкиназу привлекаться к ITAMS, расположенным на γ-цепях. Это вызывает активацию тирозинкиназы Syk, в результате чего она фосфорилируется. |
| Сык тирозинкиназа | Нацеливается на несколько белков и вызывает их активацию |
| Фосфолипаза C | Катализирует фосфатидилинозитол-4,5-бисфосфат |
| Инозитол трифосфат | Повышает уровень кальция |
| Диацилглицерин | Активирует протеинкиназу С |
| FYN | Фосфорилаты GAB2 |
| GAB2 | Связывается с фосфоинозитид-3-киназой |
| Фосфоинозитид-3-киназа | Активирует протеинкиназу С |
| Протеинкиназа C | Активирует движения гранул фосфорилирования легкой цепи миозина, которые разрушают актин-миозиновые комплексы |
| Rab-ассоциированные киназы и фосфатазы | Регулировать слияние мембран клеточных гранул в покоящихся тучных клетках |
Клиническое значение
Паразитарные инфекции
Тучные клетки активируются в ответ на инфекцию патогенными паразитами, такими как некоторые гельминты и простейшие, через IgE сигнализация.
Нарушения активации тучных клеток
Нарушения активации тучных клеток (MCAD) представляют собой спектр иммунные нарушения которые не связаны с патогенной инфекцией и включают аналогичные симптомы, возникающие из-за секретируемых промежуточных продуктов тучных клеток, но немного отличаются по своим патофизиология, подход к лечению и отличительные симптомы.[24][25] Классификация нарушений активации тучных клеток была заложена в 2010 году.[24][25]
Аллергическая болезнь
Аллергия опосредуется IgE сигнализация, которая запускает дегрануляцию тучных клеток.[24]
Многие формы кожи и слизистых оболочек аллергия в значительной степени опосредуются тучными клетками; они играют центральную роль в астма, экзема, зуд (по разным причинам), и аллергический ринит и аллергический конъюнктивит. Антигистаминный лекарства действуют, блокируя гистамин действие на нервные окончания. Кромогликат лекарственные препараты (кромогликат натрия, недокромил) блокируют кальциевый канал, необходимый для дегрануляции тучных клеток, стабилизации клетки и предотвращения высвобождения гистамина и родственных медиаторов. Антагонисты лейкотриенов (Такие как монтелукаст и зафирлукаст ) блокируют действие медиаторов лейкотриена и все чаще используются при аллергических заболеваниях.[7]
Кальций запускает секрецию гистамина из тучных клеток после предыдущего воздействия фторида натрия. Секреторный процесс можно разделить на стадию активации фторида и секреторную стадию, индуцированную кальцием. Было замечено, что стадия активации фтором сопровождается повышением циклический аденозинмонофосфат (цАМФ) уровни в клетках. Достигнутые высокие уровни цАМФ сохраняются во время высвобождения гистамина. Кроме того, было обнаружено, что катехоламины существенно не изменяют индуцированное фторидом высвобождение гистамина. Было также подтверждено, что второй, но не первый этап секреции гистамина, вызванной фторидом натрия, ингибируется теофиллином.[26] Расширение сосудов и повышенная проницаемость капилляров являются результатом действия рецепторов как H1, так и H2.[27]
Стимуляция гистамина активирует аденилатциклазу кислородных клеток, чувствительную к гистамину (Н2), и происходит быстрое увеличение клеточного [цАМФ], которое участвует в активации транспорта Н + и других связанных изменениях оксинтических клеток.[28]
Анафилаксия
В анафилаксия (тяжелая системная реакция на аллергены (например, орехи, пчелиные укусы или лекарства), дегрануляция тучных клеток по всему телу приводит к расширению сосудов и, в тяжелых случаях, к симптомам, угрожающим жизни шок.[нужна цитата ]
Гистамин является сосудорасширяющим веществом, высвобождаемым во время анафилаксии.[27]
Аутоиммунитет
Тучные клетки могут быть вовлечены в патологию, связанную с аутоиммунными воспалительными заболеваниями суставов. Было показано, что они участвуют в привлечении воспалительных клеток в суставы (например, ревматоидный артрит ) и кожа (например, буллезный пемфигоид ), и эта активность зависит от антител и компонентов комплемента.[29]
Мастоцитоз и клональные нарушения
Эта секция нуждается в расширении. Вы можете помочь добавляя к этому. (Октябрь 2015) |
Мастоцитоз является редким заболеванием клональных тучных клеток, включающим присутствие слишком большого количества тучных клеток (мастоциты) и CD34 + предшественники тучных клеток.[30] Мутации в c-Kit связаны с мастоцитозом.[24]
Моноклональные расстройства
Эта секция нуждается в расширении. Вы можете помочь добавляя к этому. (Октябрь 2015) |
Неопластические расстройства
Мастоцитомы или опухоли тучных клеток, могут секретировать чрезмерное количество продуктов дегрануляции.[24][25] Их часто можно увидеть у собак и кошек.[31] Другой новообразования связанные с тучными клетками, включают саркома тучных клеток и лейкоз тучных клеток.
Синдром активации тучных клеток
Синдром активации тучных клеток (MCAS) - это идиопатический иммунное расстройство что включает в себя повторяющиеся и избыточные тучные клетки дегрануляция и который вызывает симптомы, подобные другим нарушениям активации тучных клеток.[24][25] Синдром диагностируется на основе четырех наборов критериев, включающих реакцию на лечение, симптомы и дифференциальная диагностика, и биомаркеры дегрануляции тучных клеток.[24][25]
История
Тучные клетки впервые были описаны Пол Эрлих в его 1878 г. докторская диссертация на основе их уникальных характеристик окрашивания и крупных гранул. Эти гранулы также привели его к неправильному убеждению, что они существуют для питания окружающей ткани, поэтому он назвал их Mastzellen (из Немецкий Мачта «откорм», как у животных).[32][33] Теперь они считаются частью иммунная система.
Исследование
Аутизм
Исследование иммунологического вклада в аутизм предполагает, что расстройство аутистического спектра (РАС) у детей могут быть «аллергические» проблемы при отсутствии повышенного уровня сывороточного IgE и хронических заболеваниях. крапивница, что предполагает неаллергическую активацию тучных клеток в ответ на триггеры окружающей среды и стресса. Эта активация тучных клеток может способствовать воспалению мозга и проблемам нервного развития.[34]
Гистологическое окрашивание
Толуидиновый синий: одно из самых распространенных пятен от кислоты мукополисахариды и гликоаминогликаны, компоненты гранул тучных клеток.[35]
Бисмарк коричневый: окрашивает гранулы тучных клеток в коричневый цвет.[36]
Поверхностные маркеры: маркеры клеточной поверхности тучных клеток подробно обсуждались Heneberg,[37] утверждая, что тучные клетки могут быть непреднамеренно включены в изоляты стволовых клеток или клеток-предшественников, поскольку часть из них является положительной по антигену CD34. Классические маркеры тучных клеток включают высокоаффинный рецептор IgE, CD117 (c-Kit) и CD203c (для большинства популяций тучных клеток). Экспрессия некоторых молекул может изменяться в процессе активации тучных клеток.[38]
Смотрите также
- Аллергия
- Диаминоксидаза
- Гранулоцит
- Непереносимость пищи
- Гистамин
- Непереносимость гистамина
- Гистамин N-метилтрансфераза или HNMT
Рекомендации
- ^ «лаброциты». Мемидекс. Архивировано из оригинал 6 ноября 2018 г.. Получено 19 февраля 2011.
- ^ Эрлих, Пауль (1878). "Beiträge zur Theorie und Praxis der Histologischen Färbung". Лейпцигский университет.
- ^ а б c да Силва Э.З., Джамур М.С., Оливер С. (2014). «Функция тучных клеток: новое видение старой клетки». J. Histochem. Cytochem. 62 (10): 698–738. Дои:10.1369/0022155414545334. ЧВК 4230976. PMID 25062998.
Тучные клетки могут распознавать патогены с помощью различных механизмов, включая прямое связывание патогенов или их компонентов с рецепторами PAMP на поверхности тучных клеток, связывание антител или бактерий, покрытых комплементом, с рецепторами комплемента или иммуноглобулина или распознавание эндогенных пептидов, продуцируемых инфицированными или поврежденными клетками. (Хофманн и Абрахам, 2009). Характер экспрессии этих рецепторов значительно варьируется среди разных подтипов тучных клеток. TLR (1-7 и 9), NLR, RLR и рецепторы комплемента ответственны за большинство врожденных ответов тучных клеток.
- ^ а б c d Polyzoidis S, Koletsa T, Panagiotidou S, Ashkan K, Theoharides TC (2015). «Тучные клетки при менингиомах и воспалении головного мозга». J нейровоспаление. 12 (1): 170. Дои:10.1186 / s12974-015-0388-3. ЧВК 4573939. PMID 26377554.
MC происходят от предшественника костного мозга и впоследствии развивают различные фенотипические характеристики локально в тканях. Их спектр функций широк и включает участие в аллергических реакциях, врожденном и адаптивном иммунитете, воспалении и аутоиммунитете [34]. В головном мозге человека MC могут располагаться в различных областях, таких как гипофиз, эпифиз, постремная зона, сосудистое сплетение, таламус, гипоталамус и срединное возвышение [35]. В мозговых оболочках они обнаруживаются в слое твердой мозговой оболочки вместе с сосудами и окончаниями ноцицепторов менингеальных сосудов [36]. MC имеют отличительную особенность по сравнению с другими гематопоэтическими клетками в том, что они находятся в головном мозге [37]. MC содержат множество гранул и секретируют множество предварительно сохраненных медиаторов, таких как кортикотропин-рилизинг-гормон (CRH), нейротензин (NT), вещество P (SP), триптаза, химаза, вазоактивный кишечный пептид (VIP), фактор роста эндотелия сосудов (VEGF) , TNF, простагландины, лейкотриены и разновидности хемокинов и цитокинов, некоторые из которых, как известно, нарушают целостность гематоэнцефалического барьера (BBB) [38-40].
[Ключевая роль MCs в воспалении [34] и разрушении ГЭБ [41–43]) указывает на важность областей для новых исследований в области терапии. Все больше данных также указывает на то, что MC участвуют в нейровоспалении напрямую [44–46] и через стимуляцию микроглии [47], внося свой вклад в патогенез таких состояний, как головные боли [48] аутизм [49] и синдром хронической усталости [50]. Фактически, недавний обзор показал, что периферические воспалительные стимулы могут вызывать активацию микроглии [51], таким образом, возможно, вовлекая MC вне мозга. - ^ Франко CB, Chen CC, Drukker M, Weissman IL, Galli SJ (2010). «Различение дифференцировки тучных клеток и гранулоцитов на одноклеточном уровне». Стволовая клетка. 6 (4): 361–8. Дои:10.1016 / j.stem.2010.02.013. ЧВК 2852254. PMID 20362540.
- ^ Мариеб Э. Н., Хоэн К. (2004). Анатомия и физиология человека (6-е изд.). Сан-Франциско: Пирсон Бенджамин Каммингс. п.805. ISBN 978-0-321-20413-4.
- ^ а б c d е ж Пруссин С., Меткалф Д.Д. (февраль 2003 г.). «4. IgE, тучные клетки, базофилы и эозинофилы». Журнал аллергии и клинической иммунологии. 111 (2 доп.): S486–94. Дои:10.1067 / mai.2003.120. ЧВК 2847274. PMID 12592295.
- ^ Разин Е, Кордон-Кардо C, Good RA (апрель 1981 г.). «Рост чистой популяции тучных клеток мышей in vitro с кондиционированной средой, полученной из спленоцитов, стимулированных конканавалином А». Труды Национальной академии наук Соединенных Штатов Америки. 78 (4): 2559–61. Bibcode:1981PNAS ... 78.2559R. Дои:10.1073 / pnas.78.4.2559. ЧВК 319388. PMID 6166010.CS1 maint: несколько имен: список авторов (связь)
- ^ Разин Э., Иле Дж. Н., Селдин Д. и др. (Март 1984 г.). «Интерлейкин 3: фактор дифференцировки и роста тучных клеток мыши, содержащий хондроитинсульфат E протеогликан». Журнал иммунологии. 132 (3): 1479–86. PMID 6198393.
- ^ Денбург Дж. А. (1998). Аллергия и аллергические заболевания: новые механизмы и методы лечения. Тотова, Нью-Джерси: Humana Press. ISBN 978-0-89603-404-4.[страница нужна ]
- ^ а б c d е Moon TC, Бефус А.Д., Кулька М (2014). «Медиаторы тучных клеток: их дифференциальное высвобождение и задействованные секреторные пути». Фронт Иммунол. 5: 569. Дои:10.3389 / fimmu.2014.00569. ЧВК 4231949. PMID 25452755.
Для MC были описаны два типа дегрануляции: частичная дегрануляция (PMD) и анафилактическая дегрануляция (AND) (Рисунки 1 и 2). И PMD, и AND встречаются in vivo, ex vivo и in vitro в MC у человека (78–82), мыши (83) и крысы (84). PMD - это избирательное высвобождение частей содержимого гранул без слияния гранул с гранулами и / или гранул с плазматической мембраной. ... В отличие от PMD, AND - это взрывное высвобождение содержимого гранул или целых гранул за пределы клеток после слияния гранул с гранулами и / или гранул с плазматической мембраной (Рисунки 1 и 2). Ультраструктурные исследования показывают, что И начинается с набухания гранул и изменения матрикса после соответствующей стимуляции (например, сшивания FcεRI).
Рисунок 1: Высвобождение медиатора из тучных клеток В архиве 29 апреля 2018 г. Wayback Machine
Рисунок 2: Модель генеза секреторных гранул тучных клеток В архиве 29 апреля 2018 г. Wayback Machine
Рисунок 3: Биогенез липидных тел В архиве 29 апреля 2018 г. Wayback Machine
Таблица 2: Селективное к стимулам высвобождение медиатора из тучных клеток В архиве 29 апреля 2018 г. Wayback Machine - ^ Пулендран Б., Оно SJ (май 2008 г.). «Укол в руку по тучным клеткам». Nat. Med. 14 (5): 489–90. Дои:10,1038 / нм0508-489. PMID 18463655.
- ^ Ли Дж, Витч С.Л., Бэрд Б., Холовка Д. (2012). «Молекулярные механизмы спонтанной и направленной подвижности тучных клеток». J. Leukoc. Биол. 92 (5): 1029–41. Дои:10.1189 / jlb.0212091. ЧВК 3476239. PMID 22859829.
- ^ Эшмол I, Брэддинг П. (май 2013 г.). «Ионные каналы, регулирующие биологию тучных клеток». Clin. Exp. Аллергия. 43 (5): 491–502. Дои:10.1111 / cea.12043. PMID 23600539.
Рецепторы P2X представляют собой неселективные катионные каналы, управляемые лигандами, которые активируются внеклеточным АТФ. ... Повышенные локальные концентрации АТФ, вероятно, будут присутствовать вокруг тучных клеток в воспаленных тканях из-за его высвобождения в результате повреждения или гибели клеток и активации тромбоцитов [40]. Более того, сами тучные клетки хранят АТФ в секреторных гранулах, который высвобождается при активации [41]. Следовательно, существует возможность значительного притока Ca2 + в тучные клетки через рецепторы P2X. Члены семейства P2X различаются как по концентрации АТФ, необходимой для активации, так и по степени десенсибилизации после активации агониста [37, 38]. Это открывает возможность того, что путем экспрессии ряда различных рецепторов P2X тучные клетки могут быть способны адаптировать свой ответ на АТФ в зависимости от концентрации [37].
- ^ Вильгельм М., Сильвер Р., Сильверман А. Дж. (Ноябрь 2005 г.). «Нейроны центральной нервной системы приобретают продукты тучных клеток посредством трансгрануляции». Европейский журнал нейробиологии. 22 (9): 2238–48. Дои:10.1111 / j.1460-9568.2005.04429.x. ЧВК 3281766. PMID 16262662.
- ^ Ren H, Han R, Chen X, Liu X, Wan J, Wang L, Yang X, Wang J (май 2020 г.). «Возможные терапевтические цели для воспаления, связанного с внутримозговым кровоизлиянием: обновление». J Cereb Blood Flow Metab. Дои:10.1177 / 0271678X20923551. PMID 32423330.
- ^ а б Будзыньски Я., Клопоцка М (2014). «Ось мозг-кишечник в патогенезе инфекции Helicobacter pylori». Мир J. Гастроэнтерол. 20 (18): 5212–25. Дои:10.3748 / wjg.v20.i18.5212. ЧВК 4017036. PMID 24833851.
В пищеварительной ткани H. pylori может изменять передачу сигналов в оси мозг-кишечник тучными клетками, которые являются эффектором основной оси мозг-кишечник.
- ^ а б Каработти М., Сирокко А., Маселли М.А., Севери С. (2015). «Ось кишечник-мозг: взаимодействие между кишечной микробиотой, центральной и кишечной нервной системами». Энн Гастроэнтерол. 28 (2): 203–209. ЧВК 4367209. PMID 25830558.
- ^ а б c d Воутерс М.М., Викарио М., Сантос Дж. (2015). «Роль тучных клеток в функциональных расстройствах ЖКТ». Кишечник. 65 (1): 155–168. Дои:10.1136 / gutjnl-2015-309151. PMID 26194403.
Функциональные желудочно-кишечные расстройства (FGID) характеризуются хроническими жалобами, возникающими из-за неорганизованных взаимодействий между мозгом и кишечником, ведущих к нарушению моторики и гиперчувствительности. Двумя наиболее распространенными FGID, которыми страдают до 16–26% населения мира, являются функциональная диспепсия и синдром раздраженного кишечника. ... Хорошо известно, что активация тучных клеток может вызывать эпителиальную и нервно-мышечную дисфункцию и способствовать висцеральной гиперчувствительности и измененным паттернам моторики при FGID, послеоперационной кишечной непроходимости, пищевой аллергии и воспалительных заболеваниях кишечника.
▸ Тучные клетки играют центральную патофизиологическую роль при СРК и, возможно, в функциональной диспепсии, хотя и не совсем четко.
▸ Повышенная активация тучных клеток - частая находка на слизистой оболочке пациентов с функциональными расстройствами желудочно-кишечного тракта. ...
▸ Лечение стабилизаторами тучных клеток предлагает достаточно безопасный и многообещающий вариант ведения пациентов с СРК, не отвечающих на традиционные подходы, хотя для оценки эффективности и показаний необходимы будущие исследования. - ^ а б Кинет JP (1999). «Высокоаффинный рецептор IgE (FcεRI): от физиологии к патологии». Ежегодный обзор иммунологии. 17: 931–72. Дои:10.1146 / annurev.immunol.17.1.931. PMID 10358778.
- ^ а б c Аббас А.К., Лихтман А.Х., Пиллай С. (2011). «Роль тучных клеток, базофилов и эозинофилов в немедленной гиперчувствительности». Клеточная и молекулярная иммунология (7-е изд.). Нью-Йорк, штат Нью-Йорк: Эльзевир. ISBN 978-1-4377-1528-6.[страница нужна ]
- ^ а б Ривера Дж., Кордеро Дж. Р., Фурумото Ю. и др. (Сентябрь 2002 г.). «Макромолекулярные белковые сигнальные комплексы и ответы тучных клеток: взгляд на организацию IgE-зависимой передачи сигналов тучных клеток». Молекулярная иммунология. 38 (16–18): 1253–8. Дои:10.1016 / S0161-5890 (02) 00072-X. PMID 12217392.
- ^ Ли В., Динин Г.Г., Марголис Б., Шлессингер Дж., Оливер Дж. М. (июль 1992 г.). «FcεR1-опосредованное фосфорилирование тирозина множества белков, включая фосфолипазу Cγ1 и рецепторный βγ2 комплекс, в клетках базофильного лейкоза крыс RBL-2H3». Молекулярная и клеточная биология. 12 (7): 3176–82. Дои:10.1128 / MCB.12.7.3176. ЧВК 364532. PMID 1535686.
- ^ а б c d е ж грамм Фриери М (2018). «Синдром активации тучных клеток». Clin Rev Allergy Immunol. 54 (3): 353–365. Дои:10.1007 / s12016-015-8487-6. PMID 25944644.
Таблица 1
Классификация заболеваний, связанных с активацией тучных клеток из Akin et al. [14]
1. Первичная
а. Анафилаксия с ассоциированным заболеванием клональных тучных клеток
б. Синдром активации моноклональных тучных клеток (MMAS), см. Текст для объяснения
2. Среднее
а. Аллергические расстройства
б. Активация тучных клеток, связанная с хроническими воспалительными или неопластическими заболеваниями
c. Физическая крапивница (требуется первичная стимуляция)
d. Хроническая аутоиммунная крапивница
3. Идиопатический (когда документально подтверждена дегрануляция тучных клеток; может быть первичной или вторичной. Ангионевротический отек может быть связан с наследственным или приобретенным ангионевротическим отеком, где он может быть независимым от тучных клеток и быть результатом генерации кининов)
а. Анафилаксия
б. Ангионевротический отек
c. Крапивница
d. Синдром активации тучных клеток (MCAS) ...
Рецидивирующая идиопатическая анафилаксия проявляется аллергическими признаками и симптомами - крапивницей и ангионевротическим отеком, которые являются отличительной особенностью - устраняет идентифицируемую аллергическую этиологию, учитывает мастоцитоз и карциноидный синдром и лечится антигистаминными препаратами H1 и H2, эпинефрином и стероидами [21, 22]. - ^ а б c d е Акин С., Валент П., Меткалф Д.Д. (2010). «Синдром активации тучных клеток: предлагаемые диагностические критерии». J. Allergy Clin. Иммунол. 126 (6): 1099–104.e4. Дои:10.1016 / j.jaci.2010.08.035. ЧВК 3753019. PMID 21035176.
- ^ Alm PE (апрель 1983 г.). «Фторид натрия вызывает высвобождение гистамина из тучных клеток. Исследование уровней циклического АМФ и эффектов катехоламинов». Агенты и действия. 13 (2–3): 132–7. Дои:10.1007 / bf01967316. PMID 6191542.
- ^ а б Дахман В.Д., Бедарида Г., Блашке Т.Ф., Хоффман Б.Б. (март 1994 г.). «Гистамин-индуцированная венодиляция у человека включает подтипы рецепторов H1 и H2». Журнал аллергии и клинической иммунологии. 93 (3): 606–14. Дои:10.1016 / S0091-6749 (94) 70072-9. PMID 8151062.
- ^ Machen TE, Rutten MJ, Ekblad EB (февраль 1982 г.). «Гистамин, цАМФ и активация слизистой оболочки желудка поросят». Американский журнал физиологии. 242 (2): G79–84. Дои:10.1152 / ajpgi.1982.242.2.G79. PMID 6175225.
- ^ Ли Д.М., Друг Д.С., Гуриш М.Ф., Бенуа С., Матис Д., Бреннер МБ (сентябрь 2002 г.). «Тучные клетки: клеточная связь между аутоантителами и воспалительным артритом». Наука. 297 (5587): 1689–92. Bibcode:2002Научный ... 297.1689L. Дои:10.1126 / science.1073176. PMID 12215644.
- ^ Horny HP, Сотлар К., Валент П. (2007). «Мастоцитоз: современное состояние». Патобиология. 74 (2): 121–32. Дои:10.1159/000101711. PMID 17587883.
- ^ «Кожные опухоли тучных клеток». Ветеринарное руководство Merck. 2006. В архиве из оригинала 23 мая 2007 г.. Получено 8 июля 2007.
- ^ Эрлих П. (1878). Beiträge zur Theorie und Praxis der histologischen Färbung [Вклад в теорию и практику гистологических красителей] (Диссертация) (на немецком языке). Лейпцигский университет. OCLC 63372150.
- ^ «Мастоцит - Определение». Архивировано из оригинал 3 февраля 2010 г.. Получено 16 августа 2010.[требуется полная цитата ]
- ^ Теохаридес Т.С., Ангелиду А., Алисандратос К.Д. и др. (Январь 2012 г.). «Активация тучных клеток и аутизм». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1822 (1): 34–41. Дои:10.1016 / j.bbadis.2010.12.017. PMID 21193035.
- ^ Блюменкранц Н, Асбоэ-Хансен Г (май 1975 г.). «Селективная окраска тучных клеток». Гистохимический журнал. 7 (3): 277–82. Дои:10.1007 / BF01003596. PMID 47855.
- ^ Томов, Н .; Димитров, Н. (2017). «Модифицированное окрашивание по Бисмарку коричневым для демонстрации тучных клеток мягких тканей» (PDF). Научный журнал Тракия. 15 (3): 195–197. Дои:10.15547 / tjs.2017.03.001.
- ^ Хенеберг П. (ноябрь 2011 г.). «Тучные клетки и базофилы: троянские кони обычных изолятов стволовых клеток / клеток-предшественников». Текущий фармацевтический дизайн. 17 (34): 3753–71. Дои:10.2174/138161211798357881. PMID 22103846.
- ^ Лебдуска П., Корб Дж., Томова М., Хенеберг П., Драбер П. (декабрь 2007 г.). «Топография сигнальных молекул, обнаруженная с помощью электронной микроскопии на листах плазматической мембраны, изолированных от неприлипающих тучных клеток». Журнал иммунологических методов. 328 (1–2): 139–51. Дои:10.1016 / j.jim.2007.08.015. PMID 17900607.
внешняя ссылка
- Маст + клетки в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
