Пентахлорид сурьмы - Antimony pentachloride
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Имена ИЮПАК Пентахлорид сурьмы Хлорид сурьмы (V) | |||
| Другие имена Хлорид сурьмы Перхлорид сурьмы | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.729 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| |||
| |||
| Характеристики | |||
| Cl5Sb | |||
| Молярная масса | 299.01 г · моль−1 | ||
| Внешность | бесцветная или красновато-желтая (дымящая) жидкость маслянистая | ||
| Запах | острый, зловонный | ||
| Плотность | 2,336 г / см3 (20 ° С)[1] 2,36 г / см3 (25 ° С)[2] | ||
| Температура плавления | 2,8 ° С (37,0 ° F, 275,9 К) | ||
| Точка кипения | 140 ° С (284 ° F, 413 К) разлагается от 106 ° C[3] 79 ° С (174 ° F, 352 К) при 22 мм рт. ст.[1] 92 ° С (198 ° F, 365 К) при 30 мм рт. ст.[2] | ||
| реагирует | |||
| Растворимость | растворим в алкоголь, HCl, Винная кислота, CHCl3, CS2, CCl4 | ||
| Растворимость в оксихлорид селена (IV) | 62,97 г / 100 г (25 ° С) | ||
| Давление газа | 0,16 кПа (25 ° C) 4 кПа (40 ° C) 7,7 кПа (100 ° C)[4] | ||
| -120.0·10−6 см3/ моль | |||
| 1.59255 | |||
| Вязкость | 2,034 сП (29,4 ° С)[1] 1,91 сП (35 ° C) | ||
| Структура | |||
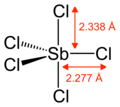
| Тригональный бипирамидный | |||
| 0 D | |||
| Термохимия | |||
Теплоемкость (C) | 120,9 Дж / моль · К (газ)[3] | ||
Стандартный моляр энтропия (S | 295 Дж / моль · К[3] | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -437,2 кДж / моль[3] | ||
Свободная энергия Гиббса (Δжграмм˚) | -345,35 кДж / моль[3] | ||
| Опасности | |||
| Пиктограммы GHS |   [2] [2] | ||
| Сигнальное слово GHS | Опасность | ||
| H314, H411[2] | |||
| P273, P280, P305 + 351 + 338, P310[2] | |||
| Вдыхание опасность | Токсичный | ||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 77 ° С (171 ° F, 350 К) | ||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | 1115 мг / кг (крыса, перорально)[3] | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 0,5 мг / м3 (как Sb)[5] | ||
REL (Рекомендуемые) | TWA 0,5 мг / м3 (как Sb)[5] | ||
| Родственные соединения | |||
Другой анионы | Пентафторид сурьмы | ||
Другой катионы | Пентахлорид фосфора | ||
Родственные соединения | Трихлорид сурьмы | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Пентахлорид сурьмы представляет собой химическое соединение с формулой SbCl5. Это бесцветное масло, но типичные образцы желтоватого цвета из-за примесей. Из-за его склонности к гидролизовать к соляная кислота, SbCl5 является очень агрессивным веществом и должен храниться в стекле или PTFE контейнеры.
Подготовка и состав
Пентахлорид сурьмы получают путем пропускания газообразный хлор в расплавленный трихлорид сурьмы:
- SbCl3 + Cl2 → SbCl5
Газообразный SbCl5 имеет тригонально-бипирамидное строение.[6]
Реакции
Пентахлорид сурьмы гидролизуется с образованием соляная кислота и сурьма оксихлориды. Эта реакция подавляется в присутствии большого избытка хлорида из-за образования гексахлорантимоната. комплексный ион:
- SbCl5 + Cl− → [SbCl6]−
Известны моно- и тетрагидраты, SbCl5·ЧАС2O и SbCl5· 4H2О.
Это соединение образует аддукты со многими основаниями Льюиса. SbCl5 это мягкая кислота Льюиса и это Модель ECW параметры EА = 3.64 и CА = 10,42. Используется как стандартная кислота Льюиса в Шкала Гутмана основности Льюиса.[7] Тем не мение, Графики Крамера-Боппа показывают, что однопараметрическая шкала основности неполна и что не существует единого рангового порядка базовой силы. Эти графики показывают, что для определения порядка силы основания Льюиса (или силы кислоты Льюиса) необходимо учитывать по крайней мере два свойства.[8][9]
Это также сильный окислитель.[10]
Приложения
Пентахлорид сурьмы используется как полимеризация катализатор и для хлорирование органических соединений.
Меры предосторожности
Пентахлорид сурьмы - очень коррозионное вещество, которое следует хранить вдали от источников тепла и влаги. Это хлорирующий агент, который в присутствии влаги выделяет газообразный хлористый водород. Из-за этого он может травить даже инструменты из нержавеющей стали (например, иглы), если обращаться с ним во влажной атмосфере. Не следует работать с нефторированными пластиками (например, пластиковыми шприцами, пластиковыми перегородками или иглами с пластиковыми фитингами), поскольку они плавятся и обугливаются.[11]
Рекомендации
- ^ а б c «Пентахлорид сурьмы (UK PID)».
- ^ а б c d е Сигма-Олдрич Ко., Хлорид сурьмы (V). Проверено 29 мая 2014.
- ^ а б c d е ж «Хлорид сурьмы (V)».
- ^ Пентахлорид сурьмы в Linstrom, Peter J .; Маллард, Уильям Г. (ред.); Веб-книга NIST Chemistry, стандартная справочная база данных NIST номер 69, Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд), http://webbook.nist.gov (Дата обращения 29 мая 2014)
- ^ а б Карманный справочник NIOSH по химической опасности. "#0036". Национальный институт охраны труда и здоровья (NIOSH).
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ В. Гутманн (1976). «Влияние растворителей на химическую активность металлоорганических соединений». Coord. Chem. Ред. 18 (2): 225–255. Дои:10.1016 / S0010-8545 (00) 82045-7.
- ^ Лоуренс, К., Гал, Ж.-Ф. Шкалы основности и сродства Льюиса, данные и измерения, (Wiley 2010), стр. 50-51, IBSN 978-0-470-74957-9
- ^ Cramer, R.E .; Бопп, Т. Т. (1977). «Графическое отображение энтальпий образования аддуктов для кислот и оснований Льюиса». Журнал химического образования. 54: 612–613. Дои:10.1021 / ed054p612. На графиках, представленных в этом документе, использовались более старые параметры. Улучшенные параметры E&C перечислены в Модель ECW.
- ^ Коннелли, Н.Г .; Гейгер, В. Э. (1996). «Химические окислительно-восстановительные агенты для металлоорганической химии». Chem. Ред. 96 (2): 877–922. Дои:10.1021 / cr940053x. PMID 11848774.
- ^ Шекарчи, М .; Бехбахани, Ф.К. Катал. Lett. 2017 147 2950. DOI: 10.1007 / s10562-017-2194-2
внешняя ссылка
| Этот неорганический сложный –Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |