Хлорид ртути (I) - Mercury(I) chloride
 | |
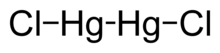 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Димеркурия дихлорид | |
| Другие имена | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.030.266 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 3077 |
| |
| |
| Характеристики | |
| Hg2Cl2 | |
| Молярная масса | 472,09 г / моль |
| Внешность | Белое твердое вещество |
| Плотность | 7,150 г / см3 |
| Температура плавления | 525 ° С (977 ° F, 798 К) (тройная точка) |
| Точка кипения | 383 ° С (721 ° F, 656 К) (сублимированные) |
| 0,2 мг / 100 мл | |
| Растворимость | не растворим в этиловый спирт, эфир |
| −26.0·10−6 см3/ моль | |
| 1.973 | |
| Опасности | |
| Паспорт безопасности | ICSC 0984 |
Классификация ЕС (DSD) (устарело) | Токсичный (Т) Вредный (Xn) Опасно для окружающей среды (N) |
| R-фразы (устарело) | R22, R36 / 37/38, R50 / 53 |
| S-фразы (устарело) | (S2), S13, S24 / 25, S46, S60, S61 |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 210 мг / кг (крыса, перорально)[1] |
| Термохимия | |
Стандартный моляр энтропия (S | 196 Дж · моль−1· K−1[2] |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −265 кДж · моль−1[2] |
| Родственные соединения | |
Другой анионы | Фторид ртути (I) Бромид ртути (I) Иодид ртути (I) |
Родственные соединения | Хлорид ртути (II) |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Хлорид ртути (I) это химическое соединение с формулой Hg2Cl2. Также известен как минеральная каломель[3] (редкий минерал) или хлорид ртути, это плотное белое или желтовато-белое твердое вещество без запаха является основным примером Меркурий (I) соединение. Это компонент электроды сравнения в электрохимия.[4][5]
История
Считается, что название каломель произошло от Греческий καλός красивая, а μέλας чернить; или καλός и μέλι медовый от его сладкого вкуса.[3] В чернить название (несколько неожиданное для белого соединения), вероятно, связано с его характеристикой непропорциональность реакция с аммиак, дающий «эффектный» черный цвет за счет мелкодисперсного металлического Меркурий сформирован. Его также называют минералом рог ртуть или же рог ртути.[3]
Каломель принимали внутрь и использовали как слабительное,[3] например лечить Георгий III в 1801 году и дезинфицирующим средством, а также при лечении сифилиса до начала 20 века. До недавнего времени[когда? ] он также использовался в качестве садового фунгицида, особенно в качестве корневого окунания, чтобы предотвратить возникновение кила среди сельскохозяйственных культур семьиBrassicaceae.[6]
Ртуть стала популярным лекарством от множества физических и психических заболеваний в возрасте "героическая медицина ". Он использовался врачами в Америке на протяжении 18 века и во время революции, чтобы заставить пациентов срыгивать и освободить свое тело от" нечистот ". Бенджамин Раш был одним из самых известных защитников ртути в медицине и использовал каломель для лечения больных желтая лихорадка во время его вспышки в Филадельфия в 1793 г. Каломель давали пациентам в качестве слабительное или же катарсис до тех пор, пока у них не началось выделение слюны, и их часто вводили пациентам в таком большом количестве, что у них выпадали волосы и зубы.[7]
Вскоре после того, как желтая лихорадка поразила Филадельфию, болезнь вспыхнула на Ямайке. В прессе разразилась война слов о лучшем лечении желтой лихорадки: кровотечении; или каломель. По неподтвержденным данным, каломель была более эффективной, чем кровотечение.[8]
Мормонский пророк Джозеф Смит старший брат Элвин Смит умер в 1823 г. от отравления ртутью из каломели.[нужна цитата ]
Льюис и Кларк принесли с собой чудо-лекарство дня, хлорид ртути (также известный как каломель), в виде пилюли, настойки, и мазь. Современные исследователи использовали ту самую ртуть, найденную глубоко в уборная ямы, чтобы проследить местоположение их соответствующих местоположений и кемпингов.[9]
Характеристики
Ртуть является уникальной среди металлов группы 12 своей способностью так легко образовывать связь M – M. Hg2Cl2 представляет собой линейную молекулу. Минеральная каломель кристаллизуется в четырехугольный система, с пространственной группой I4 / м 2 / м 2 / м. В ячейка из Кристальная структура показано ниже:
 | 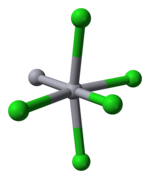 |
Длина связи Hg – Hg составляет 253 пм (Hg – Hg в металле 300 пм), а длина связи Hg – Cl в линейной Hg2Cl2 единица 243 пм.[10] Общая координация каждого атома Hg октаэдрическая, так как, помимо двух ближайших соседей, есть еще четыре атома Cl в 321 пм. Дольше поликатионы ртути существовать.
Подготовка и реакции
Хлорид ртути образуется при реакции элементарной ртути и хлорида ртути:
- Hg + HgCl2 → Hg2Cl2
Его можно приготовить через реакция метатезиса с участием водных нитрат ртути (I) с использованием различных источников хлорида, включая NaCl или HCl.
- 2 HCl + Hg2(НЕТ3)2 → Hg2Cl2 + 2 HNO3
Аммиак вызывает Hg2Cl2 к непропорционально:
- Hg2Cl2 + 2 NH3 → Hg + Hg (NH2) Cl + NH4Cl
Каломельный электрод
Хлорид ртути широко применяется в электрохимия, благодаря легкости его реакций окисления и восстановления. Каломельный электрод представляет собой электрод сравнения, особенно в старых публикациях. За последние 50 лет на смену ему пришел электрод серебро / хлорид серебра (Ag / AgCl). Хотя от ртутных электродов отказались из-за опасного характера Меркурий, многие химики считают, что они все же более точны и не опасны при правильном обращении. Различия экспериментальных потенциалов мало отличаются от литературных значений. Другие электроды могут варьироваться от 70 до 100 милливольт.[нужна цитата ]
Фотохимия
Хлорид ртути разлагается на хлорид ртути (II) и элементарная ртуть при воздействии УФ-излучения.
- Hg2Cl2 → HgCl2 + Hg
Образование Hg можно использовать для расчета числа фотонов в световом пучке по методике актинометрия.
Используя легкую реакцию в присутствии хлорид ртути (II) и оксалат аммония, хлорид ртути (I), хлорид аммония и углекислый газ производятся.
- 2 HgCl2 + (NH4)2C2О4 Hg2Cl2(s) + 2 [NH+
4] [Cl−] + 2 CO2
Эта конкретная реакция была открыта Дж. М. Эдером (отсюда и название Эдер реакция) в 1880 г. и повторно исследован В. Э. Розевером в 1929 г.[11]
Родственные соединения ртути (I)
Бромид ртути (I), Hg2Br2, светло-желтый, тогда как иодид ртути (I), Hg2я2, имеет зеленоватый цвет. Оба плохо растворимы. Фторид ртути (I) нестабилен в отсутствие сильной кислоты.
Соображения безопасности
Хлорид ртути токсичный, хотя из-за его низкой растворимости в воде он обычно менее опасен, чем его хлорид ртути аналог. Он использовался в медицине как мочегонное средство и слабительное (слабительное) в Соединенные Штаты с конца 1700-х по 1860-е гг. Каломель также был обычным ингредиентом в прорезывание зубов порошков в Великобритании до 1954 г., вызывая широко распространенное отравление ртутью в виде розовая болезнь, который в то время имел уровень смертности 1 из 10.[12] Это лекарственное использование было позже прекращено, когда была обнаружена токсичность соединения.
Он также нашел применение в косметике в качестве мыла и осветление кожи кремы, но эти препараты в настоящее время незаконны для производства или импорта во многих странах, включая США, Канаду, Японию и Европейский Союз.[13] Исследование рабочих, занятых в производстве этих препаратов, показало, что натриевая соль 2,3-димеркапто-1-пропансульфоновая кислота (DMPS) был эффективным в снижении бремя тела ртути и в снижении концентрации ртути в моче до нормального уровня.[14]
Рекомендации
- ^ «Соединения ртути [кроме (органо) алкилов] (как Hg)». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б Зумдал, Стивен С. (2009). Химические принципы 6-е изд.. Компания Houghton Mifflin. п. A22. ISBN 978-0-618-94690-7.
- ^ а б c d Чисхолм, Хью, изд. (1911). . Британская энциклопедия (11-е изд.). Издательство Кембриджского университета.
- ^ Housecroft, C.E .; Шарп, А. Г. (2004). Неорганическая химия (2-е изд.). Прентис Холл. С. 696–697. ISBN 978-0-13-039913-7.
- ^ Скуг, Дуглас А .; Холлер, Ф. Джеймс; Ниман, Тимоти А. (1998). Принципы инструментального анализа (5-е изд.). Паб Saunders College. С. 253–271. ISBN 978-0-03-002078-0.
- ^ Бучацкий, С., Вредители, болезни и болезни садовых растений, Collins, 1998, стр. 449-50. ISBN 0-00-220063-5
- ^ Келер, Кристофер С. В. (январь 2001 г.). "Медицина хэви-метала". Сегодняшний химик за работой. 10 (1): 61–65. ISSN 1062-094X. Получено 2009-02-02.
- ^ Джонстон, Элизабет Лихтенштейн (1901). Воспоминания лоялиста Джорджии ... написанные в 1836 году. Нью-Йорк: Мэнсфилд и компания. п.82. С. 82-83.
- ^ Инглис-Аркелл, Эстер. «Археологи выследили Льюиса и Кларка по их следу слабительных». io9. Получено 2018-11-09.
- ^ Уэллс А.Ф. (1984) Структурная неорганическая химия 5-е издание Oxford Science Publications ISBN 0-19-855370-6
- ^ Розевер, У. Э. (1930). «Рентгеновская фотохимическая реакция между оксалатом калия и хлоридом ртути». Варенье. Chem. Soc. 52 (7): 2612–2619. Дои:10.1021 / ja01370a005.
- ^ Снидер, Уолтер (2005). Открытие лекарств: история. Джон Уайли и сыновья. С. 45–46. ISBN 978-0-471-89980-8. Получено 2009-02-02.
- ^ "Директива Комиссии 86/199 / EEC, OJ L 149, стр. 38 от 3.6.1986".
- ^ Д. Гонсалес-Рамирес; М. Зунига-Чарльз; А. Нарро-Хуарес; Ю. Молина-Ресио; К. М. Херлбут; Р. К. Дарт; Х. В. Апошян (1 октября 1998 г.). «DMPS (2,3-димеркаптопропан-1-сульфонат, Dimaval) снижает содержание ртути в организме человека, подвергающегося воздействию хлорида ртути» (свободный полный текст). Журнал фармакологии и экспериментальной терапии. 287 (1): 8–12. PMID 9765315.

