Нитрат ртути (II) - Mercury(II) nitrate
 | |
| Имена | |
|---|---|
| Имена ИЮПАК Динитрат ртути Нитрат ртути (II) | |
| Другие имена Нитрат ртути | |
| Идентификаторы | |
| |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.030.126 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 1625 |
| |
| |
| Характеристики | |
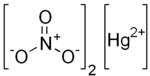
| Hg (НЕТ3)2 | |
| Молярная масса | 324,60 г / моль (безводный) |
| Внешность | бесцветные кристаллы или белый порошок |
| Запах | острый |
| Плотность | 4,3 г / см3 (моногидрат) |
| Температура плавления | 79 ° С (174 ° F, 352 К) (моногидрат) |
| растворимый | |
| Растворимость | растворим в азотная кислота, ацетон, аммиак не растворим в алкоголь |
| −74.0·10−6 см3/ моль | |
| Опасности | |
| Паспорт безопасности | ICSC 0980 |
Классификация ЕС (DSD) (устарело) | Очень токсичен (Т +) Опасно для окружающей среды (N) |
| R-фразы (устарело) | R26 / 27/28, R33, R50 / 53 |
| S-фразы (устарело) | (S1 / 2), S13, S28, S45, S60, S61 |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Родственные соединения | |
Другой анионы | Сульфат ртути (II) Хлорид ртути (II) |
Другой катионы | Нитрат цинка Нитрат кадмия |
Родственные соединения | Нитрат ртути (I) |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Нитрат ртути (II) ядовитый бесцветный или белый растворимый кристаллический Меркурий (II) соль из азотная кислота. Его использовали для лечения мех сделать чувствовал себя в процессе, называемом 'морковь '. Фраза 'злой как черт 'связано с психологическим заболеванием, вызванным чрезмерным воздействием нитрата ртути (II). Эта практика продолжалась в Соединенных Штатах, пока не была запрещена в декабре 1941 г. Служба общественного здравоохранения США. Хотя это звучит полезно для здоровья, запрет фактически освободил нитрат ртути (II) для использования в производстве детонаторов во время продолжающейся войны.[1]
Производство
Нитрат ртути (II) получают в результате реакции горячего концентрированного азотная кислота с Меркурий металла, в этих условиях азотная кислота является окислитель. Разбавленная азотная кислота даст нитрат ртути (I).
Использует
Нитрат ртути используется в реакциях меркурации. В частности, он используется в реакциях с участием кетонов. Одним из наиболее эффективных химикатов является ацетон. В этой реакции используются нитрат ртути, оксид ртути и сульфат кальция для изменения ацетона, который представляет собой CH3C (O) CH3, в CH3C (O) CH2Hg. Ацетон - это соединение, для которого большинство других методов меркурации неэффективны.[2] Соединение нитрата ртути работает, потому что это сильный окислитель.[3] Кроме того, когда ртуть растворяется в азотной кислоте, образуется кислотная форма нитрата ртути.[4] Кислая форма способна инвертировать молекулы сахарозы.[5]
Информация о здоровье
Нитрат ртути имеет тенденцию влиять на организм как Hg.2+, который считается формой неорганической ртути. Формы неорганической ртути можно найти в различных формах, включая крем для осветления кожи. Если неорганическая ртуть попадает в организм, она может изменить структуру важных белков в организме. Если он попадает в почву, он может абсорбироваться и оставаться для растений.[6] У людей, страдающих от отравления, как правило, самыми ранними симптомами являются рвота и диарея.[3]
Реактивность
Хотя нитрат ртути не горюч, он может ускорить воспламенение, поскольку действует как окислитель. Кроме того, в сочетании со спиртами он может образовывать взрывоопасные соединения.[7]
Смотрите также
Рекомендации
- ^ «Не такой уж безумный Шляпник: профессиональные опасности ртути».
- ^ Morton, Avery A .; Пеннер, Хельмут П. (1951). «Меркурация кетонов и некоторых других соединений нитратом ртути». Журнал Американского химического общества. 73 (7): 3300–3304. Дои:10.1021 / ja01151a091.
- ^ а б «Нитрат ртути».
- ^ Блит, Александр Винтер; Блит, Мередит Винтер (1903). Пища: их состав и анализ.
- ^ Кокран, К. Б. (1907). "Инверсия сукросса кислым нитратом ртути". Журнал Американского химического общества. 29 (4): 555–556. Дои:10.1021 / ja01958a016.
- ^ «Элементарная ртуть и неорганические соединения ртути: аспекты здоровья человека» (PDF).
- ^ «Нитрат ртути».
внешняя ссылка
- ATSDR - Портал токсичных веществ - Ртуть (11/14/2013)
- ATSDR - Заявление об общественном здравоохранении: ртуть (11/14/2013)
- ATSDR - ВНИМАНИЕ! Модели воздействия металлической ртути, 26.06.97 (ссылка не прослеживается 14.11.2013)
- ATSDR - Руководство по медицинскому лечению ртути (11/14/2013)
- ATSDR - токсикологический профиль: ртуть (11/14/2013)
- Данные по безопасности (MSDS) (ссылка не прослеживается 14.11.2013)
- Нитрат ртути (ICSC)
- Меркурий
- Информационные пакеты Mercury
- Как сделать хорошие электрические соединения ртути, Популярная наука ежемесячно, февраль 1919 г., ненумерованная страница, сканированная Google Книгами: https://books.google.com/books?id=7igDAAAAMBAJ&pg=PT14

