Четырехокись сурьмы - Antimony tetroxide
 | |
| Имена | |
|---|---|
| Название ИЮПАК оксид сурьмы (III, V) | |
| Идентификаторы | |
| ECHA InfoCard | 100.014.161 |
PubChem CID | |
| Характеристики | |
| SbO2; Sb2О4 | |
| Молярная масса | 153,7588; 307,5176 г / моль |
| Внешность | белое твердое вещество |
| Плотность | 6,64 г / см3 (орторомбическая форма) [1] |
| Температура плавления | > 930 ° C (1710 ° F, 1200 К) (разлагается) |
| Точка кипения | разлагается |
| нерастворимый | |
| 2.0 | |
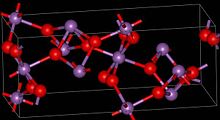
| Структура | |
| ромбический | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| NIOSH (Пределы воздействия на здоровье в США): | |
PEL (Допустимо) | TWA 0,5 мг / м3 (как Sb)[2] |
REL (Рекомендуемые) | TWA 0,5 мг / м3 (как Sb)[2] |
| Родственные соединения | |
Родственные соединения | Триоксид сурьмы Пятиокись сурьмы |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Четырехокись сурьмы является неорганическое соединение с формулой Sb2О4. Этот материал, который существует как минерал сервантит,[3] белый, но обратимо желтеет при нагревании. Материал по эмпирической формуле SbO2, называется тетроксидом сурьмы, чтобы обозначить наличие двух видов центров Sb.
Формирование и структура
Материал формируется, когда Sb2О3 нагревается на воздухе:[4]
- Sb2О3 + 0,5 O2 → Сб2О4 ΔH = −187 кДж / моль
При 800 ° C, оксид сурьмы (V) теряет кислород, чтобы дать тот же материал:
- Sb2О5 → Сб2О4 + 0,5 O2 ΔH = −64 кДж / моль
Материал смешанной валентности, содержащий центры как Sb (V), так и Sb (III). Два полиморфы известны, один ромбический (показан в информационном окне) и один моноклинический.[1] Обе формы имеют октаэдрические центры Sb (V), расположенные в виде листов с искаженными центрами Sb (III), связанными с четырьмя оксидами.
Рекомендации
- ^ а б Amador, J .; Пуэбла, Э. Гутьеррес; Monge, M. A .; Rasines, I .; Валеро, К. Руис (1988). «Повторение тетраоксидов диантьмы». Неорганическая химия. 27: 1367–1370. Дои:10.1021 / ic00281a011.
- ^ а б Карманный справочник NIOSH по химической опасности. "#0036". Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Сервантит». Вебминералы. Получено 2009-06-06.
- ^ Холлеман, А. Ф .; Виберг, Э. "Неорганическая химия" Academic Press: Сан-Диего, 2001. ISBN 0-12-352651-5.

