Оксид марганца (II, III) - Manganese(II,III) oxide
 | |
| Имена | |
|---|---|
| Название ИЮПАК оксид марганца (II) диманганца (III) | |
| Другие имена Четырехокись марганца; Оксид марганца, оксид марганца, тетраоксид триманганца, четырехокись триманганца[1] | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ECHA InfoCard | 100.013.879 |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| Mn3О4 MnO · Mn2О3 | |
| Молярная масса | 228,812 г / моль |
| Внешность | коричневато-черный порошок[1] |
| Плотность | 4,86 г / см3 |
| Температура плавления | 1567 ° С (2853 ° F, 1840 К) |
| Точка кипения | 2847 ° С (5157 ° F, 3120 К) |
| нерастворимый | |
| Растворимость | растворим в HCl |
| +12,400·10−6 см3/ моль | |
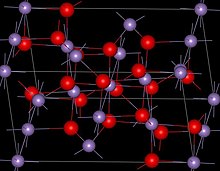
| Структура | |
| Шпинель (тетрагональный), tI28 | |
| я41/ драм, № 141 | |
| Опасности | |
| NIOSH (Пределы воздействия на здоровье в США): | |
PEL (Допустимо) | C 5 мг / м3[1] |
REL (Рекомендуемые) | Не установлено[1] |
IDLH (Непосредственная опасность) | N.D.[1] |
| Термохимия | |
Стандартный моляр энтропия (S | 149 Дж · моль−1· K−1[2] |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −1387 кДж · моль−1[2] |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Оксид марганца (II, III) химическое соединение с формулой Mn3О4. Марганец присутствует в двух состояния окисления +2 и +3, а формулу иногда записывают как MnO ·Mn2О3. Mn3О4 встречается в природе как минерал гаусманнит.
Подготовка
Mn3О4 образуется при нагревании любого оксида марганца на воздухе выше 1000 ° C.[3] Значительные исследования были сосредоточены на производстве нанокристаллический Mn3О4 и различные синтезы, включающие окисление MnII или уменьшение MnVI.[4][5][6]
Реакции
Mn3О4 было обнаружено, что он действует как катализатор для ряда реакций, например окисление метана и оксида углерода;[7][8] разложение NO,[9] восстановление нитробензола[10] и каталитическое горение органических соединений.[11]
Структура
Mn3О4 имеет шпинель структура, где ионы оксида плотноупакованы кубической структурой, а MnII занимают тетраэдрические позиции, а MnIII октаэдрические участки.[3] Структура искажена из-за Эффект Яна – Теллера.[3] При комнатной температуре Mn3О4 является парамагнитный, ниже 41-43 К это ферримагнитный[12] хотя сообщается, что это уменьшение в нанокристаллических образцах примерно до 39 К.[13]
Использует
Mn3О4 иногда используется в качестве исходного материала при производстве мягких ферриты например феррит цинка марганца,[14] и оксид лития-марганца, используемый в литиевых батареях.[15]
Четырехокись марганца также можно использовать в качестве утяжелителя при бурении пластов пласта в нефтяных и газовых скважинах.[нужна цитата ]
Рекомендации
- ^ а б c d е Карманный справочник NIOSH по химической опасности. "#0381". Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б Зумдал, Стивен С. (2009). Химические принципы 6-е изд.. Компания Houghton Mifflin. п. A22. ISBN 978-0-618-94690-7.
- ^ а б c Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ Хаусманнит Mn3О4 наностержни: синтез, характеристика и магнитные свойства Jin Du et al. Нанотехнологии, (2006), 17 4923-4928, Дои: 10.1088/0957-4484/17/19/024
- ^ Одностадийный синтез Mn3О4 наночастицы: структурное и магнитное исследование Васкес-Олмос А., Редон Р., Родригес-Гатторно Г., Мата-Замора М.Э., Моралес-Леал Ф., Фернандес-Осорио А.Л., Saniger JM Journal of Colloid and Interface Science, 291, 1, ( 2005), 175-180 Дои:10.1016 / j.jcis.2005.05.005
- ^ Использование углеродных полисахаридных микросфер в качестве шаблонов для изготовления полых сфер из оксида металла Xiaoming Sun, Junfeng Liu, Yadong Li, Chemistry - A European Journal, (2005), 12, 7, 2039-2047, Дои:10.1002 / chem.200500660
- ^ Поведение оксидов марганца при восстановлении и окислении Stobhe E.R, de Boer A.D., Geus J.W., Catalysis Today. (1999), 47, 161–167. Дои:10.1016 / S0920-5861 (98) 00296-X
- ^ Исследование методом рентгеновской дифракции in situ однократно и дважды промотированных катализаторов сочетания оксида марганца и метана. Моггридж Г.Д., Реймент Т., Ламберт Р.М. Журнал катализа, (1992), 134, 242–252, Дои:10.1016/0021-9517(92)90225-7
- ^ NO Разложение по Mn2О3 и Mn3О4. Ямашита Т., Ваннис А., Журнал катализа (1996), 163, 158–168, Дои:10.1006 / jcat.1996.0315
- ^ Выборочное сокращение нитробензол в нитрозобензол на различных типах катализаторов на основе тетроксида триманганца. Wang W.M., Yang Y.N., Zhang J.Y., Applied Catalysis A. (1995), 133, 1, 81–93 Дои:10.1016 / 0926-860X (95) 00186-7
- ^ Каталитическое горение углеводородов С3 и оксигенатов над Mn3О4. Балди М., Финоккио Е., Милелла Ф., Буска Г., Прикладной катализ Б. (1998), 16, 1, 43–51, Дои:10.1016 / S0926-3373 (97) 00061-1
- ^ Магнитная структура Mn3О4 по нейтронной дифракции Буше Б., Буль Р., Перрин М., J. Appl. Phys. 42, 1615 (1971); Дои:10.1063/1.1660364
- ^ Синтез суперпарамагнитного Mn3О4 нанокристаллиты ультразвуковым облучением И.К. Гопалакришнан, Н. Багкар, Р. Гангули и С.К. Kulshreshtha Journal of Crystal Growth 280, 3-4, (2005), 436-441, Дои:10.1016 / j.jcrysgro.2005.03.060
- ^ Способ получения марганцево-цинкового феррита Номер патента США: 4093688 (1978) Артур Уитхоп, Роджер Эмиль Травальи
- ^ Процесс получения оксидов лития-марганца, номер патента США: 6706443, (2004), Хорст Крампиц, Герхард Вонер
