Перекись калия - Potassium peroxide
 | |
| Имена | |
|---|---|
| Название ИЮПАК Перекись калия | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.037.339 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| K2О2 | |
| Молярная масса | 110,196 г / моль |
| Внешность | желтое аморфное твердое вещество |
| Температура плавления | 490 ° С (914 ° F, 763 К) |
| реагирует с водой[1] | |
| Структура | |
| Орторомбический | |
| CMCA, oS16 | |
| Термохимия | |
Стандартный моляр энтропия (S | 113 Дж · моль−1· K−1[2] |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −496 кДж · моль−1[2] |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Другой анионы | Оксид калия Супероксид калия Хлорид калия |
Другой катионы | Перекись лития Перекись натрия |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Перекись калия является неорганическое соединение с молекулярная формула K2О2. Он формируется как калий реагирует с кислородом воздуха, вместе с оксид калия (K2O) и супероксид калия (КО2).
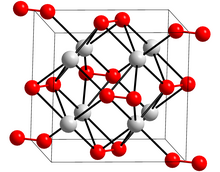
Кристальная структура
Пероксид калия реагирует с воды формировать гидроксид калия и кислород:
Рекомендации
- ^ Лиде, Дэвид Р. (1998). Справочник по химии и физике (87 изд.). Бока-Ратон, Флорида: CRC Press. С. 477, 520. ISBN 0-8493-0594-2.
- ^ а б Зумдал, Стивен С. (2009). Химические принципы 6-е изд.. Компания Houghton Mifflin. п. A22. ISBN 978-0-618-94690-7.
| Этот неорганический сложный –Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |


