IDH3B - IDH3B
Бета-субъединица изоцитратдегидрогеназы [НАД], митохондриальная является фермент что у людей кодируется IDH3B ген.[5][6]
Изоцитратдегидрогеназы (IDH) катализировать окислительный декарбоксилирование из изоцитрат к 2-оксоглутарат. Эти ферменты принадлежат к двум разным подклассам, один из которых использует НАД (+) как акцептор электронов а другой НАДФ (+). Сообщалось о пяти изоцитратдегидрогеназах: о трех НАД (+) - зависимых изоцитратдегидрогеназах, которые локализуются в митохондриальном матриксе, и о двух. НАДФ (+) - зависимые изоцитратдегидрогеназы, одна из которых митохондриальный а другой преимущественно цитозольный. НАД (+) - зависимые изоцитратдегидрогеназы катализируют аллостерически регулируемый ограничивающий шаг из цикл трикарбоновых кислот. Каждый изофермент представляет собой гетеротетрамер который состоит из двух альфа подразделения, одна бета-субъединица и одна гамма-субъединица. Белок, кодируемый этим геном, представляет собой бета-субъединицу одного изофермента НАД (+) - зависимой изоцитратдегидрогеназы. Для этого гена описаны три альтернативно сплайсированных варианта транскрипта, кодирующие разные изоформы. [предоставлено RefSeq, июль 2008 г.][6]
Структура
IDH3 - один из трех изоферментов изоцитратдегидрогеназы, два других - IDH1 и IDH2, и кодируется одним из пяти генов изоцитратдегидрогеназы, которые IDH1, IDH2, IDH3A, IDH3B, и IDH3G.[7] Гены IDH3A, IDH3B, и IDH3G кодируют субъединицы IDH3, который является гетеротетрамер состоит из двух α-субъединиц 37 кДа (IDH3α), одной β-субъединицы 39 кДа (IDH3β) и одной γ-субъединицы 39 кДа (IDH3γ), каждая из которых имеет отдельные изоэлектрические точки.[8][9][10] Выравнивание их аминокислотные последовательности выявляет ~ 40% идентичности между IDH3α и IDH3β, ~ 42% идентичности между IDH3α и IDH3γ и еще более близкую идентичность 53% между IDH3β и IDH3γ, что составляет 34% идентичности и 23% сходства для всех трех типов субъединиц.[9][10][11][12] В частности, Arg 88 в IDH3α имеет важное значение для каталитической активности IDH3, тогда как эквивалентные Arg99 в IDH3β и Arg97 в IDH3γ в значительной степени участвуют в аллостерической регуляции фермента с помощью ADP и NAD.[11] Таким образом, возможно, что эти субъединицы произошли от дупликация гена общего предкового гена и исходного каталитического Arg остаток были адаптированы к аллостерическим функциям в β- и γ-субъединицах.[9][11] Так же, Жерех 181 в IDH3α необходим для катализа, в то время как эквивалентные Asp192 в IDH3β и Asp190 в IDH3γ усиливают НАД- и Mn2+-обвязка.[9] Поскольку окислительное декарбоксилирование, катализируемое IDH3, требует связывания НАД, Mn2+, а субстрат isocitrate, все три субъединицы участвуют в каталитической реакции.[10][11] Более того, исследования фермента в сердце свиньи показывают, что димеры αβ и αγ составляют два сайта связывания для каждого из его лиганды, в том числе изоцитрат, Mn2+, и НАД - в одном тетрамере IDH3.[9][10]
Изоформы
В IDH3B ген содержит 12 экзоны и кодирует два альтернативно сращенный изоформы: IDH3β1 (349 остатки ) и IDH3β2 (354 остатка).[13][14] Эти изоформы тканеспецифичны и обладают оптимальным pH совпадающие с тканями-мишенями. IDH3β1 с оптимальным pH 8,0 выражается в мозг и почка, тогда как IDH3β2 с оптимальным pH 7,6 выражается в сердце и скелетные мышцы.[14]
Функция
Как изоцитратдегидрогеназа, IDH3 катализирует обратимое окислительное декарбоксилирование изоцитрата с образованием α-кетоглутарат (α-KG) и CO2 как часть Цикл TCA в метаболизме глюкозы.[8][9][10][11][15] Этот шаг также учитывает сопутствующие снижение NAD + в NADH, который затем используется для генерации АТФ сквозь электронная транспортная цепь. Примечательно, что IDH3 полагается на NAD + в качестве своего акцептор электронов, в отличие от NADP +, такого как IDH1 и IDH2.[8][9] Активность IDH3 регулируется потребностями клетки в энергии: когда клетке требуется энергия, IDH3 активируется АДФ; а когда энергия больше не требуется, IDH3 ингибируется АТФ и NADH.[9][10] Эта аллостерическая регуляция позволяет IDH3 действовать как лимитирующая ступень в цикле TCA.[15][16] Внутри клеток было обнаружено, что IDH3 и его субъединицы локализовать к митохондрии.[9][10][15]
Клиническое значение
Гомозиготный мутации с потерей функции IDH3B ген был связан с пигментный ретинит, нейродегенерация стержни и конусы в сетчатка приводит к слепоте.[12][13][17]
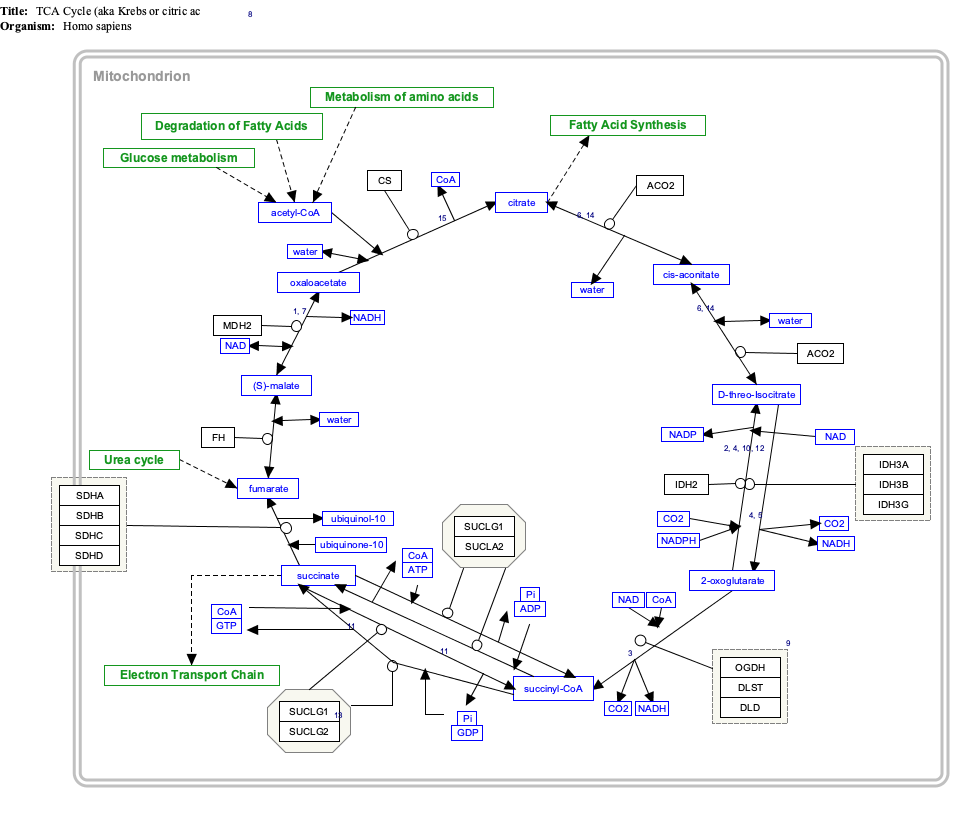
Интерактивная карта проезда
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи. [§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: "TCACycle_WP78".
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000101365 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000027406 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Ким Ё, Пак Ш., Кан Ё.Дж., Ко Х.Дж., Ким Ш., Пак С.И., Сон У, Ха Т.Л. (январь 2000 г.). «Отнесение митохондриального NAD (+) - специфичного гена бета-субъединицы изоцитратдегидрогеназы (IDH3B) к полосе 20p13 хромосомы человека посредством гибридизации in situ и радиационного гибридного картирования». Cytogenet Cell Genet. 86 (3–4): 240–1. Дои:10.1159/000015348. PMID 10575215. S2CID 85139434.
- ^ а б «Ген Entrez: IDH3B изоцитратдегидрогеназа 3 (NAD +) бета».
- ^ Димитров Л., Хонг С.С., Ян С., Чжуан З., Хейсс Д.Д. (2015). «Новые разработки в патогенезе и терапевтическом воздействии мутации IDH1 в глиоме». Международный журнал медицинских наук. 12 (3): 201–13. Дои:10.7150 / ijms.11047. ЧВК 4323358. PMID 25678837.
- ^ а б c Цзэн, Л; Моринибу, А; Кобаяши, М; Чжу, Y; Ван, Х; Гото, Y; Йом, CJ; Чжао, Т; Хирота, К; Шиномия, К; Итасака, S; Йошимура, М; Guo, G; Hammond, EM; Хираока, М. Харада, H (3 сентября 2015 г.). «Аберрантная экспрессия IDH3α способствует росту злокачественной опухоли путем индукции HIF-1-опосредованного метаболического перепрограммирования и ангиогенеза». Онкоген. 34 (36): 4758–66. Дои:10.1038 / onc.2014.411. PMID 25531325.
- ^ а б c d е ж грамм час я Бзымек, КП; Колман, РФ (8 мая 2007 г.). «Роль альфа-Asp181, бета-Asp192 и гамма-Asp190 в отличительных субъединицах человеческой НАД-специфической изоцитратдегидрогеназы». Биохимия. 46 (18): 5391–7. Дои:10.1021 / bi700061t. PMID 17432878.
- ^ а б c d е ж грамм Soundar, S; О'хаган, М; Фомулу, KS; Колман, РФ (28 июля 2006 г.). «Идентификация Mn2 + -связывающих аспартатов из альфа, бета и гамма субъединиц NAD-зависимой изоцитратдегидрогеназы человека». Журнал биологической химии. 281 (30): 21073–81. Дои:10.1074 / jbc.m602956200. PMID 16737955.
- ^ а б c d е Soundar, S; Парк, JH; Ха, TL; Колман, РФ (26 декабря 2003 г.). «Оценка с помощью мутагенеза важности 3 аргининов в альфа, бета и гамма субъединицах НАД-зависимой изоцитратдегидрогеназы человека». Журнал биологической химии. 278 (52): 52146–53. Дои:10.1074 / jbc.m306178200. PMID 14555658.
- ^ а б Данге, М; Колман, РФ (2 июля 2010 г.). «Каждый консервативный тир активного сайта в трех субъединицах изоцитратдегидрогеназы человека выполняет разные функции». Журнал биологической химии. 285 (27): 20520–5. Дои:10.1074 / jbc.m110.115386. ЧВК 2898308. PMID 20435888.
- ^ а б Hartong, DT; Данге, М; McGee, TL; Берсон, Э.Л .; Дрыя, ТП; Колман, РФ (октябрь 2008 г.). «Понимание роли изоцитратдегидрогеназ в цикле Кребса на основе пигментного ретинита». Природа Генетика. 40 (10): 1230–4. Дои:10,1038 / нг.223. ЧВК 2596605. PMID 18806796.
- ^ а б Ким, YO; Koh, HJ; Kim, SH; Jo, SH; Ха, JW; Jeong, KS; Ли, Эй Джей; Песня, Би Джей; Ха, TL (24 декабря 1999 г.). «Идентификация и функциональная характеристика новой тканеспецифической изоформы бета-субъединицы НАД (+) - зависимой изоцитратдегидрогеназы». Журнал биологической химии. 274 (52): 36866–75. Дои:10.1074 / jbc.274.52.36866. PMID 10601238.
- ^ а б c Ха, TL; Ким, YO; О, АйЮ; Песня, Би Джей; Инадзава, Дж. (1 марта 1996 г.). «Отнесение гена альфа-субъединицы изоцитратдегидрогеназы (IDH3A) к митохондриальной NAD + человека человека к 15q25.1 -> q25.2 посредством гибридизации in situ». Геномика. 32 (2): 295–6. Дои:10.1006 / geno.1996.0120. PMID 8833160.
- ^ Йошими, N; Футамура, Т; Берген, ЮВ; Иваяма, Y; Ишима, Т; Селлгрен, С; Экман, CJ; Якобссон, Дж; Pålsson, E; Какумото, К; Охги, Y; Йошикава, Т; Landén, M; Хашимото, К. (19 января 2016 г.). «Метаболомика спинномозговой жидкости определяет ключевую роль изоцитратдегидрогеназы в биполярном расстройстве: доказательства в поддержку гипотезы митохондриальной дисфункции». Молекулярная психиатрия. 21 (11): 1504–1510. Дои:10.1038 / mp.2015.217. ЧВК 5078854. PMID 26782057.
- ^ Fahim, AT; Дайгер, ИП; Велебер, Р.Г .; Пагон, РА; Адам, депутат; Ardinger, HH; Уоллес, ЮВ; Амемия, А; Бин, LJH; Птица, ТД; Фонг, Коннектикут; Меффорд, ХК; Смит, RJH; Стивенс, К. (1993). «Обзор пигментного ретинита». PMID 20301590. Цитировать журнал требует
| журнал =(помощь)
дальнейшее чтение
- Ким ЙО, Кох Х.Дж., Ким Ш.и др. (2000). «Идентификация и функциональная характеристика новой тканеспецифической изоформы бета-субъединицы НАД (+) - зависимой изоцитратдегидрогеназы». J. Biol. Chem. 274 (52): 36866–75. Дои:10.1074 / jbc.274.52.36866. PMID 10601238.
- Weiss C, Zeng Y, Huang J, et al. (2000). «Бычья НАД + -зависимая изоцитратдегидрогеназа: альтернативный сплайсинг и тканезависимая экспрессия субъединицы 1». Биохимия. 39 (7): 1807–16. Дои:10.1021 / bi991691i. PMID 10677231.
- Делукас П., Мэтьюз Л.Х., Ашерст Дж. И др. (2002). «Последовательность ДНК и сравнительный анализ хромосомы 20 человека». Природа. 414 (6866): 865–71. Дои:10.1038 / 414865a. PMID 11780052.
- Strausberg RL, Feingold EA, Grouse LH, et al. (2003). «Создание и первоначальный анализ более 15 000 полноразмерных последовательностей кДНК человека и мыши». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 99 (26): 16899–903. Дои:10.1073 / pnas.242603899. ЧВК 139241. PMID 12477932.
- Ота Т., Сузуки Ю., Нисикава Т. и др. (2004). «Полное секвенирование и характеристика 21 243 полноразмерных кДНК человека». Nat. Genet. 36 (1): 40–5. Дои:10,1038 / ng1285. PMID 14702039.
- Герхард Д.С., Вагнер Л., Фейнгольд Е.А. и др. (2004). «Статус, качество и расширение проекта NIH полноразмерной кДНК: Коллекция генов млекопитающих (MGC)». Genome Res. 14 (10B): 2121–7. Дои:10.1101 / гр.2596504. ЧВК 528928. PMID 15489334.
- Кил И.С., Парк Дж. В. (2005). «Регулирование митохондриальной НАДФ + -зависимой активности изоцитратдегидрогеназы путем глутатионилирования». J. Biol. Chem. 280 (11): 10846–54. Дои:10.1074 / jbc.M411306200. PMID 15653693.
- Руал Дж. Ф., Венкатесан К., Хао Т. и др. (2005). «К карте протеомного масштаба сети взаимодействия белка и белка человека». Природа. 437 (7062): 1173–8. Дои:10.1038 / природа04209. PMID 16189514. S2CID 4427026.
- Лим Дж., Хао Т., Шоу С. и др. (2006). «Сеть межбелкового взаимодействия для унаследованных атаксий человека и нарушений дегенерации клеток Пуркинье». Клетка. 125 (4): 801–14. Дои:10.1016 / j.cell.2006.03.032. PMID 16713569. S2CID 13709685.
- Саундар С., О'хаган М., Фомулу К.С., Колман Р.Ф. (2006). «Идентификация Mn2 + -связывающих аспартатов из альфа, бета и гамма субъединиц NAD-зависимой изоцитратдегидрогеназы человека». J. Biol. Chem. 281 (30): 21073–81. Дои:10.1074 / jbc.M602956200. PMID 16737955.
- Бзымек КП, Колман РФ (2007). «Роль альфа-Asp181, бета-Asp192 и гамма-Asp190 в отличительных субъединицах человеческой НАД-специфической изоцитратдегидрогеназы». Биохимия. 46 (18): 5391–7. Дои:10.1021 / bi700061t. PMID 17432878.