Тропон - Tropone
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Циклогепта-2,4,6-триен-1-он | |||
| Другие имена Циклогепта-2,4,6-триенон | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.007.933 | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C7ЧАС6О | |||
| Молярная масса | 106,12 г / моль | ||
| Плотность | 1,094 г / мл | ||
| Точка кипения | 113 ° С (235 ° F, 386 К) (15 мм рт. Ст.) | ||
| Опасности | |||
| точка возгорания | > 113 ° С (235 ° F, 386 К) | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Тропон или 2,4,6-циклогептатриен-1-он является органическое соединение с некоторым значением в органическая химия как небензоид ароматный.[2] Соединение состоит из кольца из семи атомов углерода с тремя сопряженный алкен группы и кетон группа. Родственное соединение трополон (2-гидрокси-2,4,6-циклогептатриен-1-он) имеет дополнительный алкоголь (или энол включая двойную связь) группу рядом с кетоном.
Фрагмент тропона можно найти в биомолекулы такие как колхицин, стипитатовая кислота и хинокитиол.
Тропон известен с 1951 года, его еще называют оксид циклогептатриенилия. Название трополон придумал М. Дж. С. Дьюар в 1945 году в связи с ощущаемыми ароматическими свойствами.[3]
Характеристики
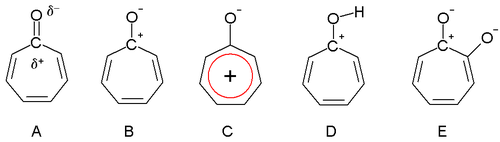
Дьюар в 1945 году предположил, что тропоны могут обладать ароматическими свойствами. В карбонил группа поляризованный с частичным положительным зарядом атома углерода (A) и частичным отрицательным зарядом кислорода. В крайнем случае атом углерода имеет полный положительный заряд (B), образуя ион тропилия кольцо, которое является ароматный 6 электронная система (С).
Трополоне кислый (показано сопряженное основание, E) с pKa из 7, что находится между фенол (10) и бензойная кислота (4). Повышенная кислотность по сравнению с фенолом обусловлена регулярным резонансная стабилизация. Тропоны и, в меньшей степени, трополоны также являются основными (D), и это во многом связано с ароматической стабилизацией. Это свойство можно наблюдать по легкости образования солей с кислотами. В дипольный момент для тропона - 4,17 D по сравнению со значением всего 3,04 Д для циклогептанон, что также можно рассматривать как свидетельство ароматичности.
Синтез
Существует множество методов для органический синтез тропонов и их производных. Два выбранных метода синтеза тропона: диоксид селена окисление из циклогептатриен[4] и косвенно от тропинон по Устранение Хофмана и бромирование.[2]
Два метода синтеза трополона - это бромирование 1,2-циклогептандиона с N-бромосукцинимид с последующим дегидрогалогенирование при повышенных температурах и конденсация ацилоина этилового сложный эфир из пимелиновая кислота то ацилоин снова с последующим окислением бромом.[2]
Реакции
- Тропон подвергается сжатие кольца к бензойная кислота с гидроксид калия при повышенной температуре. Многие деривативы также сокращаются до соответствующих ареновые соединения.[2]
- Тропон реагирует на электрофильное замещение, например, с бром, но реакция протекает через продукт 1,2-присоединения и не является электрофильное ароматическое замещение.[2]
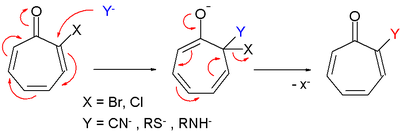
- Производные тропона также реагируют в нуклеофильное замещение очень похоже на нуклеофильное ароматическое замещение.[2]
- Тропон - это диен в Реакция Дильса-Альдера, например, с малеиновый ангидрид.[2]
- Также обнаружено, что тропон реагирует на [8 + 3]аннулирование с коричный альдегид[5]
Рекомендации
- ^ Тропон в Сигма-Олдрич
- ^ а б c d е ж грамм Паусон, Питер Л. (1955). «Тропоны и тропоны». Chem. Ред. 55 (1): 9–136. Дои:10.1021 / cr50001a002.
- ^ М. Дж. С. Дьюар (1945). «Структура стипитатовой кислоты». Природа. 155 (3924): 50–51. Дои:10.1038 / 155050b0.
- ^ Dahnke, Karl R .; Пакетт, Лео А. (1993). «Обратное циклоприсоединение Дильса-Альдера кетен-дитиоацеталя с потребностью в электронах. Восстановление конъюгированного енона, стимулированное гидридом меди. 9-Дитиоланобицикло [3.2.2] нон-6-ен-2-он». Орг. Synth. 71: 181.
- ^ Аннулирование [8 + 3] тропона и эналов, катализируемое N-гетероциклическим карбеном, через гомоенолят Виджай Наир, Маноджкумар Пунот, Срикумар Веллалат, Эрингатоди Суреш и Раджасекаран Тирумалай J. Org. Chem.; 2006; 71 (23) стр. 8964–8965; (Примечание) Дои:10.1021 / jo0615706