Тиазол - Thiazole
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC 1,3-тиазол | |||
| Другие имена Тиазол | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.005.475 | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C3ЧАС3NS | |||
| Молярная масса | 85.12 г · моль−1 | ||
| Точка кипения | От 116 до 118 ° C (от 241 до 244 ° F, от 389 до 391 K) | ||
| Кислотность (пKа) | 2,5 (конъюгированной кислоты) [1] | ||
| -50.55·10−6 см3/ моль | |||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Тиазол, или же 1,3-тиазол, это гетероциклическое соединение содержащий серу и азот; термин «тиазол» также относится к большому семейству производных. Сам тиазол представляет собой бледно-желтую жидкость с пиридин -подобный запах и молекулярная формула C3ЧАС3NS.[2] Тиазольное кольцо примечательно как компонент витамин тиамин (B1).
Молекулярная и электронная структура
Тиазолы входят в состав азолы, гетероциклы, которые включают имидазолы и оксазолы. Тиазол также можно считать функциональная группа. Оксазолы являются родственными соединениями, в которых сера заменена кислородом. Тиазолы структурно похожи на имидазолы, с заменой тиазольной серы на азот.
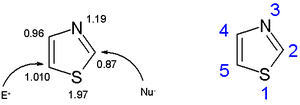
Кольца тиазола плоские и ароматный. Тиазолы характеризуются более крупными пи-электронами. делокализация чем соответствующий оксазолы и поэтому больше ароматичность. Об этой ароматичности свидетельствует химический сдвиг протонов кольца в протонный ЯМР спектроскопия (между 7,27 и 8,77 м.д.), ясно указывающая на сильную диамагнитный кольцевой ток. Рассчитанная плотность пи-электронов отмечает C5 как первичный сайт для электрофильного замещения и C2 как сайт для нуклеофильного замещения.
Появление тиазолов и солей тиазолия
Тиазолы содержатся во множестве специализированных продуктов, часто конденсированных с производными бензола, так называемыми бензотиазолами. В дополнение к витамину B1, тиазольное кольцо находится в эпотилон. Другие важные производные тиазола: бензотиазолы, например, химикат светлячка люциферин. Тогда как тиазолы хорошо представлены в биомолекулы, оксазолы не являются. Он содержится в природных пептидах и используется при разработке пептидомиметиков (т.е. молекул, имитирующих функцию и структуру пептидов).[3]
Коммерчески значимые тиазолы включают в основном красители и фунгициды. Тифлузамид, трициклазол и Тиабендазол продаются для борьбы с различными сельскохозяйственными вредителями. Другим широко используемым производным тиазола является нестероидный противовоспалительный препарат. Мелоксикам. Следующее антрохинон красители содержат субъединицы бензотиазола: Algol Yellow 8 (CAS # [6451-12-3]), Algol Yellow GC (CAS # [129-09-9]), Indanthren Rubine B (CAS # [6371-49-9]), Индантрен синий CLG (CAS № [6371-50-2] и индантрен синий CLB (CAS № [6492-78-0]). Эти тиазольные красители используются для окрашивания. хлопок.
Органический синтез
Существуют различные лабораторные методы для органический синтез тиазолов.
- В Синтез тиазола по Ганцу (1889) - реакция между галокетоны и тиоамиды. Например, 2,4-диметилтиазол синтезируется из ацетамид, пентасульфид фосфора, и хлорацетон.[4] Другой пример [5] приведено ниже:
- В адаптации Синтез Робинсона-Габриэля, 2-ациламино-кетоны реагируют с пентасульфид фосфора.
- в Синтез Кука-Хейльброна, α-аминонитрил реагирует с сероуглерод.
- К некоторым тиазолам можно получить доступ с помощью Реакция Герца.
Биосинтез
Несколько путей биосинтеза приводят к тиазольному кольцу, необходимому для образования тиамина.[6] Сера тиазола является производным цистеина. У анаэробных бактерий группа CN происходит из дегидроглицина.
Реакции
Реакционную способность тиазола можно резюмировать следующим образом:
- Депротонирование в C2: отрицательный заряд в этом положении стабилизируется как илида; Базы Хаузера и литийорганические соединения реагируют на этом сайте, заменяя протон
- 2- (триметилсилил) тиазол [7] (с триметилсилил группа в положении 2) является стабильным заменителем и реагирует с рядом электрофилов, таких как альдегиды, ацилгалогениды, и кетены
- Электрофильное ароматическое замещение на C5 требуется активация групп например, метил группа в этом бромирование:
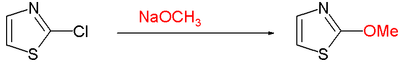
- Нуклеофильное ароматическое замещение часто требуется уходящая группа, такая как хлор в C2 с
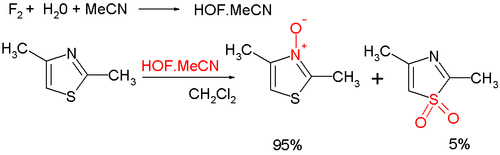
- Органический окисление азотом дает ароматический тиазол N-окись; существует много окислителей, таких как mCPBA; новый гипофтористая кислота приготовлено из фтор и вода в ацетонитрил; некоторая часть окисления происходит у серы, что приводит к неароматическим сульфоксид /сульфон:[8]
- Тиазолы являются формил синтоны; преобразование Р-тиа к R-CHO альдегид имеет место с,[7] соответственно, йодистый метил (N-метилирование), органическое восстановление с борогидрид натрия, и гидролиз с Хлорид ртути (II) в воде.
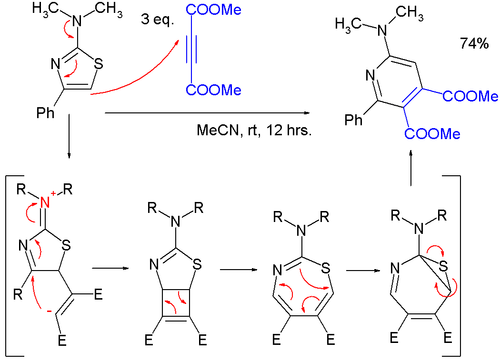
- Тиазолы могут реагировать в циклоприсоединения, но обычно при высоких температурах из-за благоприятной ароматической стабилизации реагента; Реакции Дильса-Альдера с алкины сопровождаются экструзией серы, и конечным продуктом является пиридин; в одном исследовании,[5] очень мягкая реакция 2- (диметиламино) тиазол с диметилацетилендикарбоксилат (DMAD) в пиридин проходит через цвиттерионный промежуточное соединение в формальном [2 + 2] циклоприсоединении к циклобутену, затем к 1,3-тиазепин в 4-х электронном электроциклическое размыкание кольца а затем в 7-тиа-2-азаноркарадиен в 6-электронном электроциклическом кольце, закрывающемся перед экструзией атома серы.
Соли тиазолия
Алкилирование тиазолов при азоте образует тиазолий катион. Соли тиазолия являются катализаторами Реакция Стеттера и Бензоиновая конденсация. Депротонирование N-алкилтиазолиевые соли дают бесплатные карбены[9] и карбеновые комплексы переходных металлов.
 Структура тиазолов (слева) и солей тиазолия (справа)
Структура тиазолов (слева) и солей тиазолия (справа)
Алагебриум представляет собой препарат на основе тиазолия.
Рекомендации
- ^ Zoltewicz, J. A .; Диди, Л. У. (1978). Кватернизация гетероароматических соединений. Количественные аспекты. Успехи химии гетероциклов. 22. С. 71–121. Дои:10.1016 / S0065-2725 (08) 60103-8. ISBN 9780120206223.
- ^ Eicher, T .; Хауптманн, С. (2003). Химия гетероциклов: структура, реакции, синтезы и приложения. ISBN 978-3-527-30720-3.
- ^ Мак, Джеффри Ю. В .; Сюй, Вэйцзюнь; Фэрли, Дэвид П. (01.01.2015). Пептидомиметики I (PDF). Разделы химии гетероциклов. 48. Springer Berlin Heidelberg. С. 235–266. Дои:10.1007/7081_2015_176. ISBN 978-3-319-49117-2.
- ^ Шварц, Г. (1945). «2,4-Диметилтиазол». Органический синтез. 25: 35.; Коллективный объем, 3, п. 332
- ^ а б Alajarín, M .; Cabrera, J .; Пастор, А .; Sánchez-Andrada, P .; Баутиста, Д. (2006). «О [2 + 2] циклоприсоединении 2-аминотиазолов и диметилацетилендикарбоксилата. Экспериментальные и вычислительные доказательства термического дисротационного раскрытия кольца конденсированных циклобутенов». J. Org. Chem. 71 (14): 5328–5339. Дои:10.1021 / jo060664c. PMID 16808523.
- ^ Kriek, M .; Мартинс, Ф .; Леонарди, Р .; Fairhurst, S.A .; Lowe, D. J .; Роуч, П. Л. (2007). "Тиазол-синтаза из кишечная палочка: Исследование субстратов и очищенных белков, необходимых для активности in vitro" (PDF). J. Biol. Chem. 282 (24): 17413–17423. Дои:10.1074 / jbc.M700782200. PMID 17403671.
- ^ а б Дондони, А .; Мерино, П. (1995). «Диастереоселективная гомологация ацетонида D- (R) -глицеральдегида с использованием 2- (триметилсилил) тиазола». Органический синтез. 72: 21.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 9, п. 952
- ^ Amir, E .; Розен, С. (2006). "Легкий доступ к семейству тиазолов N-оксиды с использованием HOF · CH3CN ». Химические коммуникации. 2006 (21): 2262–2264. Дои:10.1039 / b602594c. PMID 16718323.
- ^ Ардуенго, А. Дж .; Goerlich, J. R .; Маршалл, У. Дж. (1997). «Стабильный тиазол-2-илиден и его димер». Либигс Аннален. 1997 (2): 365–374. Дои:10.1002 / jlac.199719970213.