Ингибитор ренина - Renin inhibitor
| Ингибитор ренина | |
|---|---|
| Класс препарата | |
 | |
| Идентификаторы класса | |
| Использовать | Гипертония |
| Код УВД | C09XA |
| Биологическая мишень | Ренин |
| Клинические данные | |
| Drugs.com | Классы наркотиков |
| В Викиданных | |
Ингибиторы ренина находятся фармацевтические препараты подавление активности ренин который отвечает за гидролиз ангиотензиноген к ангиотензин I,[2][3][4] что, в свою очередь, снижает образование ангиотензин II что облегчает артериальное давление.[5][6]
Ингибитору ренина часто предшествует непосредственный, называется непосредственный ингибитор ренина чтобы отличить его механизм от других ренин-ангиотензин-альдостероновая система - мешающие препараты, такие как ингибиторы ангиотензинпревращающего фермента (ACEI), блокаторы рецепторов ангиотензина (АРБ) и антагонисты рецепторов альдостерона.[6]
Эти препараты подавлять первый и ограничивающий шаг из ренин-ангиотензин-альдостероновая система (RAAS), а именно преобразование ангиотензиноген к ангиотензин I. Это приводит к полному отсутствию ангиотензин II основано на том, что ренин только ингибирует эту стадию, в отличие от фермента, превращающего ангиотензин, который также участвует в других биохимических реакциях. С 1970-х годов ученые пытались разработать мощный ингибиторы с приемлемым пероральным биодоступность.[7][8] Процесс был трудным и занял около трех десятилетий. Первое и второе поколения столкнулись с такими проблемами, как низкая биодоступность и недостаток активности. Наконец, было открыто третье поколение. Эти соединения не былипептидный ингибиторы ренина имели приемлемую пероральную биодоступность и были достаточно эффективны для клинического применения. Первым препаратом этого класса был алискирен, получившее маркетинговое одобрение в 2007 году.[7] По состоянию на июнь 2020 г.[Обновить], это единственный ингибитор ренина на рынке.
История
В 1896 г. финский физиолог Роберт Тигерстедт и шведский врач Пер Бергман провел эксперимент с почками и сердечно-сосудистая система у кроликов. Они заметили, что кровяное давление у кроликов повышалось, когда выдержки почек вводили в их яремные вены.[9][10] Они также обнаружили, что это вещество, ответственное за высокое кровяное давление, было произведено в почечная кора, и они назвали это ренин.[10] Хотя этот эксперимент заложил основу для будущих исследований пути RAAS, он мало повлиял на научное сообщество в то время.[9][11] В 1934 году, когда Голдблатт опубликовал свою работу в почечная ишемия, снова в фокусе ренин. Важность ренина в патогенез из сердечно-сосудистые заболевания был, однако, не полностью изучен до 1970-х годов, а 20 лет спустя первые ингибиторы ренина стали клинические испытания.[7]
Пепстатин, который был описан в 1972 году, был первым синтетическим ингибитором ренина, но плохим фармакокинетический свойства не позволили ему войти in vivo расследования.[8][12] Ингибиторы ренина первого поколения, такие как H-142, были пептидными аналогами ангиотензиноген.[13] Однако эти ингибиторы также обладали ограниченными лекарственными свойствами.[7][12] Надежды на прорыв появились в 1982 году, когда началась разработка ингибиторов ренина второго поколения.[7] Это поколение состояло из пептидоподобных соединений, таких как ремикирен, эналкирен и заникирен.[11] У них были скорее лекарственные свойства, чем субстратные, и в 1990 году они прошли клинические испытания. Второе поколение имело свои ограничения и так и не завершило клинических испытаний.[7]
Алискирен, единственный ингибитор ренина, проходящий клинические испытания III фазы, структурно не связан с пептидами, что делает его ингибитором ренина третьего поколения.[7][14] Первое клиническое испытание было проведено в 2000 году на здоровых добровольцах.[15] В 2007 году алискирен был одобрен Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США и Европейское агентство по лекарствам как лечение гипертония.[7] Систематический обзор Кокрановской группы по гипертонии показал, что максимальная рекомендуемая доза алискирена вызывает заметное снижение артериального давления по сравнению с плацебо.[16]

Ренин-ангиотензин-альдостероновая система

В ренин-ангиотензин-альдостероновая система (RAAS) играет ключевую роль в патология из сердечно-сосудистые заболевания, гипертония, диабетик болезнь почек и сердечная недостаточность.[17] В нормальных условиях стимуляция RAAS происходит в ответ на угрозы, компрометирующие артериальное давление стабильность, например гипотония, кровопотеря и чрезмерная потеря натрия и воды. Артериальное давление зависит от общее периферическое сопротивление и сердечный выброс.
Очень селективный аспарагиновая протеаза ренин секретный от юкстагломерулярный аппарат, который является единственным источником активного ренина,[18] хотя его предшественник, проренин, могут секретироваться другими ткани, например, слюнные железы, мозг, сердце и кровеносные сосуды.[18][19][20] Ренин - циркулирующий фермент действует на циркулирующий пептид, ангиотензиноген.[21] Ренин расщепляет пептид по связи Leu10 – Val11, и эта реакция является этап определения ставки РАСХН.[22] Это приводит к продукту ангиотензин I (Ang I), который является декапептид. Анг я сломан посредством ангиотензин-превращающий фермент (АПФ) к активному октапептиду ангиотензин II (Ang II), который является основным эффектором RAAS.[21] Ang II стимулирует задержку натрия почками; продвигает альдостерон секреция; причины вазоконстрикция, и увеличивает Симпатическая нервная система Мероприятия.[20][23] Ang II также обеспечивает негативный отзыв в систему, ингибируя высвобождение ренина юкстагломерулярным аппаратом.[23] Ang II взаимодействует как минимум с двумя классами Рецепторы Ang II, AT1 и AT2.[20] Этот механизм, который проходит от ренина через Ang II и к альдостерону, а также отрицательная обратная связь, которую Ang II оказывает на секрецию ренина, известен как RAAS.[23] В результате повышается кровяное давление, что в нормальной физиологии необходимо для поддержания гомеостаз.
Предполагается, что эссенциальная гипертензия, гетерогенное заболевание, отдаленные последствия которого могут быть повреждение конечного органа, может включать, по крайней мере, в некоторых случаях сверхактивность этой системы, которой пытаются противодействовать несколько типов лекарств.[21] Ренин концентрация в плазма крови имеет тенденцию быть выше у молодых людей с гипертонией, когда сужение сосудов может быть основной причиной высокого кровяного давления. И наоборот, уровень ренина ниже у пожилых людей или у людей афроамериканской или афро-карибской национальности, когда задержка соли может в большей степени способствовать повышению артериального давления.[21] Тем не менее, роль уровней ренина плазмы в этиологии и лечении артериальной гипертонии является спорной.[24]
Механизм действия
Ингибиторы ренина связываются с активный сайт ренина и ингибируют связывание ренина с ангиотензиногеном, что является определяющей стадией каскада РААС.[21] Следовательно, ингибиторы ренина предотвращают образование Ang I и Ang II. Ингибиторы ренина также могут предотвращать образование Ang- (1-7), Ang- (1-9) и Ang- (1-5),[25] хотя неизвестно, насколько это важно с клинической точки зрения. Ренин очень селективен из-за его единственного встречающегося в природе субстрат который является ангиотензиногеном, и случаи нежелательных побочных эффектов при приеме ингибитора ренина нечасты.[26] и аналогично антагонисты рецепторов ангиотензина II.[27] Ang II также действует в RAAS как отрицательная обратная связь, подавляя дальнейшее высвобождение ренина. Снижение уровней Ang II или блокада рецепторов ангиотензина подавляет петлю обратной связи и приводит к повышению концентрации ренина в плазме (PRC) и активность ренина плазмы (PRA). Это может быть проблематично для Ингибитор АПФ и антагонист рецепторов ангиотензина II терапии, поскольку повышенный PRA может частично преодолеть фармакологическое ингибирование каскада RAAS. Поскольку ингибиторы ренина напрямую влияют на активность ренина, снижение PRA, несмотря на увеличение PRC (из-за потери отрицательной обратной связи), может быть клинически полезным.[28]
Открытие и разработка лекарств
Пепстатин - первый ингибитор ренина
Пепстатин был первым синтетический ингибитор ренина. Это из микробный происхождение и является N-ацилпентапептидом, точнее: изовалерил-L-валил-L-валил-статил-L-аланилстатин.[8][29] Пепстатин оказался сильнодействующим конкурентный ингибитор большинства аспарагиновых протеаз, но слабый ингибитор ренина.[30] Первоначально считалось, что он эффективен при лечении дуоденальный язвы, и прошел клинические испытания, но безуспешно.[31][32] Статина, аминокислота, считается ответственным за ингибирующую активность пепстатина, потому что он имитирует тетраэдрическую переходное состояние пептида катализ.[33] Потому что гидрофобный свойства статина, у пепстатина очень низкие растворимость в физиологических средах.[34] Поскольку он имел низкую активность и плохую растворимость, он не входил в состав in vivo исследования.
Первое поколение: аналоги пептидов

Это поколение состоит из двух групп соединений, либо пептидных аналогов просегмента ренина.[35] или пептидные аналоги аминоконцевая часть субстрата ангиотензиногена.[13][36][37] Препараты последней группы оказались эффективными в подавлении активности ренина и снижении артериального давления как у животных, так и у людей.[38] К сожалению, их пришлось отдать парентерально из-за плохой биодоступности. Также оказалось, что у них короткая продолжительность действия, низкие потенции и их способность снижать артериальное давление была недостаточной. Ни один из этих препаратов не прошел клинических исследований.[28]
Второе поколение: пептидные миметики

Соединения этого поколения были более мощными, более стабильными и имели более продолжительное действие. Один из них, CGP2928, a пептидомиметик соединение, было первым ингибитором ренина, доказавшим свою эффективность при пероральном приеме. Проверено на мартышки, он был активен только в высоких дозах.[12] Разработка новых лекарств второго поколения продолжала улучшать фармакокинетические свойства. Затем были обнаружены ремикирен, эналкирен и занкирен. Это были пептидомиметические ингибиторы с улучшенными структурами, которые сделали их более специфичными, мощными и стабильными. К сожалению, клинические разработки были прекращены, поскольку препараты имели низкую биодоступность при пероральном приеме (плохо всасывались и быстро метаболизировались), а активность снижения артериального давления оставалась низкой.[7][22][28]
Третье поколение: непептиды
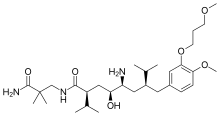
Алискирен, перорально активный непептидный ингибитор ренина, был первым лекарством в своем классе на рынке. Он используется для лечения гипертонии как монотерапия или в сочетании с другими антигипертензивными средствами.[7][39] Ключ к открытию алискирена был кристаллография и молекулярное моделирование техники. Теперь найдено решение проблемы, препятствовавшей разработке ингибиторов ренина предыдущих поколений. Было известно, что непептидные вещества способны решать проблемы плохих фармакокинетических свойств и низкой специфичности. Это привело к созданию небольших молекул, непептидных ингибиторов, которые были очень сильными и специфичными по отношению к ренину человека.[22][40]
Однако из-за их химической структуры даже ингибиторы ренина третьего поколения трудно всасываются организмом человека, и их пероральная биодоступность часто составляет менее 2%.
Связь связывания и структурной активности ингибиторов ренина
Молекула ренина - моноспецифический фермент, принадлежащий к семейству аспарагиновых протеаз.[41] Его структура сложная и состоит из двух гомологичных долей, которые складываются преимущественно в виде β-лист конформация.[22] Между двумя долями, глубоко внутри фермента, находится активный сайт, а его каталитическая активность обусловлена двумя аспарагиновая кислота остатки (Asp32 и Asp 215, по одному от каждой доли в молекуле ренина).[42] Гибкий лоскут из аминокислот, образованный в β-шпилька закрывает активный участок, закрывая щель.[43]Молекула ренина содержит как гидрофобные, так и гидрофильный аминокислоты. Гидрофильные, как правило, находятся снаружи молекулы, в то время как гидрофобные, как правило, больше внутри и образуют активный центр, большую гидрофобную полость.[44] который может вместить лиганд минимум с семью остатками. Основная связь между лигандом и ферментом заключается в водородная связь. Остатки названы в честь их мест в лиганде, остатки, ближайшие к сайту расщепления, названы P1 и P1 ', и они связываются в карманы S1 и S1' соответственно. Имеется четыре кармана S и три кармана S '(таблица 1). Карманы чередуются по обе стороны от остова лиганда. Это изменение влияет на ориентацию карманов, заставляя карманы S3 и S1 располагаться вместе, а карман S2 - близко к обоим карманам S4 и S1 '.[43] Факты свидетельствуют о том, что близко расположенные карманы S1 и S3 сливаются, образуя просторный суперкарман.[45]Лиганды, которые наполняют суперкарман, обладают большей эффективностью, чем те, которые не заполняют его, занимая увеличивает потенция В 200 раз. Эти лиганды могут быть структурно разнообразными и образовывать ван дер Ваальс связывается с поверхностью суперкармана.[11]Из кармана S3 тянется сайт связывания, отличный от ренина, S3зр подкарман.[41]S3зр подкарман может вместить как гидрофобные, так и полярный остатков, карман может вместить три молекулы воды, но также липофильный природа. S3зр subpocket не является конформационно гибким, поэтому остатки, занимающие карман, должны иметь определенные характеристики. Они не могут быть стерически сложными и должны иметь достаточно большое количество вращающихся связей и быть способными соединяться водородными связями. Карман S2 большой, двудольный и гидрофобный, но может вмещать как гидрофобные, так и полярные лиганды. Такое разнообразие возможных полярностей предлагает возможность изменения связи остатка P2 с ферментом. S3-S1 и S3зр субкарманы были основной целью разработки лекарств, но недавние открытия указали на другие интересные места. Доказано, что взаимодействие с карманами на участке S имеет решающее значение для близость, особенно S1 ′ и S2 ′, и in vitro тесты показали, что взаимодействие с областью лоскута может быть важным для аффинности.[11]

| Карман | Характеристики[11] | Подсайт | Важность привязки[11][46] |
|---|---|---|---|
| S4 | Гидрофобный | P4 | Относительно важно для переплета |
| S3 | Гидрофобный | P3 | Очень важно для переплета |
| S3зр | Одинаково гидрофобный / -фильный | Боковая цепь P3 | Значительно увеличивает сродство связывания |
| S2 | Большой и гидрофобный | P2 | Важно для переплета |
| S1 | Большой и гидрофобный | P1 | NA |
| S1 ′ | В первую очередь гидрофобный | P1 ′ | Критично для плотного связывания |
| S2 ′ | Полярный | P2 ′ | Критично для плотного связывания |
| S3 ′ | NA | P3 ′ | Структура и присутствие не так важны |
Взаимодействие с обеими аспарагиновыми кислотами в активном центре приводит к более высокому сродству. Более высокая аффинность также является результатом занятия более активных участков сайта. Однако некоторые карманы способствуют большей близости, чем другие. Гидрофобное взаимодействие с S3зр subpocket, S1 и S3 способствуют более высокой активности и сродству.[47] Имея большой и ароматный остаток в P3 увеличивает ингибирующую активность.[48] Занятие S3зр subpocket может увеличивать эффективность в 50 раз и приводит к прочному связыванию.[11]
Пример связывания с ингибитором ренина: Алискирен является пептидоподобным ингибитором ренина и, в отличие от большинства, довольно гидрофильным. Он блокирует каталитическую функцию фермента, занимая карманы от S3 до S2 ', за исключением кармана S2. Алискирен также связывается с S3зр субкарман и поскольку этот карман отличается для ренина, алискирен не ингибирует другие аспарагиновые протеазы, такие как катепсин D и пепсин.[46]Боковая цепь алискирена связывает S3зр subpocket в идеале и приводит к его качеству ингибитора человеческого ренина.[11]Гидроксильная группа в алискирене образует водородную связь с обоими атомами кислорода Жерех 32. The амин группа образует водородную связь с карбоновая кислота группа Gly 217 и атом кислорода Asp32. В метокси группа на ароматическом кольце заполняет карман S3 и, возможно, может образовывать водородную связь с вторичной аминогруппой Тюр 14. Амидная группа образует водородную связь с вторичной аминогруппой Сер 76.[47] Карманы S1 и S1 'заняты двумя пропил группы в позициях P1 и P1 ′.[45] Конечный амид в положении P2 'закрепляет амидный хвост в активном центре, образуя водородную связь с Arg 74 в кармане S2 ′.[49]
Текущее состояние
Алискирен эффективен при снижении артериального давления,[7][28] но по состоянию на 20 апреля 2012 г. Управление по контролю за продуктами и лекарствами (FDA) выпустило предупреждение о возможных рисках при использовании алискирена или препаратов артериального давления, содержащих алискирен, с ингибиторами АПФ и блокаторами рецепторов ангиотензина (БРА) у пациентов с диабетом или почечной (почечной) недостаточностью. Они посоветовали не использовать такие комбинации препаратов у пациентов с диабетом из-за риска почечной недостаточности. гипотония, и гиперкалиемия и что алискирен не следует использовать с БРА или ингибиторами АПФ у пациентов с почечной недостаточностью от умеренной до тяжелой (т. е. у которых скорость клубочковой фильтрации [СКФ] <60 мл / мин). Однако они также рекомендуют пациентам не прекращать прием алискирена, не посоветовавшись с врачом.[50]
Алискирен в сочетании с гидрохлоротиазид был одобрен FDA в 2008 году под торговой маркой Tekturna HCT.[51][52]
В 2007 году компании Actelion / Merck и Speedel объявили, что у них есть новое поколение ингибиторов ренина в клинических исследованиях. Свинцовый состав от Actelion / Merck вступил в фазу II испытаний. Одно соединение от Speedel, SPP635, завершило фазу IIa. Результаты показали, что он безопасен и хорошо переносится в течение четырех недель, а также снижает артериальное давление на 9,8-17,9 мм рт. В 2008 г. продолжалась фаза II разработки SPP635 для лечения гипертонии в диабетик пациенты. Другие ингибиторы ренина от Speedel проходят клинические испытания. Два из них, SPP1148 и SPP676, вошли в фазу I. Остальные находятся в доклинические фазы, компаунд SPP1234 и компаунды серии SPP800.[51]
Следующее поколение ингибиторов ренина продемонстрировало потенциальные улучшения по сравнению с предыдущими поколениями, когда биодоступность у людей увеличилась до 30%, а ткани у них лучше. распространение.[51][ненадежный источник ]
Смотрите также
использованная литература
- ^ Грэдман А.Х., Шмидер Р.Э., Линс Р.Л., Нуссбергер Дж., Чан Й., депутат Бедиджана (март 2005 г.). «Алискирен, новый эффективный для перорального применения ингибитор ренина, обеспечивает дозозависимую антигипертензивную эффективность и переносимость, подобную плацебо, у пациентов с гипертонией». Тираж. 111 (8): 1012–8. Дои:10.1161 / 01.CIR.0000156466.02908.ED. PMID 15723979.
- ^ «Ингибиторы ренина». CV Фармакология. Получено 2020-07-22.
- ^ Накано, Стефани Дж .; Эверитт, Мелани Д. (2018). «Нейрогормональная ось и натрийуретические пептиды при сердечной недостаточности». Сердечная недостаточность у детей и молодых людей. Эльзевир. С. 75–86. Дои:10.1016 / b978-0-12-802393-8.00006-5. ISBN 978-0-12-802393-8.
- ^ "Система Ренин-Ангиотензин-Альдостерон". TeachMeФизиология. 2020-04-28. Получено 2020-07-22.
- ^ Нуссбергер, Юрг (2005). «Ингибиторы ренина». Гипертония. Эльзевир. С. 754–764. Дои:10.1016 / b978-0-7216-0258-5.50162-9. ISBN 978-0-7216-0258-5.
- ^ а б Lambers Heerspink, Hiddo J .; Фьоретто, Паола; де Зеув, Дик (2014). «Патогенез, патофизиология и лечение диабетической нефропатии». Учебник по заболеваниям почек Национального фонда почек. Эльзевир. С. 222–234. Дои:10.1016 / b978-1-4557-4617-0.00025-х. ISBN 978-1-4557-4617-0.
- ^ а б c d е ж г час я j k Jensen, C .; Herold, P .; Бруннер, Х. Р. (2008). «Алискирен: первый ингибитор ренина для клинического лечения». Обзоры природы Drug Discovery. 7 (5): 399–410. Дои:10.1038 / nrd2550. PMID 18340340. S2CID 19633316.
- ^ а б c Gross, F .; Lazar, J .; Орт, Х. (1972). «Ингибирование реакции ренин-ангиотензиноген пепстатином». Наука. 175 (22): 656. Bibcode:1972Научный ... 175..656G. Дои:10.1126 / science.175.4022.656. PMID 4109853. S2CID 8348522.
- ^ а б Ferrario, C.M .; Айер, С. Н. (1998). «ангиотензин- (1-7): биоактивный фрагмент ренин-ангиотензиновой системы». Регуляторные пептиды. 78 (1–3): 13–18. Дои:10.1016 / s0167-0115 (98) 00134-7. PMID 9879742.
- ^ а б Филлипс, М. И .; Шмидт-Отт, К. М. (1999). «Открытие Ренина 100 лет назад». Новости физиологических наук. 14 (6): 271–274. Дои:10.1152 / Physiologyonline.1999.14.6.271. PMID 11390864.
- ^ а б c d е ж г час Webb, R. L .; Schiering, N .; Sedrani, R .; Майбаум, Дж. Р. (2010). «Прямые ингибиторы ренина как новая терапия гипертонии». Журнал медицинской химии. 53 (21): 7490–7520. Дои:10.1021 / jm901885s. PMID 20731374.
- ^ а б c Wood, J.M .; Гулати, Н .; Forgiarini, P .; Fuhrer, W .; Хофбауэр, К. Г. (1985). «Влияние специфического ингибитора ренина длительного действия на мартышку». Гипертония. 7 (5): 797–803. Дои:10.1161 / 01.hyp.7.5.797. PMID 3928488.
- ^ а б Szelke, M .; Leckie, B .; Hallett, A .; Джонс, Д. М .; Sueiras, J .; Атраш, Б .; Левер А.Ф. (1982). «Новые мощные ингибиторы ренина человека». Природа. 299 (5883): 555–557. Bibcode:1982Натура.299..555С. Дои:10.1038 / 299555a0. PMID 6750410. S2CID 4306900.
- ^ Segall, L .; Covic, A .; Голдсмит, Д. Дж. А. (2007). «Прямые ингибиторы ренина: начало новой эры или просто вариация на тему?». Нефрологическая диализная трансплантация. 22 (9): 2435–2439. Дои:10.1093 / ndt / gfm363. PMID 17556409.
- ^ Nussberger, J .; Wuerzner, G .; Jensen, C .; Бруннер, Х. Р. (2002). «Подавление ангиотензина II у людей пероральным активным ингибитором ренина Алискиреном (SPP100): сравнение с эналаприлом». Гипертония. 39 (1): E1 – E8. Дои:10.1161 / hy0102.102293. PMID 11799102.
- ^ Musini, VM; Фортин, PM; Бассетт, К; Райт, JM (2008). «Эффективность снижения артериального давления ингибиторов ренина при первичной гипертензии». Кокрановская база данных систематических обзоров. 4 (4): CD007066. Дои:10.1002 / 14651858.CD007066.pub2. PMID 18843743.
- ^ Weir MR (сентябрь 2007 г.). «Влияние ингибирования ренин-ангиотензиновой системы на защиту органов-мишеней: можем ли мы сделать лучше?». Clin Ther. 29 (9): 1803–24. Дои:10.1016 / j.clinthera.2007.09.019. PMID 18035185.
- ^ а б Кастроп Х., Хёхерль К., Курц А., Шведа Ф., Тодоров В., Вагнер С. (апрель 2010 г.). «Физиология ренина почек». Physiol. Rev. 90 (2): 607–73. CiteSeerX 10.1.1.455.1972. Дои:10.1152 / Physrev.00011.2009. PMID 20393195.
- ^ Tice, C.M .; Xu, Z .; Yuan, J .; Simpson, R.D .; Cacatian, S.T .; Flaherty, P.T .; Zhao, W .; Guo, J .; Ищенко, А .; Singh, S. B .; Wu, Z .; Scott, B.B .; Бухтияров, Ю .; Berbaum, J .; Mason, J .; Панемангалор, Р .; Cappiello, M. G .; Müller, D .; Харрисон, Р. К .; McGeehan, G.M .; Dillard, L.W .; Болдуин, Дж. Дж .; Кларемон, Д. А. (2009). «Дизайн и оптимизация ингибиторов ренина: пероральные биодоступные алкиламины». Письма по биоорганической и медицинской химии. 19 (13): 3541–3545. Дои:10.1016 / j.bmcl.2009.04.140. PMID 19457666.
- ^ а б c Феррарио, К. М. (2006). «Роль ангиотензина II в терапевтических последствиях сердечно-сосудистых заболеваний в результате более чем столетних исследований». Журнал системы ренин-ангиотензин-альдостерон. 7 (1): 3–14. Дои:10.3317 / jraas.2006.003. PMID 17083068.
- ^ а б c d е Браун, М. Дж. (2006). «Прямое ингибирование ренина - новый способ воздействия на рениновую систему». Журнал системы ренин-ангиотензин-альдостерон. 7 (2 доп.): S7 – S11. Дои:10.3317 / jraas.2006.035. S2CID 73232791.
- ^ а б c d Rahuel, J .; Rasetti, V .; Maibaum, J .; Rüeger, H .; Göschke, R .; Cohen, N.C .; Stutz, S .; Тмин, F .; Fuhrer, W .; Wood, J.M .; Грюттер, М. Г. (2000). «Дизайн лекарственного средства на основе структуры: открытие новых непептидных перорально активных ингибиторов ренина человека». Химия и биология. 7 (7): 493–504. Дои:10.1016 / S1074-5521 (00) 00134-4. PMID 10903938.
- ^ а б c Hsueh, W. A .; Вайн, К. (2011). «Ренин-ангиотензин-альдостероновая система при диабете и гипертонии». Журнал клинической гипертензии. 13 (4): 224–237. Дои:10.1111 / j.1751-7176.2011.00449.x. PMID 21466617.
- ^ Мозер М., Иззо Дж. Л. (2003). «Измерение ренина в плазме при лечении гипертонии: гипотеза V и R». J Clin Hypertens (Гринвич). 5 (6): 373–6. Дои:10.1111 / j.1524-6175.2003.02870.x. PMID 14688491.
- ^ Мюллер, Д. Н .; Derer, W .; Деченд, Р. (2008). «Алискирен - механизм действия и доклинические данные». Журнал молекулярной медицины. 86 (6): 659–662. Дои:10.1007 / s00109-008-0330-6. PMID 18443751. S2CID 23697321.
- ^ Weir, M .; Буш, С .; Андерсон, Д .; Zhang, J .; Киф, Д .; Сатлин, А. (2007). «Антигипертензивная эффективность, безопасность и переносимость перорального прямого ингибитора ренина алискирена у пациентов с артериальной гипертензией: объединенный анализ». Журнал Американского общества гипертонии. 1 (4): 264–277. Дои:10.1016 / Яш.2007.04.004. PMID 20409858.
- ^ Гао Д., Нин Н, Ню Х, Вэй Дж, Сунь П, Хао Г (май 2011 г.). «Алискирен против блокаторов рецепторов ангиотензина при артериальной гипертензии: метаанализ рандомизированных контролируемых исследований». Am. J. Hypertens. 24 (5): 613–21. Дои:10.1038 / ajh.2011.3. PMID 21293386.
- ^ а б c d Staessen, J. A .; Li, Y .; Ричарт, Т. (2006). «Оральные ингибиторы ренина». Ланцет. 368 (9545): 1449–1456. Дои:10.1016 / S0140-6736 (06) 69442-7. PMID 17055947. S2CID 20729350.
- ^ Umezawa, H .; Аояги, Т .; Morishima, H .; Matsuzaki, M .; Hamada, M .; Такеучи, Т. (1970). «Пепстатин, новый ингибитор пепсина, производимый актиномицетами». Журнал антибиотиков. 23 (5): 259–262. Дои:10.7164 / антибиотики. 23.259. PMID 4912600.
- ^ Фишер, Н. Д. Л .; Холленберг, Н. К. (2005). "Подавление ренина: каковы терапевтические возможности?". Журнал Американского общества нефрологов. 16 (3): 592–599. Дои:10.1681 / ASN.2004100874. PMID 15703270.
- ^ Bonnevie, O .; Свендсен, Л. Б .; Holst-Christensen, J .; Johansen, T. S .; Søltoft, J .; Кристиансен, П. М. (1979). «Двойное слепое рандомизированное клиническое испытание пепсин-ингибирующего пентапептида (пепстатина) при лечении язвы двенадцатиперстной кишки». Кишечник. 20 (7): 624–628. Дои:10.1136 / гут.20.7.624. ЧВК 1412504. PMID 385457.
- ^ Свендсен, Л. Б .; Кристиансен, П. М .; Бонневи, О. (1979). "Терапия язвы желудка пептидом, инактивирующим пепсин, пепстатином: двойное слепое рандомизированное клиническое испытание". Скандинавский журнал гастроэнтерологии. 14 (8): 929–932. PMID 394302.
- ^ Marciniszyn Jr, J .; Hartsuck, J. A .; Тан Дж. (1976). «Режим ингибирования кислотных протеаз пепстатином». Журнал биологической химии. 251 (22): 7088–7094. PMID 993206.
- ^ Eid, M .; Evin, G .; Castro, B .; Menard, J .; Корвол П. (1981). «Новые ингибиторы ренина, гомологичные пепстатину». Биохимический журнал. 197 (2): 465–471. Дои:10.1042 / bj1970465. ЧВК 1163147. PMID 7034718.
- ^ Тмин, F .; Evin, G .; Fehrentz, J. A .; Seyer, R .; Castro, B .; Menard, J .; и другие. (1985). «Ингибирование человеческого ренина синтетическими пептидами, полученными из его просегмента». J Biol Chem. 260 (16): 9154–9157. PMID 3894354.
- ^ Szelke, M .; Leckie, B.J .; Дерево, М .; Браун, А .; Grant, J .; Hallett, A .; и другие. (1982). «H-77: новый мощный ингибитор ренина. Исследования in vitro и in vivo». Гипертония. 4 (3, п. 2): 59–69. Дои:10.1161 / 01.HYP.4.3_Pt_2.59. PMID 7040240.
- ^ Дерево, М .; Атраш, Б .; Донован, Б .; Gamble, J .; Hallett, A .; Hughes, M .; Джонс, Д. М .; Leckie, B .; Lever, A. F .; Мортон, Дж. Дж .; Szelke, М. (1983). «Новые ингибиторы человеческого ренина, испытанные in vitro и in vivo на анестезированном павиане». Журнал гипертонии. 1 (4): 399–403. Дои:10.1097/00004872-198312000-00013. PMID 6398331.
- ^ Уэбб, Д. Дж .; Manhem, P.J .; Ball, S. G .; Inglis, G .; Leckie, B.J .; Lever, A. F .; Мортон, Дж. Дж .; Робертсон, Дж. И .; Мюррей, Г. Д .; Ménard, J .; Hallett, A .; Джонс, Д. М .; Szelke, М. (1985). «Исследование ингибитора ренина H142 на человеке». Журнал гипертонии. 3 (6): 653–658. Дои:10.1097/00004872-198512000-00013. PMID 3910726.
- ^ Риччони, Грациано (14 июня 2013 г.). «Роль прямых ингибиторов ренина в лечении пациентов с гипертоническим диабетом». Терапевтические достижения в эндокринологии и метаболизме. Публикации SAGE. 4 (5): 139–145. Дои:10.1177/2042018813490779. ISSN 2042-0188. ЧВК 3799297. PMID 24143271.
- ^ Клод Коэн, Н. (2007). «Дизайн лекарств на основе структуры и открытие алискирена (Tekturna): настойчивость и креативность для преодоления проблем, связанных с разработкой и исследованиями». Химическая биология и дизайн лекарств. 70 (6): 557–565. Дои:10.1111 / j.1747-0285.2007.00599.x. PMID 17999663.
- ^ а б Winiecka, I .; Dudkiewicz-Wilczyńska, J .; Роман, И .; Парушевский, Р. (2010). «Новые потенциальные ингибиторы ренина с дипептидными заменами в молекуле». Acta Poloniae Pharmaceutica. 67 (4): 367–374. PMID 20635532.
- ^ Gradman, A. H .; Кад Р. (2008). «Ингибирование ренина при гипертонии. [Обзор]». J Am Coll Cardiol. 51 (5): 519–528. Дои:10.1016 / j.jacc.2007.10.027. PMID 18237679.
- ^ а б Lunney, E. A .; Гамильтон, H.W .; Hodges, J.C .; Kaltenbronn, J. S .; Repine, J. T .; Бадассо, М .; Cooper, J. B .; Dealwis, C .; Wallace, B.A .; Лоутер, В. Т. (1993). «Анализ связывания лиганда в пяти кристаллических комплексах эндотиапепсина и их использование при разработке и оценке новых ингибиторов ренина». Журнал медицинской химии. 36 (24): 3809–3820. Дои:10.1021 / jm00076a008. PMID 8254610.
- ^ Matter, H .; Scheiper, B .; Steinhagen, H .; Böcskei, Z .; Fleury, V. R .; МакКорт, Г. (2011). «Структурный дизайн и оптимизация мощных ингибиторов ренина на 5- или 7-азаиндольных каркасах». Письма по биоорганической и медицинской химии. 21 (18): 5487–5492. Дои:10.1016 / j.bmcl.2011.06.112. PMID 21840215.
- ^ а б Yuan, J .; Simpson, R.D .; Zhao, W .; Tice, C.M .; Xu, Z .; Cacatian, S .; Jia, L .; Flaherty, P.T .; Guo, J .; Ищенко, А .; Wu, Z .; McKeever, B.M .; Scott, B.B .; Бухтияров, Ю .; Berbaum, J .; Панемангалор, Р .; Bentley, R .; Doe, C.P .; Харрисон, Р. К .; McGeehan, G.M .; Singh, S. B .; Dillard, L.W .; Болдуин, Дж. Дж .; Кларемон, Д. А. (2011). «Ингибиторы ренина бифенил / дифениловый эфир: заполнение кармана S1 ренина через карман S3». Письма по биоорганической и медицинской химии. 21 (16): 4836–4843. Дои:10.1016 / j.bmcl.2011.06.043. PMID 21741239.
- ^ а б Wood, J.M .; Maibaum, J .; Rahuel, J .; Grütter, M. G .; Cohen, N.C .; Rasetti, V .; Rüger, H .; Göschke, R .; Stutz, S .; Fuhrer, W .; Schilling, W .; Rigollier, P .; Yamaguchi, Y .; Тмин, F .; Baum, H.P .; Schnell, C.R .; Herold, P .; Mah, R .; Jensen, C .; O'Brien, E .; Стэнтон, А .; Бедигян, М. П. (2003). «Дизайн на основе структуры алискирена, нового перорального эффективного ингибитора ренина». Сообщения о биохимических и биофизических исследованиях. 308 (4): 698–705. Дои:10.1016 / S0006-291X (03) 01451-7. PMID 12927775.
- ^ а б Politi, A .; Durdagi, S .; Moutevelis-Minakakis, P .; Kokotos, G .; Мавромустакос, Т. (2010). «Разработка точных предсказаний аффинности связывания новых ингибиторов ренина посредством молекулярных исследований стыковки». Журнал молекулярной графики и моделирования. 29 (3): 425–435. Дои:10.1016 / j.jmgm.2010.08.003. PMID 20855222.
- ^ Акахане, К .; Umeyama, H .; Nakagawa, S .; Moriguchi, I .; Hirose, S .; Iizuka, K .; Мураками, К. (1985). «Трехмерная структура ренина человека». Гипертония. 7 (1): 3–12. Дои:10.1161 / 01.hyp.7.1.3. PMID 3884499.
- ^ Wu, Y .; Shi, C .; Солнце, X .; Wu, X .; Солнце, Х. (2011). «Синтез, биологическая оценка и стыковочные исследования ингибиторов ренина на основе октан-карбоксамида с расширенными сегментами по направлению к сайту S3 'ренина». Биоорганическая и медицинская химия. 19 (14): 4238–4249. Дои:10.1016 / j.bmc.2011.05.059. PMID 21708467.
- ^ https://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm301120.htm
- ^ а б c Speedel Приобретение дополнительных 51,7% акций и объявление о планах проведения обязательного публичного тендера. ОБЗОР ТРАНЗАКЦИЙ. (2008). От Novartis: http://www.novartis.com/downloads/investors/presentations-events/other-events/2008/2008-07_speedel-backgrounder.pdf
- ^ Тектурна HCT (алискирен; гидрохлоротиазид) таблетки. (2011). От Управления по контролю за продуктами и лекарствами США: http://www.accessdata.fda.gov/drugsatfda_docs/label/2011/022107s009lbl.pdf
внешние ссылки
- Ингибитор ренина алискирен приводит к дозозависимому снижению артериального давления - medicalnewstoday.com.
