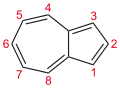
Азулен - Azulene
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Азулен | |||
| Систематическое название ИЮПАК Бицикло [5.3.0] декапентаен | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.005.449 | ||
| КЕГГ | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Свойства | |||
| C10ЧАС8 | |||
| Молярная масса | 128.174 г · моль−1 | ||
| Температура плавления | От 99 до 100 ° C (от 210 до 212 ° F, от 372 до 373 K) | ||
| Точка кипения | 242 ° С (468 ° F, 515 К) | ||
| -98.5·10−6 см3/ моль г / л[1] | |||
| Термохимия | |||
Станд. Энтальпия горение (ΔcЧАС⦵298) | −1266,5 ккал / моль[2] | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Азулен является органическое соединение и изомер из нафталин. Нафталин бесцветен, а азулен темно-синий. Два терпеноида, ветивазулен (4,8-диметил-2-изопропилазулен) и гваязулен (1,4-диметил-7-изопропилазулен), которые имеют азуленовый скелет, встречаются в природе как составляющие пигментов в грибах, масло гваякового дерева, и некоторые морские беспозвоночные.
Азулен имеет долгую историю, восходящую к 15 веку как лазурно-голубой хромофор получено паровая дистилляция из Немецкая ромашка. Хромофор был открыт в тысячелистник и полынь горькая и назван в 1863 году Септимусом Писсе. О его структуре впервые сообщил Лавослав Ружичка, а затем его органический синтез в 1937 году Плацидус Платтнер.
Структура и склеивание

Азулен обычно рассматривается как результат слияния циклопентадиен и циклогептатриен кольца. Как нафталин и циклодекапентаен, это 10 пи электрон система. Он показывает ароматный свойства: (i) периферийный облигации имеют одинаковую длину и (ii) подвержены Friedel-Crafts -подобные замены. Прирост стабильности от ароматичности оценивается вдвое по сравнению с нафталином.
это дипольный момент является 1.08 D,[4] в отличие от нафталина, у которого дипольный момент равен нулю. Эту полярность можно объяснить, рассматривая азулен как синтез 6 π-электрон циклопентадиенил анион и 6 π-электронов катион тропилия: один электрон из семичленного кольца переносится в пятичленное кольцо, чтобы придать каждому кольцу ароматическую стабильность за счет Правило Хюккеля. Исследования реакционной способности подтверждают, что семичленное кольцо электрофильно, а пятичленное кольцо является электрофильным. нуклеофильный.

Диполярный характер основного состояния отражается в его глубоком цвете, который необычен для небольших ненасыщенных ароматических соединений.[5] Еще одна примечательная особенность азулена - нарушение Правило Каши проявляя флуоресценцию из верхнего возбужденного состояния (S2 → S0).[6]
Органический синтез
Пути синтеза азулена давно вызывают интерес из-за его необычной структуры.[7] В 1939 году о первом методе сообщили Санкт-Пфау и Платтнер. [8] начиная с индан и этилдиазоацетат.
Эффективный один горшок маршрут влечет за собой аннулирование из циклопентадиен с ненасыщенным C5-синтоны.[9] Альтернативный подход от циклогептатриен давно известен, один иллюстративный метод показан ниже.[10][11]
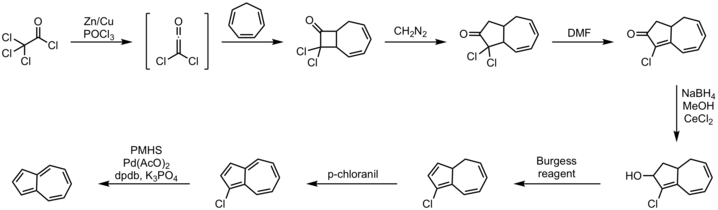
Процедура:
- циклогептатриен 2+2 циклоприсоединение с дихлор кетен
- диазометан реакция вставки
- дегидрогалогенирование реакция с DMF
- Сокращение Luche к алкоголю с борогидрид натрия
- реакция элиминации с участием Реагент Берджесса
- окисление с участием п-хлоранил
- дегалогенирование с участием полиметилгидросилоксан, ацетат палладия (II), калий фосфат и Лиганд DPDB
Металлоорганические комплексы
В металлоорганическая химия, азулен служит лигандом для низковалентных металлических центров, которые, как известно, образуют π-комплексы с обоими циклопентадиенил и циклогептатриенильные лиганды. Иллюстративные комплексы (азулен) Mo2(CO)6 и (азулен) Fe2(CO)5.[12]
Родственные соединения
1-Гидроксиазулен - нестабильное зеленое масло, не показывающее кето-енольная таутомерия.[13] 2-Гидроксиазулен получают гидролизом 2-метоксиазулена бромистоводородной кислотой. Он стабилен и демонстрирует кето-енольную таутомерию.[14] В пKа 2-гидроксиазулена в воде составляет 8,71. Он более кислый, чем фенол или нафтол. РKа 6-гидроксиазуленов в воде составляет 7,38, что делает ее более кислой, чем фенол или нафтол.[14]
В нафте [а] азулен, а нафталин кольцо конденсировано по 1,2-положениям азулена. В одной такой системе[15] деформация от планарности аналогична деформации тетрагелицен.
Гуаязулене (1,4-диметил-7-изопропилазулен) представляет собой алкилированное производное азулена с почти идентичным интенсивным синим цветом. Он коммерчески доступен для косметической промышленности, где действует как кондиционирующее средство для кожи.
использованная литература
- ^ Sweet, L.I .; Мейер, П. Г. (1997). «Смертельное и сублетальное действие азулена и лонгифолена на Microtox®, Ceriodaphnia dubia, Daphnia magna и Pimephales promelas» (PDF). Бюллетень загрязнения окружающей среды и токсикологии. 58 (2): 268–274. Дои:10.1007 / s001289900330. HDL:2027.42/42354. PMID 8975804.
- ^ Солтер, Карл; Форесман, Джеймс Б. (1998). «Нафталин и азулен I: калориметрия полумикробомб и квантово-механические расчеты». Журнал химического образования. 75 (10): 1341. Bibcode:1998JChEd..75.1341S. Дои:10.1021 / ed075p1341.
- ^ Harmon, A.D .; Weisgraber, K. H .; Вайс, У. (1980). «Преформированные азуленовые пигменты Lactarius indigo (Schw.) Fries (Russulaceae, Basidiomycetes) ». Experientia. 36: 54–56. Дои:10.1007 / BF02003967. S2CID 21207966.
- ^ Андерсон, Артур Дж .; Стеклер, Бернард М. (1959). «Азулен. VIII. Исследование спектров видимого поглощения и дипольных моментов некоторых 1- и 1,3-замещенных азуленов». Журнал Американского химического общества. 81 (18): 4941–4946. Дои:10.1021 / ja01527a046.
- ^ Михл, Джозеф; Thulstrup, E. W. (1976). «Почему азулен синий, а антрацен белый? Простая картина». Тетраэдр. 32 (2): 205. Дои:10.1016/0040-4020(76)87002-0.
- ^ Tétreault, N .; Muthyala, R. S .; Liu, R. S. H .; Стир, Р.П. (1999). «Управление фотофизическими свойствами многоатомных молекул путем замещения и сольватации: второе возбужденное синглетное состояние азулена». Журнал физической химии А. 103 (15): 2524–31. Bibcode:1999JPCA..103.2524T. Дои:10.1021 / jp984407q.
- ^ Гордон, Максвелл (1 февраля 1952 г.). «Азулены». Химические обзоры. 50 (1): 127–200. Дои:10.1021 / cr60155a004.
- ^ Санкт-Пфау, Александр; Платтнер, пл. А. (1939). "Zur Kenntnis der flüchtigen Pflanzenstoffe VIII. Synthese des Vetivazulens". Helvetica Chimica Acta. 22: 202–208. Дои:10.1002 / hlca.19390220126.
- ^ Хафнер, Клаус; Мейнхардт, Клаус-Петер (1984). «Азулен». Органический синтез. 62: 134. Дои:10.15227 / orgsyn.062.0134.
- ^ Карре, Себастьян; Блан, Орельен; Кокерель, Йоанн; Бертод, Микаэль; Грин, Эндрю Э .; Депрес, Жан-Пьер (2005). «Подход к блюзу: очень гибкий путь к Азуленам». Angewandte Chemie International Edition. 44 (32): 5130–5133. Дои:10.1002 / anie.200501276. PMID 16013070.
- ^ Lemal, Дэвид М .; Гольдман, Гленн Д. (1988). «Синтез азулена, голубого углеводорода». Журнал химического образования. 65 (10): 923. Bibcode:1988JChEd..65..923L. Дои:10.1021 / ed065p923.
- ^ Черчилль, Мелвин Р. (2007). «Комплексы переходных металлов азулена и родственных лигандов». Прогресс в неорганической химии. С. 53–98. Дои:10.1002 / 9780470166123.ch2. ISBN 9780470166123.
- ^ Асао, Тойонобу; Сюндзи Ито; Нобору Морита (1989). «1-Гидроксиазулен и 3-гидроксигвайазулен: Синтез и их свойства». Буквы Тетраэдра. 30 (48): 6693–6696. Дои:10.1016 / S0040-4039 (00) 70653-8.
- ^ а б Такасе, Кахеи; Тойонобу Асао; Ёсиказу Такаги; Тэцуо Нозоэ (1968). «Синтезы и некоторые свойства 2- и 6-гидроксиазуленов». Химические коммуникации (7): 368b – 370. Дои:10.1039 / C1968000368B.
- ^ Ямамура, Кимиаки; Кавабата, Сидзука; Кимура, Такатомо; Эда, Кадзуо; Хасимото, Масао (2005). "Новый синтез бензалацетоновых аналогов нафта [а] азулены с помощью реакции раскрытия фуранового цикла, опосредованной внутримолекулярными ионами тропилия, и рентгеновского исследования нафта [1,2-а] производное азулена ». Журнал органической химии. 70 (22): 8902–6. Дои:10.1021 / jo051409f. PMID 16238325.