Кубан - Cubane
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Кубан[1] | |||
| Систематическое название ИЮПАК Пентацикло [4.2.0.02,5.03,8.04,7] октан | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C8ЧАС8 | |||
| Молярная масса | 104,15 г / моль | ||
| Плотность | 1,29 г / см3 | ||
| Температура плавления | 133,5 ° С (272,3 ° F, 406,6 К)[2] | ||
| Точка кипения | 161,6 ° С (322,9 ° F, 434,8 К)[2] | ||
| Родственные соединения | |||
Связанный углеводороды | Cuneane Додекаэдран Тетраэдран Присмане Присмане C8 | ||
Родственные соединения | Гептанитрокубан Октанитрокубан Октаазакубан | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Кубан (C8ЧАС8) является синтетическим углеводород молекула который состоит из восьми углерод атомы расположены по углам куб, с одним водород атом, присоединенный к каждому атому углерода. Твердый кристаллический вещество, кубан является одним из Платоновые углеводороды и член присманес. Впервые он был синтезирован в 1964 г. Филип Итон и Томас Коул.[3] До этой работы исследователи полагали, что кубические молекулы на основе углерода будут слишком нестабильными, чтобы существовать. Кубическая форма требует, чтобы атомы углерода имели необычно острый угол соединения 90 °, что было бы очень напряженный по сравнению с углом 109,45 ° четырехгранный углерод. После образования кубан довольно кинетически стабильный, из-за отсутствия доступных путей декомпозиции. Это простейший углеводород с октаэдрическая симметрия.
Обладая высокой потенциальной энергией, но кинетической стабильностью, кубан и его производные соединения могут использоваться для контролируемого накопления энергии. Например, октанитрокубан и гептанитрокубан были изучены как высокоэффективные взрывчатые вещества.
Эти соединения также обычно имеют очень высокий плотность для молекул углеводородов. В результате высокий плотность энергии означает, что большое количество энергии может быть сохранено в сравнительно небольшом пространстве, что является важным соображением для приложений в области хранения топлива и транспортировки энергии.
Синтез
Классический синтез 1964 года начинается с преобразования 2-циклопентенон до 2-бромациклопентадиенон:[3][4]
Аллильный бромирование с N-бромосукцинимид в четыреххлористый углерод с последующим добавлением молекулярного брома к алкен дает 2,3,4-трибромциклопентанон. Обработка этого соединения диэтиламин в диэтиловый эфир причины устранение двух эквивалентов бромистый водород чтобы получить диеновый продукт.
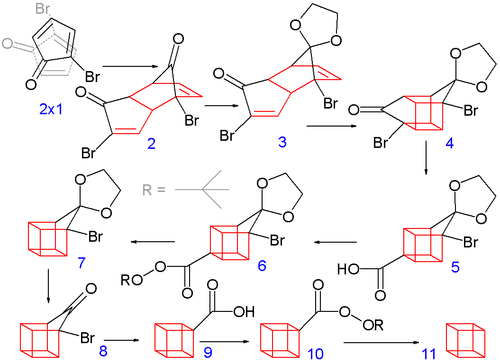 Синтез кубана Eaton 1964 г.
Синтез кубана Eaton 1964 г.
Построение восьмиуглеродного кубанового каркаса начинается, когда 2-бромциклопентадиенон подвергается самопроизвольной Димеризация Дильса-Альдера, аналогично димеризации циклопентадиен к дициклопентадиен - две молекулы 1 реагировать на форму 2. Чтобы последующие шаги были успешными, только эндо изомер является полезным, и это преобладающий изомер, образующийся в этой реакции. Это наиболее вероятный продукт в результате минимизации стерический взаимодействия между бромом каждой молекулы с бромом и карбонил другого, когда реагенты приближаются друг к другу и минимизируют подобные дипольные взаимодействия в переходное состояние самой реакции. Обе карбонильные группы защищенный в качестве ацетали с этиленгликоль и п-толуолсульфоновая кислота в бензол; затем с одного ацеталя селективно снимается защита водным соляная кислота к 3.
На следующем этапе эндо изомер 3 (с обоими алкен группы в непосредственной близости) образует каркасный изомер 4 в фотохимический [2+2] циклоприсоединение. В бромкетон группа преобразуется в кольцевую карбоновая кислота 5 в Перестановка Фаворского с гидроксид калия. Далее тепловая декарбоксилирование происходит через хлорангидрид (с тионилхлорид ) и терт-бутил Перестер 6 (с терт-бутилгидропероксид и пиридин ) к 7; после этого ацеталь еще раз удаляют в 8. Вторая перестановка Фаворского дает 9, и, наконец, другое декарбоксилирование дает через 10, кубан (11).
Производные
Синтез октафенила производная из тетрафенилциклобутадиен бромида никеля, созданного Фридманом в 1962 году, предшествует таковому для исходного соединения. Это труднорастворимое бесцветное соединение, плавящееся при 425–427 ° C.[2][5][6][7] А гиперкубан, с гиперкуб -подобная структура, как было предсказано в публикации 2014 года.[8][9] Два разных изомера Cubene были синтезированы, а треть проанализирована вычислительно. Алкен в орто-кубен исключительно реактивен из-за его пирамидальная геометрия. На момент синтеза это был алкен с наиболее пирамидальной структурой, который удалось получить.[10] В мета-кубен изомер еще менее стабилен, и параграф-кубен изомер, вероятно, существует только как бирадикал а не диагональная связь.[11]
Кубилкубаны и олигокубаны
Кубан (1,2-дегидрокубан) и 1,4-кубандиил (1,4-дегидрокубан) представляют собой чрезвычайно напряженные соединения, которые оба очень быстро подвергаются нуклеофильному присоединению, и это позволило химикам синтезировать кубилкубан. Решение структуры дифракции рентгеновских лучей показало, что центральная кубилкубановая связь чрезвычайно коротка (1,458 Ангстрем), что намного короче, чем типичная одинарная связь C-C (1,578 Ангстрем). Это связано с тем, что экзоциклические орбитали кубана s-богаты и близки к ядру.[12] Химики из Чикагского университета расширили и модифицировали последовательность таким образом, что это позволяет получить множество олигомеров [n] кубилкубана.[13] [N] кубилкубаны представляют собой жесткие молекулярные стержни, которые особенно перспективны во время создания жидких кристаллов с исключительной УФ-прозрачностью. По мере увеличения количества связанных кубановых единиц растворимость [n] кубилкубана резко падает; в результате в растворах были успешно синтезированы только цепи ограниченной длины (до 40 звеньев). Каркас [n] кубилкубанов по-прежнему состоит из чрезвычайно напряженных углеродных кубов, что ограничивает его стабильность. Напротив, исследователи из Университета Пенсильвании показали, что поликубан, синтезированный твердотельной реакцией, состоит на 100% из sp3-углерода, связанного с тетраэдрическим углом (109,5 градуса), и демонстрирует исключительные оптические свойства (высокий показатель преломления). [14]
Реакции
Cuneane может быть произведен из кубана катализируемая ионами металлов перегруппировка σ-связи.[15][16]
Смотрите также
Рекомендации
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 169. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
Сохраненные названия адамантан и кубан используются в общей номенклатуре и в качестве предпочтительных названий IUPAC.
- ^ а б c Бегасевич, Кайл; Гриффитс, Джастин; Сэвидж, Г. Пол; Цанакстидис, Джон; Прифер, Ронни (2015). «Кубана: 50 лет спустя». Химические обзоры. 115 (14): 6719–6745. Дои:10.1021 / cr500523x. PMID 26102302.
- ^ а б Eaton, Philip E .; Коул, Томас В. (1964). «Кубана». Варенье. Chem. Soc. 86 (15): 3157–3158. Дои:10.1021 / ja01069a041.
- ^ Eaton, Philip E .; Коул, Томас В. (1964). «Кубанская система». Варенье. Chem. Soc. 86 (5): 962–964. Дои:10.1021 / ja01059a072.
- ^ Фридман, Х. Х. (1961). "Производные тетрафенилциклобутадиена. II.1 Химические доказательства триплетного состояния". Варенье. Chem. Soc. 83 (9): 2195–2196. Дои:10.1021 / ja01470a037.
- ^ Freedman, H.H .; Петерсен, Д. Р. (1962). «Производные тетрафенилциклобутадиена. IV.1.« Октафенилкубан »; димер тетрафенилциклобутадиена». Варенье. Chem. Soc. 84 (14): 2837–2838. Дои:10.1021 / ja00873a046.
- ^ Pawley, G.S .; Lipscomb, W. N .; Фридман, Х. Х. (1964). «Строение димера тетрафенилциклобутадиена». Варенье. Chem. Soc. 86 (21): 4725–4726. Дои:10.1021 / ja01075a042.
- ^ Пичьерри, Ф. (2014). "Гиперкубан: предсказание на основе DFT Очас-симметричный двухоболочечный углеводород ». Chem. Phys. Латыш. 612: 198–202. Bibcode:2014CPL ... 612..198P. Дои:10.1016 / j.cplett.2014.08.032.
- ^ «Гиперкубан: предсказание на основе DFT О-симметричного углеводорода с двойной оболочкой».
- ^ Eaton, Philip E .; Маггини, Микеле (1988). «Кубен (1,2-дегидрокубан)». Варенье. Chem. Soc. 110 (21): 7230–7232. Дои:10.1021 / ja00229a057.
- ^ Миняев, Руслан М .; Минкин Владимир И .; Грибанова, Татьяна Н. (2009). «2.3 Теоретический подход к изучению и проектированию систем Присмана». В Додзюке, Елена (ред.). Деформированные углеводороды. Вайли. п.55. ISBN 9783527627141.
- ^ Джиларди, Ричард .; Маггини, Микеле .; Итон, Филип Э. (1 октября 1988 г.). «Рентгеновские структуры кубилкубана и 2-трет-бутилкубилкубана: короткие связи клетка-клетка». Журнал Американского химического общества. 110 (21): 7232–7234. Дои:10.1021 / ja00229a058. ISSN 0002-7863.
- ^ Итон, Филип Э. (1992). «Кубинцы: исходные материалы для химии 1990-х и нового века». Angewandte Chemie International Edition на английском языке. 31 (11): 1421–1436. Дои:10.1002 / anie.199214211. ISSN 1521-3773.
- ^ Хуанг, Хау-Тынг; Чжу, Ли; Уорд, Мэтью Д.; Ван, Дао; Чен, Бо; Chaloux, Brian L .; Ван, Цяньцянь; Бисвас, Арани; Грей, Дженнифер Л .; Куэй, Брук; Коди, Джордж Д .; Эпштейн, Альберт; Креспи, Винсент Х .; Баддинг, Джон В .; Штробель, Тимоти А. (21 января 2020 г.). «Наноархитектура через напряженные молекулы: каркасы на основе кубана и мельчайшие углеродные нанонити». Журнал Американского химического общества. Дои:10.1021 / jacs.9b12352. ISSN 0002-7863. PMID 31961671.
- ^ Смит, Майкл Б .; Март, Джерри (2001). Мартовская продвинутая органическая химия (5-е изд.). Джон Вили и сыновья. п.1459. ISBN 0-471-58589-0.
- ^ Киндлер, К .; Люрс, К. (1966). "Studien über den Mechanismus chemischer Reaktionen, XXIII. Hydrierungen von Nitrilen unter Verwendung von Terpenen als Wasserstoffdonatoren". Chem. Бер. 99: 227–232. Дои:10.1002 / cber.19660990135.