Зукапсаицин - Zucapsaicin
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Civanex |
| Другие имена | Цивамид; (Z) -Капсаицин; СНГ-Капсаицин |
| Маршруты администрация | Актуальные |
| Код УВД | |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| ECHA InfoCard | 100.164.527 |
| Химические и физические данные | |
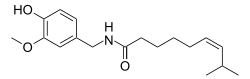
| Формула | C18ЧАС27NО3 |
| Молярная масса | 305.418 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
Зукапсаицин (Civanex) это медикамент используется для лечения остеоартроз колена и другие невропатическая боль. Применяется трижды в день в течение максимум трех месяцев. Зукапсаицин входит в состав фенолов и метоксибензолов.[1] Это модулятор транзиторного рецепторного потенциала катионного канала V члена 1 подсемейства (TRPV-1), также известного как рецептор 1 ваниллоида или капсаицина, который уменьшает боль и улучшает суставные функции.[2][3] Это СНГ-изомер из капсаицин. Цивамид, производимый Winston Pharmaceuticals, выпускается в виде препаратов для перорального, назального и местного применения (пластырь и крем).[4][5]
Цукапсаицин был протестирован для лечения различных состояний, связанных с постоянной нервной болью. Это включает в себя простой герпес инфекции; кластерные головные боли и мигрень; и колено остеоартроз.[6] Он был одобрен Министерством здравоохранения Канады в 2010 году как крем для местного применения, продаваемый под торговой маркой Zuacta, но в настоящее время не одобренный FDA.[2] Он имеет температуру плавления 71,5–74,5.[2]
Фармакология
Зукапсаицин опосредует антиноцицептивное действие, действуя как агонист TRPV1. TRPV1 играет важную физиологическую роль в передаче химических, механических и тепловых стимулов, а также в передаче боли и участвует в модуляции и восприятии боли. Они в основном распределены в сенсорных нервных волокнах C, а также в волокнах Aẟ для передачи сенсорной информации, включающей воспалительную и невропатическую боль, и активация этих каналов высвобождает матостатин, пептид, связанный с геном кальцитонина (CGRP) и другие нейропептиды (нейрокинин A, кассинин), ведущие к нейрогенному воспалению [A19720]. Сообщается также, что цукапсаицин влияет на пептидергические афферентные нейроны посредством механизма десенсибилизации, снижая уровни ганглиев задних корешков и пептида, связанного с геном седалищного кальцитонина (CGRP), и вещества P (SP) [L877].[2]
Фармакодинамика
Зукапсаицин опосредует антиноцицептивное действие, действуя как агонист TRPV1. TRPV1 играет важную физиологическую роль в передаче химических, механических и тепловых стимулов, а также в передаче боли и участвует в модуляции и восприятии боли. Они в основном распределены в сенсорных нервных волокнах C, а также в волокнах Aẟ для передачи сенсорной информации, включающей воспалительную и невропатическую боль, и активация этих каналов высвобождает матостатин, пептид, связанный с геном кальцитонина (CGRP) и другие нейропептиды (нейрокинин A, кассинин), к нейрогенному воспалению.[5] Сообщается также, что цукапсаицин влияет на пептидергические афферентные нейроны посредством механизма десенсибилизации, снижая уровни ганглиев задних корешков и пептида, связанного с геном седалищного кальцитонина (CGRP), и вещества P (SP).[2]
Механизм действия
Цукапсаицин возбуждает и десенсибилизирует С-волокна через агонист TRPV1 на ноцицептивных нейронах. Он связывается с внутриклеточными участками и сначала стимулирует каналы, вызывая ощущение жжения.[3] Механизм фармакологического действия цукапсаицина еще полностью не изучен. Предполагается, что это соединение, как и его транс-изомер, является агонистом ваниллоидного рецептора VR1 (TRPV1) и блокатором нейронных кальциевых каналов.[7][8] Капсаицин способен возбуждать и снижать чувствительность С-волокон. Таким образом, он не только причиняет боль, но и обладает обезболивающими свойствами. Первоначально он стимулирует TRPV1, который отвечает за ощущение жжения. За этим эффектом следует длительное рефрактерное состояние - «десенсибилизация», во время которого ранее возбужденные сенсорные нейроны перестают реагировать на капсаицин и другие раздражители. Было показано, что десенсибилизация и тахифилаксия каналов TRPV1 способствуют уменьшению боли, вызванной капсаицином.[9] Десенсибилизация TRPV1 представляет собой основной механизм его ингибирующей функции.
Были описаны три различных пути индуцированной капсаицином десенсибилизации: i) активация кальциневрина, которая приводит к дефосфорилированию TRPV1; б) активация фосфолипазы С с последующими фосфатидилинозитолами 4,5-бисфосфат гидролизом (а) и спорным III) активацией кальцием-зависимый изоформа протеинкиназы C и последующего фосфорилирование канала.[10][11] Десенсибилизация включает как тахифилаксию (краткосрочную десенсибилизацию), так и долгосрочную стойкую десенсибилизацию.[12][13][14] Предполагается, что понижающая регуляция прогальгетических веществ (таких как SP) и повышенная регуляция анальгетических пептидов участвуют в десенсибилизации.[15] Истощение запасов SP делает нейроны десенсибилизированными и невосприимчивыми. Эти механизмы десенсибилизации до конца не изучены. Считается, что кратковременная десенсибилизация связана со способностью капсаицина блокировать внутриаксональный транспорт NGF, SP и соматостатина.[16]
Десенсибилизация - явление обратимое. Он начинается через несколько часов после применения капсаицина и может длиться даже несколько недель.[15] Обратимая десенсибилизация оказалась полезной при лечении боли, тогда как сайт-специфическая абляция сенсорных нервов, передающих болевые стимулы, является многообещающим подходом («молекулярный скальпель») для достижения постоянного обезболивания у пациентов, страдающих от боли при раке костей или ВИЧ-инфекции. индуцированные невропатии.[12][13] Десенсибилизация и истощение пронцицептивных нейротрансмиттеров вызывают химическую денервацию с потерей функции, что в клинической практике используется при остеоартрите, диабетической нейропатии, псориазе и других.[17][18][19] В ганглиях задних корешков и седалищном нерве цукапсаицин снижает уровни SP и CGRP, что указывает на то, что он влияет на пептидергические афферентные нейроны посредством механизма десенсибилизации.[20][41]. При местном применении целевыми мишенями для цукапсаицина являются нейроны, которые иннервируют локальную область применения. Эти нейроны передают боль в ЦНС.
Фармакокинетика
Абсорбция
Зукапсаицин обладает низкой системной абсорбцией и локализуется в области нанесения. В исследованиях на животных системная абсорбция составляет 0,075%.[21][22][23]
Метаболизм
В пробирке исследования демонстрируют слабое или умеренное ингибирующее действие на различные ферменты цитохрома P450, хотя и не клинически значимое из-за низкой системной абсорбции.[22]
Путь устранения
В исследованиях на крысах цукапсаицин и его метаболиты медленно выводятся с мочой и калом (до 2/3) с минимальным выводом через выдох после кожного введения.[21][22]
Период полураспада
У крыс период полувыведения цукапсаицина и его метаболитов составляет примерно от 7 до 11 часов.[21][22]
Токсичность
Наиболее частые побочные эффекты связаны с реакциями на месте нанесения, такими как временное жжение и ощущение тепла. Другие побочные эффекты, наблюдаемые в клинических испытаниях, включают раздражение глаз, артралгию, обострение остеоартрита, чувство жжения, головную боль, кашель и чихание. Оральная LD50 у мышей составляет> 87,5 мг / кг у самцов и <60 мг / кг у самок. Оральная LD50 у крыс составляет> 90 мг / кг у самцов и> 60 мг / кг у самок.[21]
Химические и физические свойства
Расчетные свойства
| Имя свойства | Стоимость имущества[24] |
|---|---|
| Молекулярный вес | 305,418 г / моль |
| XLogP3-AA | 3.6 |
| Количество доноров водородной связи | 2 |
| Количество акцепторов водородной связи | 3 |
| Вращающийся счетчик облигаций | 9 |
| Точная масса | 305,199 г / моль |
| Моноизотопная масса | 305,199 г / моль |
| Топологическая площадь полярной поверхности | 58,6 А ^ 2 |
| Счетчик тяжелых атомов | 22 |
| Формальное обвинение | 0 |
| Сложность | 341 |
| Количество атомов изотопа | 0 |
| Определенное количество стереоцентров атома | 0 |
| Неопределенное количество стереоцентров атома | 0 |
| Определенное количество стереоцентров связи | 1 |
| Неопределенное количество стереоцентров связи | 0 |
| Количество ковалентно-связанных единиц | 1 |
| Соединение канонизировано | да |
Рекомендации
- ^ «цукапсаицин (CHEBI: 135952)». Химические объекты, представляющие биологический интерес (ChEBI). EMBL-EBI. Получено 2019-06-25.
- ^ а б c d е «Зукапсаицин». DrugBank. Получено 2019-06-25.
- ^ а б Studer M, McNaughton PA (октябрь 2010 г.). «Модуляция одноканальных свойств TRPV1 путем фосфорилирования». Журнал физиологии. 588 (Pt 19): 3743–56. Дои:10.1113 / jphysiol.2010.190611. ЧВК 2998224. PMID 20693293.
- ^ «Цивамид». Winston Pharmaceuticals. Архивировано из оригинал 25 апреля 2012 г.. Получено 16 ноября, 2011.
- ^ а б Салат К., Якубовская А., Кулиг К. (октябрь 2014 г.). «Зукапсаицин для лечения невропатической боли». Заключение эксперта по исследуемым препаратам. 23 (10): 1433–40. Дои:10.1517/13543784.2014.956079. PMID 25171227.
- ^ Информация о Zucapsaicin из Национальной медицинской библиотеки http://druginfo.nlm.nih.gov/drugportal
- ^ Беван С.Дж., Дочерти Р.Дж. (1993). «Клеточные механизмы действия капсаицина». В Вуд Дж (ред.). Капсаицин при исследовании боли. Лондон, Англия: Academic Press. С. 27–44.
- ^ Ананд П., Блей К. (октябрь 2011 г.). «Местный капсаицин для снятия боли: терапевтический потенциал и механизмы действия нового 8% пластыря с высокой концентрацией капсаицина». Британский журнал анестезии. 107 (4): 490–502. Дои:10.1093 / bja / aer260. ЧВК 3169333. PMID 21852280.
- ^ Сен-Пьер М., Ри П. У., Циммерманн К. (июнь 2009 г.). «Дифференциальные эффекты блока TRPV каналов на полимодальную активацию ноцицепторов кожи крыс in vitro». Экспериментальное исследование мозга. 196 (1): 31–44. Дои:10.1007 / s00221-009-1808-3. PMID 19404626.
- ^ Стаки С.Л., Дубин А.Е., Джеске Н.А. и др. Роль временных каналов рецепторного потенциала при боли. Brain Res Rev 2009; 60 (1): 2-23
- ^ Нилиус Б, Овсяник Г (2013). "Переходное семейство рецепторов ионных каналов". Энциклопедия боли. Геномная биология. 12. Springer Berlin Heidelberg. п. 4037. Дои:10.1007/978-3-642-28753-4_202324. ISBN 9783642287527. ЧВК 3129667. PMID 21401968.
- ^ а б Szallasi A, Sheta M (сентябрь 2012 г.). «Ориентация на TRPV1 для обезболивания: пределы, неудачники и лавры». Заключение эксперта по исследуемым препаратам. 21 (9): 1351–69. Дои:10.1517/13543784.2012.704021. PMID 22780443.
- ^ а б Тревизани М (26.07.2010). «Ориентация на TRPV1: вызовы и проблемы в управлении болью ~! 2009-12-02 ~! 2010-03-08 ~! 2010-07-26 ~!». Журнал Open Drug Discovery. 2 (3): 37–49. Дои:10.2174/1877381801002030037. ISSN 1877-3818.
- ^ Хайраткар-Джоши Н., Салласи А. (январь 2009 г.). «Антагонисты TRPV1: проблемы для терапевтического нацеливания». Тенденции в молекулярной медицине. 15 (1): 14–22. Дои:10.1016 / j.molmed.2008.11.004. PMID 19097938.
- ^ а б Brederson JD, Kym PR, Szallasi A. Нацеливание каналов TRP для облегчения боли. Eur J Pharmacol 2013; 716: 61-76
- ^ Папойу А.Д., Йосипович Г. (июнь 2010 г.). «Актуальный капсаицин. Вспыхивает огонь« горячего »лекарства». Мнение эксперта по фармакотерапии. 11 (8): 1359–71. Дои:10.1517/14656566.2010.481670. PMID 20446852.
- ^ Palazzo E, Luongo L, de Novellis V, Berrino L, Rossi F, Maione S (октябрь 2010 г.). «Переход к супраспинальным рецепторам TRPV1 для облегчения хронической боли». Молекулярная боль. 6: 1744-8069–6-66. Дои:10.1186/1744-8069-6-66. ЧВК 2959024. PMID 20937102.
- ^ Ламберт Д.Г. (февраль 2009 г.). «Антагонисты рецепторов капсаицина: новое многообещающее дополнение к клинике боли». Британский журнал анестезии. 102 (2): 153–5. Дои:10.1093 / bja / aen354. PMID 19151045.
- ^ Ламберт Г.А., Дэвис Дж. Б., Эпплби Дж. М., Чиж Б. А., Хоскин К. Л., Загами А. С. (октябрь 2009 г.). «Эффекты антагониста рецептора TRPV1 SB-705498 на сенсибилизацию сосудов тригемина и нейротрансмиссию». Архив фармакологии Наунин-Шмидеберг. 380 (4): 311–25. Дои:10.1007 / s00210-009-0437-5. PMID 19690836.
- ^ Хольцер П. (март 1988 г.). «Местные эффекторные функции чувствительных к капсаицину сенсорных нервных окончаний: участие тахикининов, пептидов, связанных с геном кальцитонина, и других нейропептидов». Неврология. 24 (3): 739–68. Дои:10.1016/0306-4522(88)90064-4. PMID 3288903.
- ^ а б c d «Монография продукта ZUACTA (крем с цукапсаицином)» (PDF). Санофи Канада.
- ^ а б c d WO 2011100668, Бернштейн Дж. Э. «Способ и состав цивамида для лечения заболеваний кишечника», опубликовано в 2011 г.
- ^ Schnitzer TJ, Pelletier JP, Haselwood DM, Ellison WT, Ervin JE, Gordon RD и др. (Март 2012 г.). «Крем цивамид 0,075% у пациентов с остеоартрозом коленного сустава: 12-недельное рандомизированное контролируемое клиническое испытание с долгосрочным продлением». Журнал ревматологии. 39 (3): 610–20. Дои:10.3899 / jrheum.110192. PMID 22089461.
- ^ «Зукапсаицин. Вычисленные свойства». PubChem. Национальная медицинская библиотека США. Получено 23 августа, 2019.
