Глиальный фибриллярный кислый белок - Glial fibrillary acidic protein
Глиальный фибриллярный кислый белок (GFAP) это белок который закодирован GFAP ген в людях.[5] Это промежуточная нить типа III (IF) белок, который экспрессируется многими типами клеток Центральная нервная система (ЦНС), в том числе астроциты[6] и эпендимные клетки во время разработки.[7] Также было обнаружено, что GFAP выражается в клубочки и перитубулярный фибробласты взяты из почек крысы,[8] Клетки Лейдига яичек обоих хомяков[9] и люди,[10] человек кератиноциты,[11] человек остеоциты и хондроциты[12] и звездчатые клетки поджелудочная железа и печень у крыс.[13]
GFAP тесно связан с тремя другими не-эпителиальный члены семьи IF типа III, виментин, десмин и периферин, которые все участвуют в структуре и функциях клетки цитоскелет. Считается, что GFAP помогает поддерживать астроцит механическая сила[14] а также форма клеток, но его точная функция остается малоизученной, несмотря на количество исследований, в которых он используется в качестве маркер ячейки. Белок был назван и впервые выделен и охарактеризован Лоуренсом Ф. Энгом в 1969 году.[15] У человека он расположен на длинной руке хромосома 17.[16]
Структура
Промежуточные филаменты типа III содержат три домена, названные доменами головы, стержня и хвоста. Конкретные ДНК последовательность стержневого домена может различаться между разными промежуточными филаментами III типа, но структура белок хорошо сохраняется. Этот стержневой домен наматывается вокруг другой нити, образуя димер, с N-концевой и C-терминал каждой нити накала. Нити типа III, такие как GFAP, способны образовывать как гомодимеры и гетеродимеры; GFAP может полимеризовать с другими белками III типа.[17] GFAP и другие белки ПФ типа III не могут собираться с кератины, тип I и II промежуточные нити: в клетках, которые экспрессируют оба белка, образуются две отдельные сети промежуточных филаментов,[18] что может позволить специализацию и повышенную вариативность.
Чтобы сформировать сети, исходные димеры GFAP объединяются, чтобы тетрамеры,[19] которые являются основными подразделениями промежуточная нить. Поскольку только стержневые домены in vitro не образуют филаментов, неспиральные домены головки и хвоста необходимы для образования филаментов.[17] Области головы и хвоста имеют большую вариабельность последовательности и структуры. Несмотря на эту повышенную вариабельность, головка GFAP содержит два консервативных аргинины и ароматный остатки, которые, как было показано, необходимы для правильной сборки.[20]
Функция в центральной нервной системе
GFAP выражается в Центральная нервная система в клетках астроцитов.[6][21] Он участвует во многих важных процессах ЦНС, включая клеточную коммуникацию и функционирование гематоэнцефалический барьер.
Было показано, что GFAP играет роль в митоз регулируя сетку волокон, присутствующую в ячейке. Во время митоза происходит увеличение количества фосфорилированного GFAP и перемещение этого модифицированного белка к борозде дробления.[22] Действуют разные наборы киназ; cdc2 киназа действует только в Фаза G2 переход, в то время как другие GFAP киназы активны на борозда декольте один. Эта специфичность расположения позволяет точно регулировать распределение GFAP в дочерних клетках. Исследования также показали, что GFAP нокаутные мыши претерпевают множественные дегенеративные процессы, в том числе патологические миелинизация, ухудшение структуры белого вещества и функциональное / структурное нарушение гематоэнцефалический барьер.[23] Эти данные предполагают, что GFAP необходим для выполнения многих критических ролей в ЦНС.
GFAP предлагается сыграть роль в астроцит -нейрон взаимодействия, а также сотовая связь. В пробирке, с помощью антисмысловая РНК, астроциты, лишенные GFAP, не образуют отростков, обычно присутствующих с нейронами.[24] Исследования также показали, что Клетки Пуркинье у мышей с нокаутом GFAP не обнаруживают нормальной структуры, и эти мыши демонстрируют дефицит в экспериментах по кондиционированию, таких как задача моргания глаз.[25] Биохимические исследования GFAP показали MgCl2 и / или кальций /кальмодулин зависимый фосфорилирование при различных сериновых или треонин остатки по PKC и PKA[26] которые два киназы что важно для цитоплазматический передача сигналов. Эти данные подчеркивают важность GFAP для связи между ячейками.
Также было показано, что GFAP играет важную роль в восстановлении после повреждения ЦНС. В частности, за его роль в формировании глиальные рубцы во множестве мест по всей ЦНС, включая глаз[27] и мозг.[28]
Аутоиммунная астроцитопатия с GFAP
В 2016 году воспалительное заболевание ЦНС, связанное с анти-GFAP. антитела был описан. Пациенты с аутоиммунная астроцитопатия GFAP развился менингоэнцефаломиелит с воспалением мозговые оболочки, мозг паренхима, а спинной мозг. Около трети случаев были связаны с различными раки и многие также выразили другие ЦНС аутоантитела.
Менингоэнцефалит является преобладающим клиническим проявлением аутоиммунной астроцитопатии GFAP в опубликованных сериях случаев.[29] Он также может ассоциироваться с энцефаломиелит и паркинсонизм.[30]
Состояния болезни

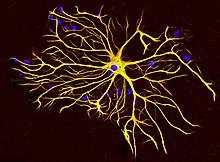
Существует множество нарушений, связанных с неправильной регуляцией GFAP, и травмы могут вызвать глиальные клетки реагировать пагубно. Глиальный рубец является следствием нескольких нейродегенеративный состояния, а также травмы, разрывающие нервный материал. Шрам образован астроциты взаимодействуя с фиброзная ткань для восстановления глиальных границ вокруг центральной травмы[31] и частично вызвано регулирование GFAP.[32]
Еще одно условие, напрямую связанное с GFAP: Болезнь Александра, редкое генетическое заболевание. Его симптомы включают умственную и физическую отсталость, слабоумие, увеличение мозга и головы, спастичность (жесткость рук и / или ног), и припадки.[33] Клеточный механизм заболевания - наличие цитоплазматический скопления, содержащие GFAP и белки теплового шока, известный как Волокна Розенталя.[34] Было показано, что мутации в кодирующей области GFAP вносят вклад в накопление волокон Розенталя.[35] Было высказано предположение, что некоторые из этих мутаций вредны для цитоскелет формирование, а также увеличение каспаза 3 Мероприятия,[36] что приведет к увеличению апоптоз клеток с этими мутациями. Таким образом, GFAP играет важную роль в патогенезе болезни Александра.
Примечательно, что выражение некоторых GFAP изоформы сообщалось об уменьшении в ответ на острый инфекция или нейродегенерация.[37]Кроме того, снижение экспрессии GFAP также было зарегистрировано в Энцефалопатия Вернике.[38] В ВИЧ-1 вирусный конверт гликопротеин gp120 может напрямую подавлять фосфорилирование уровней GFAP и GFAP могут быть уменьшены в ответ на хронический заражение ВИЧ-1,[39] ветряная оспа,[40] и псевдобешенство.[41] Сообщалось о снижении экспрессии GFAP в Синдром Дауна, шизофрения, биполярное расстройство и депрессия.[37]
В исследовании с участием 22 пациентов-детей, перенесших экстракорпоральную мембранную оксигенацию (ЭКМО ), дети с аномально высоким уровнем GFAP в 13 раз чаще умирают и в 11 раз чаще страдают черепно-мозговой травмой, чем дети с нормальным уровнем GFAP.[42] Уровни GFAP уже используются в качестве маркера неврологического повреждения у взрослых, страдающих удары и черепно-мозговые травмы.[42]
Взаимодействия
Было показано, что глиальный фибриллярный кислый белок взаимодействовать с MEN1[43] и PSEN1.[44]
Изоформы
Хотя GFAP альфа является единственной изоформой, которая способна гомомерно собираться, GFAP имеет 8 различных изоформы которые маркируют отдельные субпопуляции астроциты в мозге человека и грызунов. Эти изоформы включают GFAP каппа, GFAP +1 и наиболее изученную в настоящее время дельту GFAP. Дельта GFAP, похоже, связана с нервные стволовые клетки (НСК) и могут участвовать в миграции. GFAP + 1 - это антитело, которое метит две изоформы. Хотя GFAP + 1 положительные астроциты предположительно не являются реактивными астроцитами, они имеют широкий спектр морфологии включая отростки размером до 0,95 мм (наблюдаемые в человеческом мозге). Экспрессия GFAP + 1 положительных астроцитов связана со старостью и началом ОБЪЯВЛЕНИЕ патология.[45]
Смотрите также
- Синдром микроделеции 17q21.31 (Синдром Кулена – де Фриза)
- Пятно GFAP
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000131095 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000020932 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Isaacs A, Baker M, Wavrant-De Vrièze F, Hutton M (июль 1998 г.). «Определение структуры гена GFAP человека и отсутствие мутаций кодирующей области, связанных с лобно-височной деменцией с паркинсонизмом, связанным с хромосомой 17». Геномика. 51 (1): 152–4. Дои:10.1006 / geno.1998.5360. PMID 9693047.
- ^ а б Жак С.М., Виннер С., Куджас М., Рауль М., Ракадот Дж., Бауман Н.А. (январь 1978 г.). «Определение глиального фибриллярного кислого белка (GFAP) в опухолях головного мозга человека». Журнал неврологических наук. 35 (1): 147–55. Дои:10.1016 / 0022-510x (78) 90107-7. PMID 624958. S2CID 10224197.
- ^ Рессманн У., Веласко М.Э., Синдели С.Д., Гамбетти П. (октябрь 1980 г.). «Глиальный фибриллярный кислый белок (GFAP) в эпендимных клетках во время развития. Иммуноцитохимическое исследование». Исследование мозга. 200 (1): 13–21. Дои:10.1016/0006-8993(80)91090-2. PMID 6998542. S2CID 38131934.
- ^ Буниатян Г., Трауб П., Альбинус М., Бекерс Г., Бухманн А., Гебхардт Р., Оссвальд Г. (январь 1998 г.). «Иммунореактивность глиального фибриллярного кислого белка в мезангиальных клетках и подоцитах клубочков почки крысы in vivo и в культуре». Биология клетки. 90 (1): 53–61. Дои:10.1016 / s0248-4900 (98) 80232-3. PMID 9691426. S2CID 31851422.
- ^ Маунори Р., Портье М.М., Леонар Н., Маккормик Д. (декабрь 1991 г.). «Иммунореактивность глиального фибриллярного кислого белка в адренокортикальных клетках и клетках Лейдига сирийского золотого хомяка (Mesocricetus auratus)». Журнал нейроиммунологии. 35 (1–3): 119–29. Дои:10.1016/0165-5728(91)90167-6. PMID 1720132. S2CID 3766335.
- ^ Davidoff MS, Middendorff R, Köfüncü E, Müller D, Jezek D, Holstein AF (2002). «Клетки Лейдига яичка человека обладают астроцитами и молекулами-маркерами олигодендроцитов». Acta Histochemica. 104 (1): 39–49. Дои:10.1078/0065-1281-00630. PMID 11993850.
- ^ фон Коскулл H (1984). «Быстрая идентификация глиальных клеток в околоплодных водах человека с непрямой иммунофлуоресценцией». Acta Cytologica. 28 (4): 393–400. PMID 6205529.
- ^ Kasantikul V, Shuangshoti S (май 1989 г.). «Положительная реакция на глиальный фибриллярный кислый белок в костях, хрящах и хордомах». Журнал хирургической онкологии. 41 (1): 22–6. Дои:10.1002 / jso.2930410109. PMID 2654484. S2CID 34069861.
- ^ Apte MV, Haber PS, Applegate TL, Norton ID, McCaughan GW, Korsten MA и др. (Июль 1998 г.). «Периацинарные звездчатые клетки в поджелудочной железе крысы: идентификация, выделение и культура». Кишечник. 43 (1): 128–33. Дои:10.1136 / гут.43.1.128. ЧВК 1727174. PMID 9771417.
- ^ Каллен Д.К., Саймон С.М., LaPlaca MC (июль 2007 г.). «Зависимая от скорости штамма индукция реактивного астроглиоза и гибели клеток в трехмерных совместных культурах нейронов и астроцитов». Исследование мозга. 1158: 103–15. Дои:10.1016 / j.brainres.2007.04.070. ЧВК 3179863. PMID 17555726.
- ^ Eng LF, Гирникар RS, Ли YL (октябрь 2000 г.). «Глиальный фибриллярный кислый белок: GFAP-тридцать один год (1969-2000)». Нейрохимические исследования. 25 (9–10): 1439–51. Дои:10.1023 / А: 1007677003387. PMID 11059815. S2CID 9221868.
- ^ Bongcam-Rudloff E, Nistér M, Betsholtz C, Wang JL, Stenman G, Huebner K и др. (Март 1991 г.). «Человеческий глиальный фибриллярный кислый белок: комплементарное клонирование ДНК, хромосомная локализация и экспрессия информационной РНК в линиях клеток глиомы человека различных фенотипов». Исследования рака. 51 (5): 1553–60. PMID 1847665.
- ^ а б Ривз С.А., Хельман Л.Дж., Эллисон А., Израиль Массачусетс (июль 1989 г.). «Молекулярное клонирование и первичная структура глиального фибриллярного кислого белка человека». Труды Национальной академии наук Соединенных Штатов Америки. 86 (13): 5178–82. Bibcode:1989PNAS ... 86.5178R. Дои:10.1073 / pnas.86.13.5178. ЧВК 297581. PMID 2740350.
- ^ McCormick MB, Coulombe PA, Fuchs E (июнь 1991 г.). «Сортировка сетей IF: последствия подкачки домена для распознавания и сборки IF». Журнал клеточной биологии. 113 (5): 1111–24. Дои:10.1083 / jcb.113.5.1111. ЧВК 2289006. PMID 1710225.
- ^ Стюарт М., Куинлан Р.А., Мойр Р.Д. (июль 1989 г.). «Молекулярные взаимодействия в паракристаллах фрагмента, соответствующего альфа-спиральной части стержня спиральной спирали глиального фибриллярного кислого белка: свидетельство антипараллельной упаковки молекул и полиморфизма, связанного со структурой промежуточных филаментов». Журнал клеточной биологии. 109 (1): 225–34. Дои:10.1083 / jcb.109.1.225. ЧВК 2115473. PMID 2745549.
- ^ Фукс Э., Вебер К. (1994). «Промежуточные филаменты: структура, динамика, функция и болезнь». Ежегодный обзор биохимии. 63: 345–82. Дои:10.1146 / annurev.bi.63.070194.002021. PMID 7979242.
- ^ Венкатеш К., Срикантх Л., Венгамма Б., Чандрасекхар С., Сандживкумар А., Мулешвара Прасад BC, Сарма П.В. (2013). «Дифференциация in vitro культивируемых человеческих CD34 + клеток в астроциты». Неврология Индия. 61 (4): 383–8. Дои:10.4103/0028-3886.117615. PMID 24005729.
- ^ Тарди М., Фажес С., Ле Принц Дж., Роллан Б., Нуньес Дж. (1990). «Регулирование глиального фибриллярного кислого белка (GFAP) и его кодирующей мРНК в развивающемся мозге и в культивируемых астроцитах». Достижения экспериментальной медицины и биологии. 265: 41–52. Дои:10.1007/978-1-4757-5876-4_4. ISBN 978-1-4757-5878-8. PMID 2165732.
- ^ Лидтке В., Эдельманн В., Биери П.Л., Чиу ФК, Коуэн Н.Дж., Кучерлапати Р., Рейн С.С. (октябрь 1996 г.). «GFAP необходим для целостности архитектуры белого вещества ЦНС и долгосрочного поддержания миелинизации». Нейрон. 17 (4): 607–15. Дои:10.1016 / S0896-6273 (00) 80194-4. PMID 8893019. S2CID 14714870.
- ^ Weinstein DE, Shelanski ML, Liem RK (март 1991 г.). «Подавление антисмысловой мРНК демонстрирует потребность в глиальном фибриллярном кислотном белке для образования стабильных астроцитарных процессов в ответ на нейроны». Журнал клеточной биологии. 112 (6): 1205–13. Дои:10.1083 / jcb.112.6.1205. ЧВК 2288905. PMID 1999469.
- ^ Онлайн-менделевское наследование в человеке (OMIM): Глиальный фибриллярно-кислотный белок, GFAP - 137780
- ^ Харрисон BC, Mobley PL (январь 1992 г.). «Фосфорилирование глиального фибриллярного кислого белка и виментина за счет цитоскелетно-ассоциированной активности протеинкиназы промежуточных филаментов в астроцитах». Журнал нейрохимии. 58 (1): 320–7. Дои:10.1111 / j.1471-4159.1992.tb09313.x. PMID 1727439. S2CID 28248825.
- ^ Туккари Дж., Тромбетта С., Джардинелли М. М., Арена F, Баррези Дж. (1986). «Распределение глиального фибриллярного кислого белка в нормальной и глиотической сетчатке человека». Базовая и прикладная гистохимия. 30 (4): 425–32. PMID 3548695.
- ^ Паэтау А., Эловаара И., Паасивуо Р., Виртанен И., Пало Дж., Халтия М. (1985). «Глиальные нити являются основной фракцией головного мозга при цероид-липофусцинозе нейронов у младенцев». Acta Neuropathologica. 65 (3–4): 190–94. Дои:10.1007 / bf00686997. PMID 4038838. S2CID 1411700.
- ^ Аллен А., Гулхар С., Хайдари Р., Мартинес Дж. П., Бекенштейн Дж., ДеЛоренцо Р. и др. (Январь 2020 г.). «Аутоиммунная глиальная фибриллярная астроцитопатия с кислым белком, приводящая к рефрактерному к лечению вялому параличу». Рассеянный склероз и связанные с ним заболевания. 39: 101924. Дои:10.1016 / j.msard.2019.101924. PMID 31927153.
- ^ Tomczak A, Su E, Tugizova M, Carlson AM, Kipp LB, Feng H, Han MH (декабрь 2019 г.). «Случай GFAP-астроглиального аутоиммунитета с обратимым паркинсонизмом». Рассеянный склероз и связанные с ним заболевания. 39: 101900. Дои:10.1016 / j.msard.2019.101900. PMID 31881522.
- ^ Bunge MB, Bunge RP, Ris H (май 1961). «Ультраструктурное исследование ремиелинизации в экспериментальном поражении спинного мозга взрослой кошки». Журнал биофизической и биохимической цитологии. 10 (1): 67–94. Дои:10.1083 / jcb.10.1.67. ЧВК 2225064. PMID 13688845.
- ^ Смит ME, Eng LF (1987). «Глиальный фибриллярный кислый белок при хроническом рецидивирующем экспериментальном аллергическом энцефаломиелите у мышей SJL / J». Журнал неврологических исследований. 18 (1): 203–8. Дои:10.1002 / jnr.490180129. PMID 3682026. S2CID 25610288.
- ^ HealthLink (25 ноября 2007 г.). «Александровская болезнь». Медицинский колледж Висконсина.
- ^ Хагеманн Т.Л., Коннор Дж. Х, Мессинг А. (октябрь 2006 г.). «Связанные с болезнью Александра мутации глиального фибриллярного кислого белка у мышей вызывают образование волокон Розенталя и стрессовую реакцию белого вещества». Журнал неврологии. 26 (43): 11162–73. Дои:10.1523 / JNEUROSCI.3260-06.2006. ЧВК 6674663. PMID 17065456.
- ^ Бреннер М., Джонсон А.Б., Беспфлуг-Танги О., Родригес Д., Голдман Дж. Э., Мессинг А. (январь 2001 г.). «Мутации в GFAP, кодирующем глиальный фибриллярный кислый белок, связаны с болезнью Александера». Природа Генетика. 27 (1): 117–20. Дои:10.1038/83679. PMID 11138011. S2CID 10159452.
- ^ Чен Ю.С., Лим СК, Чен М.Х., Куинлан Р.А., Пернг Мэриленд (октябрь 2011 г.). «Мутации, вызывающие болезнь Александера в С-концевом домене GFAP, вредны как для сборки, так и для формирования сети с потенциалом как активации каспазы 3, так и снижения жизнеспособности клеток». Экспериментальные исследования клеток. 317 (16): 2252–66. Дои:10.1016 / j.yexcr.2011.06.017. ЧВК 4308095. PMID 21756903.
- ^ а б Johnston-Wilson NL, Sims CD, Hofmann JP, Anderson L, Shore AD, Torrey EF, Yolken RH (март 2000 г.). «Специфические изменения белков лобной коры головного мозга при шизофрении, биполярном расстройстве и большом депрессивном расстройстве. Консорциум невропатологов Стэнли». Молекулярная психиатрия. 5 (2): 142–9. Дои:10.1038 / sj.mp.4000696. PMID 10822341.
- ^ Каллен К.М., Холлидей GM (1994). «Хронические алкоголики имеют существенную глиальную патологию переднего и промежуточного мозга». Алкоголь и алкоголизм. 2: 253–7. PMID 8974344.
- ^ Леви Дж., Патрицио М., Бернардо А., Петруччи Т.К., Агрести С. (февраль 1993 г.). «Белок оболочки вируса иммунодефицита человека gp120 ингибирует бета-адренергическую регуляцию астроглиальных и микроглиальных функций». Труды Национальной академии наук Соединенных Штатов Америки. 90 (4): 1541–5. Bibcode:1993ПНАС ... 90.1541Л. Дои:10.1073 / пнас.90.4.1541. ЧВК 45910. PMID 8381971.
- ^ Кеннеди П.Г., майор Е.О., Уильямс Р.К., Straus SE (декабрь 1994 г.). «Подавление экспрессии глиального фибриллярного кислого белка во время острой литической инфекции вируса ветряной оспы и опоясывающего лишая культивируемых астроцитов человека». Вирусология. 205 (2): 558–62. Дои:10.1006 / viro.1994.1679. PMID 7975257.
- ^ Ринаман Л., Card JP, Enquist LW (февраль 1993 г.). «Пространственно-временные реакции астроцитов, разветвленной микроглии и макрофагов мозга на инфекцию центральных нейронов вирусом псевдобешенства». Журнал неврологии. 13 (2): 685–702. Дои:10.1523 / JNEUROSCI.13-02-00685.1993. ЧВК 6576625. PMID 8381171.
- ^ а б «Протеин, обнаруженный для прогнозирования травм головного мозга у детей при помощи ЭКМО». Детский центр Джона Хопкинса. 19 ноября 2010 г.. Получено 11 декабря 2010.
- ^ Лопес-Эджидо Дж., Каннингем Дж., Берг М., Оберг К., Бонгкам-Рудлофф Э., Гобл А. (август 2002 г.). «Взаимодействие менина с глиальным фибриллярным кислым белком и виментином предполагает роль сети промежуточных филаментов в регуляции активности менина». Экспериментальные исследования клеток. 278 (2): 175–83. Дои:10.1006 / excr.2002.5575. PMID 12169273.
- ^ Нильсен А.Л., Холм И.Е., Йохансен М., Бонвен Б., Йоргенсен П., Йоргенсен А.Л. (август 2002 г.). «Новый вариант сплайсинга глиального фибриллярного кислого белка, GFAP-эпсилон, взаимодействует с белками пресенилина». Журнал биологической химии. 277 (33): 29983–91. Дои:10.1074 / jbc.M112121200. PMID 12058025.
- ^ Миддельдорп Дж., Хол Э.М. (март 2011 г.). «GFAP в здоровье и болезни». Прогресс в нейробиологии. 93 (3): 421–43. Дои:10.1016 / j.pneurobio.2011.01.005. PMID 21219963. S2CID 41192525.
дальнейшее чтение
- Касерес-Марзал С., Вакерисо Дж., Галан Э., Фернандес С. (октябрь 2006 г.). «Ранняя митохондриальная дисфункция у младенца с болезнью Александра». Детская неврология. 35 (4): 293–6. Дои:10.1016 / j.pediatrneurol.2006.03.010. PMID 16996408.
внешняя ссылка
- GeneReviews / NCBI / NIH / UW запись о болезни Александра
- Записи OMIM о болезни Александра
- Глиальный фибриллярный кислый белок в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Обзор всей структурной информации, доступной в PDB за UniProt: P14136 (Глиальный фибриллярный кислый белок) на PDBe-KB.