Вирусная нейраминидаза - Viral neuraminidase
| Нейраминидаза | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
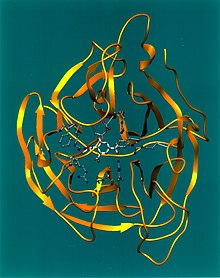 Кристаллографическая структура нейраминидазы гриппа в комплексе с ингибитором 4-ацетамидо-3-гидрокси-5-нитробензойной кислотой.[1] | |||||||||||
| Идентификаторы | |||||||||||
| Символ | Neur | ||||||||||
| Pfam | PF00064 | ||||||||||
| Pfam клан | CL0434 | ||||||||||
| ИнтерПро | IPR001860 | ||||||||||
| SCOP2 | 2bat / Объем / СУПФАМ | ||||||||||
| CAZy | GH34 | ||||||||||
| CDD | cd00260 | ||||||||||
| |||||||||||


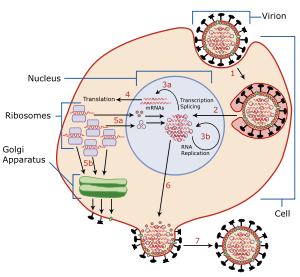
Вирусная нейраминидаза это тип нейраминидаза найдено на поверхности вирусы гриппа что позволяет вирусу высвобождаться из клетки-хозяина. Нейраминидазы ферменты этот раскол сиаловая кислота (также называемый нейраминовая кислота ) группы из гликопротеины. Ингибиторы нейраминидазы представляют собой противовирусные агенты, которые ингибируют активность нейраминидазы вируса гриппа и имеют большое значение в борьбе с гриппом.[3]
Вирусные нейраминидазы являются членами семейства гликозидгидролаз 34 КАЗИ GH_34 который включает ферменты только с одной известной активностью; сиалидаза или же нейраминидаза EC 3.2.1.18. Нейраминидазы расщепляют терминал сиаловая кислота остатки углеводных цепей в гликопротеинах. Сиаловая кислота - это отрицательно заряженный сахар, связанный с белковыми и липидными частями липопротеины.
Чтобы заразить клетку-хозяин, вирус гриппа прикрепляется к внешней поверхности клетки, используя гемагглютинин, молекула, обнаруженная на поверхности вируса, которая связывается с группами сиаловой кислоты. Сиаловые кислоты встречаются на различных гликопротеины на поверхности клетки-хозяина. Затем вирус переходит из группы сиаловой кислоты в группу сиаловой кислоты, пока не найдет правильный рецептор на клеточной поверхности (личность которого остается неизвестной).[4] Нейраминадаза обеспечивает это движение, отщепляя группы сиаловой кислоты, к которым был присоединен гемагглютинин. После того, как вирус проник в клетку и реплицировался, новые вирусные частицы отрываются от мембраны клетки-хозяина. Гемагглютинин на новых вирусных частицах остается прикрепленным к группам сиаловой кислоты гликопротеинов на внешней поверхности клетки и на поверхности других вирусных частиц; нейраминадаза расщепляет эти группы и тем самым способствует высвобождению вирусных частиц[5] и предотвращает самоагрегацию.[4] Нейраминадаза также способствует перемещению вирусных частиц в слизи, богатой сиаловой кислотой.[4]
Один гемагглютинин-нейраминидаза белок может сочетать нейраминидазу и гемагглютинин функции, такие как в вирус паротита и вирус парагриппа человека.
Функция
Фермент помогает вирусам высвобождаться после отпочкования из плазматической мембраны клетки-хозяина. Мембраны вируса гриппа содержат два гликопротеины: гемагглютинин и нейраминидаза. В то время как гемагглютинин на поверхности вирион необходим для заражения, его присутствие тормозит высвобождение частицы после бутонизации. Вирусная нейраминидаза расщепляет концы сиаловая кислота остатки от гликан структуры на поверхности инфицированной клетки. Это способствует высвобождению потомства вирусов и распространению вируса из клетки-хозяина в неинфицированные окружающие клетки. Нейраминидаза также отщепляет остатки сиаловой кислоты от вирусных белков, предотвращая агрегацию вирусов.
Ингибиторы
Нейраминидаза была нацелена в программах разработки ингибиторов ферментов на основе структуры, которые привели к производству двух лекарств: занамивир (Реленца) и осельтамивир (Тамифлю). Администрация ингибиторы нейраминидазы - это лечение, ограничивающее серьезность и распространение вирусных инфекций. Ингибиторы нейраминидазы полезны для борьбы с грипп инфекционное заболевание: занамивир, вводимый путем ингаляции; осельтамивир перорально; и исследуется перамивир вводят парентерально, то есть путем внутривенной или внутримышечной инъекции.
Устойчивость к ингибированию нейраминидазы
27 февраля 2005 г. у 14-летней вьетнамской девушки был обнаружен H5N1 штамм вируса гриппа, устойчивый к препарату осельтамивир. Препарат применяют для лечения больных гриппом. Однако вьетнамская девочка, которая получала профилактическую дозу (75 мг один раз в день), оказалась невосприимчивой к лечению. В растущем страхе перед глобальной пандемией птичьего гриппа ученые начали искать причину сопротивления вирусу. Тамифлю медикамент. Причина была установлена в превращении гистидина в тирозин (аминокислота ) замену в положении 274 в его белке нейраминидазе.
Поскольку штаммы гриппа постоянно мутируют, важно, чтобы ученые быстро и эффективно определили правильный подтип нейраминидазы, который отвечает за лекарственную устойчивость, чтобы разработать лекарства, которые будут бороться с конкретными штаммами гриппа.
Новый класс ингибиторов нейраминидазы, которые ковалентно присоединяются к ферменту, показали активность против вируса, устойчивого к лекарствам. in vitro.[6][7]
Специфика
В идеальных условиях нейраминидаза (NA) вируса гриппа должна действовать на рецептор того же типа, что и вирус. гемагглютинин (HA) связывается с явлением, которое случается не всегда. Не совсем понятно, как вирусу удается функционировать, когда нет близкого соответствия между специфичностями NA и HA.
Экзо- и эндо-
Ферменты нейраминидазы могут иметь эндо- или экзо-гликозидаза активность и классифицируются как EC 3.2.1.29 (эндонейраминидаза)[8] и EC 3.2.1.18 (экзонейраминидазы).[9] В общем, остатки сиаловой кислоты млекопитающих находятся в концевых положениях (невосстанавливающий конец) в сложных гликанах, и поэтому вирусные нейраминидазы, которые являются экзо-гликозидаза ферменты - используют эти концевые остатки в качестве субстратов.
Смотрите также
Рекомендации
- ^ Jedrzejas, MJ; Сингх, S; Brouillette, WJ; Laver, WG; Air, GM; Луо, М. (14 марта 1995 г.). «Структуры ароматических ингибиторов нейраминидазы вируса гриппа». Биохимия. 34 (10): 3144–51. Дои:10.1021 / bi00010a003. PMID 7880809.
- ^ Varghese, J. N .; McKimm-Breschkin, J. L .; Caldwell, J. B .; Kortt, A. A .; Колман, П.М. (1992). «Структура комплекса нейраминидазы вируса гриппа и сиаловой кислоты, рецептора вируса». Белки: структура, функции и генетика. 14 (3): 327–32. Дои:10.1002 / prot.340140302. PMID 1438172.
- ^ Диван РБ (1999). «Меры по борьбе с гриппом». Фармакоэкономика. 16 Дополнение 1: 41–5. Дои:10.2165/00019053-199916001-00006. PMID 10623375. S2CID 41844816.
- ^ а б c Доу, Дэн; Revol, Ребекка; Остбай, Хенрик; Ван, Хао; Дэниелс, Роберт (20.07.2018). «Вхождение в клетку вируса гриппа A, репликация, сборка и перемещение вириона». Границы иммунологии. 9. Дои:10.3389 / fimmu.2018.01581. ISSN 1664-3224. ЧВК 6062596. PMID 30079062.
- ^ Хуанг И.С., Ли В., Суй Дж., Мараско В., Чхве Х., Фарзан М. (май 2008 г.). «Нейраминидаза вируса гриппа А ограничивает вирусную суперинфекцию». Дж. Вирол. 82 (10): 4834–43. Дои:10.1128 / JVI.00079-08. ЧВК 2346733. PMID 18321971.
- ^ BBC News: лекарство от гриппа обещает преодолеть сопротивление (по состоянию на 22 февраля 2013 г.)
- ^ Ким Дж-Х и другие. Механические ингибиторы ковалентной нейраминидазы с широким спектром противовирусной активности против гриппа. Наука Дои:10.1126 / science.1232552
- ^ «EC 3.2.1.129».
- ^ «EC 3.2.1.18».
внешняя ссылка
- База данных исследований гриппа База данных последовательностей вируса гриппа (включая нейраминидазу).
- Протеопедия Нейраминидаза гриппа, Тамифлю и Реленза Нейраминидаза птичьего гриппа, Тамифлю и Реленза
