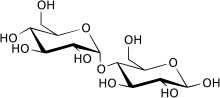
Мальтаза - Maltase
| Альфа-глюкозидаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 3.2.1.20 | ||||||||
| Количество CAS | 9001-42-7 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Мальтаза (ЕС 3.2.1.20, альфа-глюкозидаза, глюкоинвертаза, глюкозидосахараза, мальтаза-глюкоамилаза, альфа-глюкопиранозидаза, глюкозидоинвертаза, альфа-D-глюкозидаза, альфа-глюкозид гидролаза, альфа-1,4-глюкозидаза, альфа-D-глюкозид глюкогидролаза) представляет собой фермент, расположенный на щеточной кайме тонкой кишки, который расщепляет дисахарид мальтоза.[1][2][3][4][5][6] Мальтаза катализирует то гидролиз мальтозы в простой сахар глюкоза. Этот фермент содержится в растениях, бактериях и дрожжах. Дефицит кислотной мальтазы подразделяется на три отдельных типа в зависимости от возраста появления симптомов у пораженного человека.
В большинстве случаев это эквивалентно альфа-глюкозидаза, но термин «мальтаза» подчеркивает дисахаридную природу субстрата, от которого отщепляется глюкоза, а «альфа-глюкозидаза» подчеркивает связь, независимо от того, является ли субстрат дисахаридом или полисахарид.[нужна цитата ]
Летучие мыши-вампиры являются единственными позвоночными, которые, как известно, не проявляют активности кишечной мальтазы.[7]
Смотрите также
использованная литература
- ^ «Мальтаза - определение из онлайн-словаря Merriam-Webster». Получено 2009-04-06.
- ^ Бруни CB, Sica V, Auricchio F, Covelli I (сентябрь 1970). «Дальнейшая кинетическая и структурная характеристика лизосомальной альфа-D-глюкозид глюкогидролазы из печени крупного рогатого скота». Biochimica et Biophysica Acta (BBA) - Энзимология. 212 (3): 470–7. Дои:10.1016/0005-2744(70)90253-6. PMID 5466143.
- ^ Фланаган П.Р., Форстнер Г.Г. (август 1978 г.). «Очистка кишечной мальтазы / глюкоамилазы крыс и ее аномальная диссоциация при нагревании или при низком pH». Биохимический журнал. 173 (2): 553–63. Дои:10.1042 / bj1730553. ЧВК 1185809. PMID 29602.
- ^ Ларнер, Дж. (1960). «Другие глюкозидазы». In Boyer, P.D .; Lardy, H .; Myrbäck, K. (ред.). Ферменты. 4 (2-е изд.). Нью-Йорк: Academic Press. С. 369–378.
- ^ Шиваками С., Радхакришнан А.Н. (декабрь 1973 г.). «Очистка кишечной глюкоамилазы кролика с помощью аффинной хроматографии на сефадексе G-200». Индийский журнал биохимии и биофизики. 10 (4): 283–4. PMID 4792946.
- ^ Соренсен Ш., Норен О., Шёстрём Х., Даниэльсен Э.М. (сентябрь 1982 г.). «Амфифильные микроворсинки кишечника свиней, мальтаза / глюкоамилаза. Структура и специфичность». Европейский журнал биохимии. 126 (3): 559–68. Дои:10.1111 / j.1432-1033.1982.tb06817.x. PMID 6814909.
- ^ Schondube JE, Herrera-M LG, Martínez del Rio C (2001). «Диета и эволюция пищеварения и функции почек у летучих мышей-филлостомид» (PDF). Зоология. 104 (1): 59–73. Дои:10.1078/0944-2006-00007. PMID 16351819.
внешние ссылки
- Мальтазы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Структура и эволюция мальтазы-глюкоамилазы и сахаразы-изомальтазы млекопитающих