E1 (ВГС) - E1 (HCV)
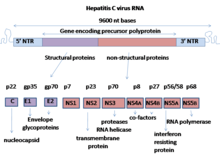
E1 одна из двух субъединиц конверта гликопротеин[1] найдено в вирус гепатита С.[2][3] Другая подгруппа E2. Этот белок относится к типу 1 трансмембранный белок с сильно гликозилированным N-концевой эктодомен и C-терминал гидрофобный якорь. После синтеза гликопротеины E1 связываются с гликопротеином E2 как нековалентный гетеродимер.[4]
Структура
Остатки гликопротеина E1 192-383 в генотип 1a штамм H77. После перевода C-терминал E1 трансмембранные домены (TMD) образует заколка для волос антипараллельных а-спирали. Затем E1 расщепляется сигнальным пептидом. пептидаза на эндоплазматический ретикулум и E1 затем превращается в одну длинную прямую a-спираль. Все, что известно о структуре, взято из Кристальная структура Сделано в 2014 году.[5] Эта кристаллическая структура показывает, что она имеет две а-спирали и 3 B-листы для обоих мономеры; два дисульфид мосты стабилизируют эти два мономера. Это означает, что E1 более компактный, чем его аналог E2. Было показано, что E1 может сворачиваться при наличии небольшого количества белка E2. Кроме того, было показано, что окисление E1 предшествует созреванию E2. Это означает, что E1 играет роль наставника для E2.[6] Несмотря на эти находки, о структуре E1 еще многое неизвестно. Белок E1 прикреплен к мембране. Большую часть времени E1 остается в развернутой конформации.
Функция
Белок E1 помогает вирусу прикрепляться к мембране клетки-мишени. В другом вирусе оболочки белок E1 играет аналогичную роль, помогая вирусу проникнуть в клетку. Было обнаружено, что как гетеродимер с E2 он важен для проникновения HCV.[7] Когда гетеродимер образуется, вирус гепатита С может связываться с рецептором клетки. В качестве гетеродимера белок E1 отдельно с белком E2 работали вместе, чтобы проникнуть в клетку. Также расщепление в соединении ядро-E1 является предпосылкой для катализируемого SPP расщепления. Это помогает вирусу переместиться на поверхность липидных капель. Как только вирус попадает на поверхность липидных капель, он рекрутирует неструктурные белки вируса и комплекс репликации.[8] Катализируемое SP расщепление в соединении ядро-E1 необходимо для образования инфекционных частиц и высвобождения любых частиц HCV. Также E1 не имеет функции отростка на мембране ER. Также он не влиял на внутриклеточное образование капсид -содержащие частицы. Вместо этого, когда E1 не позволяли формироваться, это способствовало процессу бутонизации.
Возможная вакцина
Было показано, что, блокируя E1, мы можем предотвратить образование белок оболочки. Был проведен ряд исследований, пытающихся найти структуру E1. Эти вакцины надеются, что они смогут заблокировать проникновение гепатита C, если они смогут блокировать образование E1. Если вирус не может продуцировать белок оболочки, он не сможет проникнуть в клетки-хозяева.[9] Типы вакцина которые будут использоваться, являются синтетическими пептидными вакцинами.[10]
Рекомендации
- ^ Haddad, J.G .; Rouille, Y .; и другие. (2017). «Идентификация новых функций гликопротеина E1 оболочки вируса гепатита С при проникновении и сборке вируса». Журнал вирусологии. 91 (11): e00048-17. Дои:10.1128 / JVI.00048-17. ЧВК 5375667. PMID 28179528.
- ^ Гарсия Дж. Э., Пуэнтес А., Суарес Дж. И др. (Февраль 2002 г.). «Области белка E1 и E2 вируса гепатита C (HCV), которые специфически связываются с клетками HepG2». J. Hepatol. 36 (2): 254–62. Дои:10.1016 / S0168-8278 (01) 00262-8. PMID 11830338.
- ^ Bartosch B, Dubuisson J, Cosset FL (март 2003 г.). «Псевдочастицы вируса инфекционного гепатита С, содержащие функциональные белковые комплексы оболочки E1 – E2». J. Exp. Med. 197 (5): 633–42. Дои:10.1084 / jem.20021756. ЧВК 2193821. PMID 12615904.
- ^ Lavie, M .; Goffard, A .; Dubuisson, J. В главе 4 Гликопротеины HCV: сборка функционального гетеродимера E1-E2; Норфолк: Великобритания, 2006 г .; .
- ^ Freedman, H .; Logan, M. R .; Закон, J. L .; Хоутон, М. (2016). «Структура и функция гликопротеинов E1 и E2 оболочки вируса гепатита C: противовирусные и вакцинные мишени». Инфекционные болезни ACS. 2 (11): 749–762. Дои:10.1021 / acsinfecdis.6b00110. PMID 27933781.
- ^ Abdelwahab, K. S .; Ахмед Саид, З. Н. (2016). «Статус вакцинации против вируса гепатита С: последние данные». Всемирный журнал гастроэнтерологии. 22 (2): 862–73. Дои:10.3748 / wjg.v22.i2.862. ЧВК 4716084. PMID 26811632.
- ^ Lavie, M .; Goffard, A .; Dubuisson, J. В главе 4 Гликопротеины HCV: сборка функционального гетеродимера E1-E2; Норфолк: Великобритания, 2006 г .; .
- ^ Pène, V .; Lemasson, M .; Харпер, Ф .; Pierron, G .; Розенберг, А. Р. (2017). «Роль расщепления на стыке core-E1 полипротеина вируса гепатита С в морфогенезе вируса». PLOS ONE. 12 (4): e0175810. Bibcode:2017PLoSO..1275810P. Дои:10.1371 / journal.pone.0175810. ЧВК 5402940. PMID 28437468.
- ^ Freedman, H .; Logan, M. R .; Закон, J. L .; Хоутон, М. (2016). «Структура и функция гликопротеинов E1 и E2 оболочки вируса гепатита C: противовирусные и вакцинные мишени». Инфекционные болезни ACS. 2 (11): 749–762. Дои:10.1021 / acsinfecdis.6b00110. PMID 27933781.
- ^ Abdelwahab, K. S .; Ахмед Саид, З. Н. (2016). «Статус вакцинации против вируса гепатита С: последние данные». Всемирный журнал гастроэнтерологии. 22 (2): 862–73. Дои:10.3748 / wjg.v22.i2.862. ЧВК 4716084. PMID 26811632.
