Арилдиалкилфосфатаза - Aryldialkylphosphatase
| Фосфотриэстераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 3.1.8.1 | ||||||||
| Количество CAS | 117698-12-1 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Арилдиалкилфосфатаза (EC 3.1.8.1 ) (более известный как фосфотриэстераза (PTE), а также органофосфат гидролаза, паратион гидролаза, параоксон ас, и паратион арил эстераза) это металлофермент который гидролизует триэстерная связь[1] нашел в органофосфат инсектициды.
| Семейство фосфотриэстераз | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Структура фосфорорганической гидролазы | |||||||||||
| Идентификаторы | |||||||||||
| Символ | PTE | ||||||||||
| Pfam | PF02126 | ||||||||||
| ИнтерПро | IPR001559 | ||||||||||
| PROSITE | PDOC01026 | ||||||||||
| SCOP2 | 1dpm / Объем / СУПФАМ | ||||||||||
| |||||||||||
- арилдиалкилфосфат + H2О диалкилфосфат + ариловый спирт
Таким образом, два субстраты этого фермента являются арилдиалкилфосфат и ЧАС2О, а его два товары диалкилфосфат и ариловый спирт.
Ген (опд, для разложения органофосфатов), который кодирует фермент, находится в большом плазмида (pSC1, 51Kb) эндогенный для Псевдомонады диминута,[2] хотя ген также был обнаружен у многих других видов бактерий, таких как Флавобактерии sp. (ATCC27551), где он также закодирован в внехромосомный элемент (pSM55, 43 КБ).[2]
Органофосфат общее название для сложные эфиры из фосфорная кислота и является одним из фосфорорганические соединения. Их можно найти в составе инсектициды, гербициды, и нервно-паралитические газы, среди других. Некоторые менее токсичные органофосфаты можно использовать в качестве растворители, пластификаторы, и Противозадирные присадки. На использование органофосфатов приходится примерно 38% всего использования пестицидов в мире.[3]
Ген
Бактериальные изоляты, способные разлагать фосфорорганические (ФО) пестициды, были идентифицированы из образцов почвы из разных частей мира.[3][4] Первый вид бактерий, разлагающих органофосфат, был выделен из образец почвы от Филиппины в 1973 г.,[5] который идентифицирован как Флавобактерии sp. ATCC27551. С тех пор другие виды продемонстрировали способность разрушать ОП, например Pseudomonas diminuta (выделено из образца почвы США), Agrobacterium radiobacter (выделено из образца австралийской почвы), Alteromonas haloplanktis (выделено из образца почвы США), и Псевдомонады sp. WBC-3 (выделен из образца китайской почвы).[3]
Способность гидролизовать органофосфаты не уникальна для бактерий. Было обнаружено, что некоторые виды грибов и цианобактерий также гидролизуют ФП.[3] Более того, в результате поиска гомологии последовательностей целых геномов было идентифицировано несколько других видов бактерий, которые также содержат последовательности из того же семейства генов, что и опд, включая патогенные бактерии, такие как кишечная палочка (yhfV) и Микобактерии туберкулеза.[3]
Последовательность гена, кодирующая фермент (опд) в Флавобактерии sp. ATCC27551 и Pseudomonas diminuta очень консервативен (100% гомология последовательностей ),[4] хотя плазмиды, в которых обнаружены гены, имеют очень разные последовательности, кроме 5.1Kb[4][6] консервативный регион где ген находится.[2]
Более пристальный взгляд на организацию опд ген из Флавобактерии предлагает потенциальную транспозон -подобная архитектура, которая объясняет широкое распространение гена среди других видов микробов, которое могло произойти посредством латерального переноса ДНК. В опд ген фланкирован последовательностями вставки транспозиции, характерными для Tn3 семейство транспозонов. Более того, транспозаза -подобная последовательность (гомологичная TnpA) и резольваза -подобная последовательность (гомологичная TnpR) также были выявлены в регионах вверх по течению из опд ген,[4] которые являются характеристиками класса II транспозоны например, Tn3.
Кроме того, еще один открытая рамка чтения был идентифицирован вниз по течению из опд и кодирует белок, который далее разлагается п-нитрофенол, один из побочных продуктов деградации ОП. Считается, что этот белок работает в комплексе с PTE, поскольку при наличии PTE наблюдается резкое повышение активности.[4]
Поэтому характерная архитектурная организация опд область гена предполагает, что разные виды приобрели ген через горизонтальный перенос посредством транспозиции и переноса плазмиды.
Протеин
Структура
Фосфотриэстераза (PTE) принадлежит к семейству металлоферментов, которое имеет два каталитических Zn2+ атомы металла, соединенные мостиком через общий лиганд и координированные имидазол боковые цепи гистидин остатки, которые группируются вокруг атомов металла.[7] Белок образует гомодимер.[8] Общая структура состоит из мотива α / β-цилиндра, который также присутствует в других 20 каталитических белках. Активные сайты этих белков расположены в C-концевой части β-ствола, где также находится активный сайт PTE.[7]

Катализ
Катализ органофосфатов происходит путем нуклеофильного замещения с инверсией конфигурации (SN2 механизм) о фосфорном центре субстрата.[7] В активном центре катионы металлов способствуют катализу за счет дальнейшей поляризации связи P – O субстрата, что делает его более восприимчивым к нуклеофильной атаке. Кроме того, основной остаток отрывает протон от молекулы воды, а образующийся гидроксид-ион связывает два двухвалентных катиона и действует как нуклеофил. ОН− затем атакует фосфорный центр субстрата, за которым следует перенос протона. Связь P – O разрывается, и продукты высвобождаются из активного центра.[9] Скорость оборота (kКот) фосфотриэстеразы составляет почти 104 s−1 для гидролиза параоксона,[10] и продукты п-нитрофенол и диэтилфосфорная кислота.
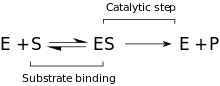
Кинетика
Предложенная кинетическая модель состоит из стадии обратимого связывания, которая происходит между ферментом и субстратом, и образования Комплекс Михаэлиса (ES). Далее следует необратимый этап, когда связь P – O разрывается и образуется временный комплекс фермент + продукт (EP). Наконец, продукты высвобождаются, и свободный фермент (E) регенерируется.[9]
Разновидность
Фосфотриэстераза присутствует в двух видах: Pseudomonas diminuta и Флавобактерии sp. ATCC27551. Другие варианты генов, которые также кодируют ферменты, разрушающие органофосфат, присутствуют у других видов. В список включены такие виды бактерий, как радиорезистентные. Дейнококк радиодуранс, патогены Микобактерии туберкулеза и Mycobacterium bovis, анаэробная бактерия Desulfatibacillum alkenivorans, термофильные бактерии Геобациллы sp. и Thermoanaerobacter sp. X514, кишечная палочка (yhfV) и многие другие группы бактерий,[3] а также некоторые Археи Такие как Sulfolobus acidocaldarius.[11]

Субклеточная локализация
Фосфотриэстераза представляет собой ассоциированный с мембраной белок, который транслируется целевым пептидом длиной 29 аминокислот (мотив Tat),[12][10][13] который затем отщепляется от зрелого белка после вставки в плазматическую мембрану.[1] Белок прикреплен к внутренней мембране клетки, обращенной к периплазме.[14]
Функция
Фермент фосфотриэстераза гидролизует органофосфатные соединения путем расщепления триэфирной связи в субстрате.

Фермент имеет очень широкую субстратную специфичность,[12] и очень эффективно катализирует реакцию: ПТЭ гидролизует параоксон со скоростью, приближающейся к диффузионному пределу,[15] что указывает на то, что фермент оптимально эволюционировал для использования этого субстрата.[13] Он действует специально на синтетические триэфиры органофосфата и фосфорфторидаты.[3] Кажется, что он не имеет естественного субстрата и, следовательно, может быть оптимально эволюционирован для использования параоксон и другие общие сельскохозяйственные пестициды.[15]
Продуктами реакции являются диэтилфосфорная кислота и п-нитрофенол.[4] Последний продукт далее разлагается ферментом, кодируемым 750 п.о. опд ген и кодирует предполагаемую гидролазу 29 кДа, которая может участвовать в разложении ароматических соединений, и работает вместе с PTE.[4] Этот фермент гомологичен гидролазам в Pseudomonas putida, Pseudomonas azelaica, Родококк sp., и P. fluorescens.[4]
Органофосфаты не токсичны для бактерий, но действуют как ингибиторы ацетилхолинэстеразы у животных.[16] Некоторые виды бактерий также могут использовать органофосфаты в качестве питательных веществ и источника углерода.[14]
Экологическое значение
Фосфотриэстеразы считаются сильным кандидатом в биокатализаторы для целей биоремедиации.[7] Его широкая субстратная специфичность и каталитическая эффективность делают его привлекательной мишенью для потенциального использования микробов, содержащих ген opd, при детоксикации почв, токсичных из-за чрезмерного использования пестицидов.[3] Кроме того, органофосфаты действуют как ингибиторы ацетилхолинэстеразы (AChE). Нейротрансмиттер AChE является жизненно важным компонентом центральной нервной системы (ЦНС) насекомых у животных, и ингибирование правильного обмена этого нейрохимического вещества приводит к чрезмерной стимуляции ЦНС, что в конечном итоге приводит к гибели насекомых и млекопитающих.[3][17] В результате использование микроорганизмов, разлагающих фосфорорганические соединения, представляет собой потенциально эффективный, недорогой и экологически безопасный метод удаления этих токсичных соединений из окружающей среды.[3]
История
Виды бактерий, которые обладали способностью разлагать фосфорорганические пестициды, были выделены из образцов почвы из разных частей мира. Первый штамм бактерий, способный гидролизовать органофосфаты, был обнаружен. Флавобактерии sp. ATCC 27551, обнаруженный Сетхунатаном и Йошидой в 1973 году в образце почвы, родом из Филиппин.[5] С тех пор было обнаружено, что у других видов также есть ферменты, расщепляющие органофосфат, аналогичные тем, которые обнаружены в Флавобактерии[6].
Рекомендации
- ^ а б Пинджари А.Б., Пандей Дж. П., Камиредди С., Сиддаваттам Д. (июль 2013 г.). «Экспрессия и субклеточная локализация органофосфатгидролазы в разлагающем ацефат штамме Pseudomonas sp. Ind01 и его использование в качестве потенциального биокатализатора для устранения фосфорорганических инсектицидов». Письма по прикладной микробиологии. 57 (1): 63–8. Дои:10.1111 / lam.12080. PMID 23574004. S2CID 12006833.
- ^ а б c Харпер Л.Л., Макдэниел С.С., Миллер С.Е., Уайлд-младший (октябрь 1988 г.). «Разные плазмиды, выделенные из Pseudomonas diminuta MG и Flavobacterium sp. (ATCC 27551), содержат идентичные гены opd». Прикладная и экологическая микробиология. 54 (10): 2586–9. Дои:10.1128 / AEM.54.10.2586-2589.1988. ЧВК 204325. PMID 3202637.
- ^ а б c d е ж грамм час я j Сингх Б.К. (февраль 2009 г.). «Фосфорорганические бактерии: экология и промышленное применение». Обзоры природы. Микробиология. 7 (2): 156–64. Дои:10.1038 / nrmicro2050. PMID 19098922. S2CID 205497513.
- ^ а б c d е ж грамм час Сиддаваттам Д., Хаджамохиддин С., Манавати Б., Пакала С.Б., Меррик М. (май 2003 г.). «Транспозоноподобная организация кластера генов плазмидной органофосфатной деградации (opd), обнаруженного в Flavobacterium sp». Прикладная и экологическая микробиология. 69 (5): 2533–9. Дои:10.1128 / AEM.69.5.2533-2539.2003. ЧВК 154515. PMID 12732518.
- ^ а б Сетхунатан Н., Йошида Т. (июль 1973 г.). «Flavobacterium sp., Разлагающий диазинон и паратион». Канадский журнал микробиологии. 19 (7): 873–5. Дои:10,1139 / м73-138. PMID 4727806.
- ^ а б Mulbry WW, Karns JS, Kearney PC, Nelson JO, McDaniel CS, Wild JR (май 1986). «Идентификация плазмидного гена паратионгидролазы из Flavobacterium sp. Путем южной гибридизации с opd из Pseudomonas diminuta». Прикладная и экологическая микробиология. 51 (5): 926–30. Дои:10.1128 / AEM.51.5.926-930.1986. ЧВК 238989. PMID 3015022.
- ^ а б c d Беннинг М.М., Куо Дж. М., Раушель Ф. М., Холден Х. М. (декабрь 1994 г.). «Трехмерная структура фосфотриэстеразы: фермент, способный детоксифицировать фосфорорганические нервно-паралитические агенты». Биохимия. 33 (50): 15001–7. Дои:10.1021 / bi00254a008. PMID 7999757.
- ^ Донг Ю.Дж., Бартлам М., Сунь Л., Чжоу Ю.Ф., Чжан З.П., Чжан К.Г., Рао З., Чжан XE (октябрь 2005 г.). «Кристаллическая структура метилпаратионгидролазы из Pseudomonas sp. WBC-3». Журнал молекулярной биологии. 353 (3): 655–63. Дои:10.1016 / j.jmb.2005.08.057. PMID 16181636.
- ^ а б Обер С.Д., Ли Й., Раушель Ф.М. (май 2004 г.). «Механизм гидролиза органофосфатов бактериальной фосфотриэстеразой». Биохимия. 43 (19): 5707–15. Дои:10.1021 / bi0497805. PMID 15134445.
- ^ а б Mulbry WW, Karns JS (февраль 1989 г.). «Очистка и характеристика трех паратионгидролаз из штаммов грамотрицательных бактерий». Прикладная и экологическая микробиология. 55 (2): 289–93. Дои:10.1128 / AEM.55.2.289-293.1989. ЧВК 184103. PMID 2541658.
- ^ Чен Л., Брюггер К., Сковгаард М., Реддер П., Ше К., Тораринссон Е., Греве Б., Авайез М., Зибат А., Кленк Х. П., Гаррет Р. А. (июль 2005 г.). «Геном Sulfolobus acidocaldarius, модельного организма Crenarchaeota». Журнал бактериологии. 187 (14): 4992–9. Дои:10.1128 / JB.187.14.4992-4999.2005. ЧВК 1169522. PMID 15995215.
- ^ а б Классен Дж. Дж., Энглер К. Р., Кенерли С. М., Уиттакер А. Д. (апрель 2000 г.). «Логистическая модель подповерхностного роста грибов с применением для биоремедиации». Журнал экологической науки и здоровья, часть A. 35 (4): 465–488. Дои:10.1080/10934520009376982. S2CID 98035446.
- ^ а б Caldwell SR, Newcomb JR, Schlecht KA, Raushel FM (июль 1991 г.). «Пределы диффузии при гидролизе субстратов фосфотриэстеразой из Pseudomonas diminuta». Биохимия. 30 (30): 7438–7444. Дои:10.1021 / bi00244a010. ISSN 0006-2960. PMID 1649628.
- ^ а б Сингх Б.К., Уокер А. (май 2006 г.). «Микробное разложение фосфорорганических соединений». Обзор микробиологии FEMS. 30 (3): 428–71. Дои:10.1111 / j.1574-6976.2006.00018.x. PMID 16594965.
- ^ а б Дюма Д.П., Колдуэлл С.Р., Уайлд-младший, Раушель FM (ноябрь 1989 г.). «Очистка и свойства фосфотриэстеразы из Pseudomonas diminuta». Журнал биологической химии. 264 (33): 19659–65. PMID 2555328.
- ^ Лотти М (2002). «Стимулирование фосфорорганической замедленной полинейропатии некоторыми ингибиторами эстеразы». Токсикология. 181–182: 245–248. Дои:10.1016 / s0300-483x (02) 00291-3. PMID 12505319.
- ^ Рагнарсдоттир К.В. (2000). «Экологическая судьба и токсикология фосфорорганических пестицидов». Журнал геологического общества. 157 (4): 859–876. Bibcode:2000JGSoc.157..859R. Дои:10.1144 / jgs.157.4.859. S2CID 129950334.
дальнейшее чтение
- Олдридж WN (январь 1953 г.). «Сывороточные эстеразы. I. Два типа эстеразы (A и B), гидролизующие п-нитрофенилацетат, пропионат и бутират, и метод их определения». Биохимический журнал. 53 (1): 110–7. Дои:10.1042 / bj0530110. ЧВК 1198110. PMID 13032041.
- Bosmann HB (июль 1972 г.). «Мембранные маркерные ферменты. Характеристика арилэстеразы коры головного мозга морской свинки, использующей п-нитрофенилацетат в качестве субстрата». Biochimica et Biophysica Acta. 276 (1): 180–91. Дои:10.1016/0005-2744(72)90019-8. PMID 5047702.
- Mackness MI, Thompson HM, Hardy AR, Walker CH (июль 1987 г.). «Различие между 'A'-эстеразами и арилэстеразами. Значение для классификации эстераз». Биохимический журнал. 245 (1): 293–6. Дои:10.1042 / bj2450293. ЧВК 1148115. PMID 2822017.
- Главный AR (1960). «Дифференциация эстераз А-типа в сыворотке овец». Biochem. J. 75: 188–195. Дои:10.1042 / bj0750188. ЧВК 1204348. PMID 14420012.

