Mycoplasma pneumoniae - Mycoplasma pneumoniae
| Mycoplasma pneumoniae | |
|---|---|
| Научная классификация | |
| Домен: | |
| Тип: | |
| Учебный класс: | |
| Заказ: | |
| Семья: | |
| Род: | |
| Разновидность: | M. pneumoniae |
| Биномиальное имя | |
| Mycoplasma pneumoniae Somerson et al., 1963 г. | |
Mycoplasma pneumoniae очень маленький бактерия в классе Молликуты.Это патоген человека, вызывающий заболевание. микоплазменная пневмония, форма атипичный бактериальная пневмония относится к болезнь холодовых агглютининов. M. pneumoniae характеризуется отсутствием клеточная стенка пептидогликана и, как следствие, сопротивление многих антибактериальные средства. Настойчивость M. pneumoniae инфекции даже после лечения связаны с его способностью имитировать клетка-хозяин состав поверхности.
Открытие и история
В 1898 году Нокар и Ру первыми выделили возбудитель, предположительно вызывающий пневмонию крупного рогатого скота, и назвали его «микробом перипневмонии».[1][2][3][4][5][6] Микроорганизмы из других источников, обладающие свойствами, подобными организму плевропневмонии крупного рогатого скота (ППО), вскоре стали известны как организмы, подобные плевропневмонии (ППЛО), но их истинная природа была неизвестна.[1][2][3][4] Позже было доказано, что многие PPLO являются причиной пневмоний и артритов у нескольких низших животных.[1][7][8][9]
В 1944 году Монро Итон использовала куриные яйца с эмбрионами для выращивания возбудителя, который, как считается, является причиной первичной атипичной пневмонии у человека, широко известной как «ходячая пневмония».[10] Этот неизвестный организм стал известен как «агент Итон».[11] В то время использование Eaton яиц с зародышами, которые затем использовались для культивирования вирусов, поддерживало идею о том, что Eaton Agent был вирусом. Тем не менее, было известно, что ПАП поддается лечению антибиотиками широкого спектра действия.[1][2][7][12][13] подозрение на вирусную этиологию, поскольку антибиотики не действуют на вирусы.
Роберт Чанок, исследователь вирусов Eaton Agent из Национального института здоровья, посетил институт Wistar в Филадельфии в 1961 году, чтобы получить культуру клеток нормального штамма человеческих клеток, разработанного Леонардом Хейфликом. Было известно, что этот штамм клеток чрезвычайно чувствителен к выделению и выращиванию человеческих вирусов. Чанок рассказал Хейфлику о своем исследовании агента Eaton и о том, что его вирусная природа вызывает сомнения. Хотя Хейфлик мало что знал о текущих исследованиях этого агента, его докторская степень. Защитила диссертацию по болезням животных, вызываемым ППЛО. Хейфлик знал, что многие низшие животные страдают пневмониями, вызванными PPLO (позже они были названы микоплазмами). Хейфлик рассудил, что агент Eaton может быть микоплазмой, а не вирусом. Чанок никогда не слышал о микоплазмах и по просьбе Хейфлика отправил ему яичный желток, содержащий агент Итон.[1][4][14][15][16][17]
Используя новый состав агара и жидкой среды, который он разработал,[14] Хейфлик выделил из яичного желтка уникальную микоплазму. Вскоре Чанок и Хейфлик доказали, что это возбудитель ПАП.[14][18][19][20] Когда об этом открытии стало известно ведущему мировому специалисту по этим организмам, д-ру Эмми Клинебергер-Нобель из Института Листера в Лондоне, она предложила назвать этот организм Mycoplasma hayflickiae.[21] Хейфлик возражал в пользу Mycoplasma pneumoniae.[22][23]
Этот мельчайший свободноживущий микроорганизм был первым, который был изолирован и оказался причиной болезни человека. За свое открытие Хейфлик был удостоен президентской премии Международной организации микоплазмологии. Инвертированный микроскоп, под которым Хейфлик обнаружил Mycoplasma pneumoniae был присоединен Смитсоновским институтом.[20]
Таксономия и классификация
Период, термин микоплазма (Mykes что означает грибок, и плазма, значение сформировано) происходит от грибковый -подобный рост некоторых видов микоплазм.[6] Микоплазмы были классифицированы как Молликуты («Mollis», что означает «мягкий» и «cutis», что означает «кожа») в 1960 году из-за их небольшого размера и геном, отсутствие клеточная стенка, низкий Содержание G + C и необычный питательный потребности.[6][24] M. pneumoniae также был обозначен как аргинин неброжение разновидность.[25] Микоплазмы дальше классифицированный последовательностью композиции 16s рРНК. Все микоплазмы пневмония группа обладают сходными вариациями 16s рРНК, уникальными для группы, из которых M. pneumoniae имеет вариацию на 6,3% в сохраненные регионы, которые предполагают микоплазмы, образованные дегенеративная эволюция от грамположительный эубактериальный группа, которая включает бациллы, стрептококки, и лактобациллы.[6][24][25] M. pneumoniae является членом семьи Mycoplasmataceae и заказать Mycoplasmatales.[6]
Клеточная биология
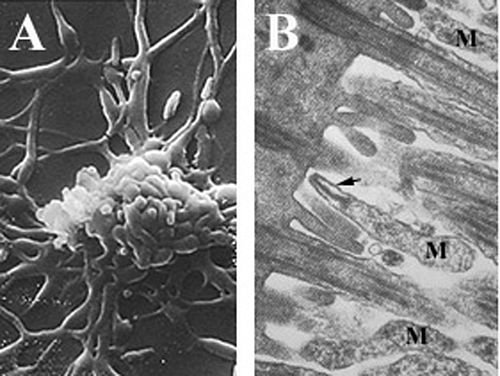
Микоплазмы - одни из самых мелких самовоспроизводящийся организмов, являются паразитический виды, у которых отсутствует клеточная стенка и периплазматическое пространство, сократили геномы, и ограниченный метаболический Мероприятия.[6][25][26] Mycoplasma pneumoniae клетки имеют удлиненную форму, примерно 0,1–0,2мкм (100-200 нм ) в ширину и 1-2 мкм (1000-2000 нм) в длину. Чрезвычайно маленький размер ячеек означает, что они не могут быть исследованы световая микроскопия; а стереомикроскоп требуется для просмотра морфология из M. pneumoniae колонии, которые обычно имеют длину менее 100 мкм.[6] Невозможность синтезировать клеточная стенка пептидогликана связано с отсутствием гены кодирует его формирование и приводит к повышенному значению в поддержании осмотический стабильность, чтобы избежать высыхание.[6] Отсутствие клеточной стенки также требует увеличения поддержки клеточная мембрана (усиленный стеринами), в который входит жесткий цитоскелет состоит из замысловатого белок сеть и, возможно, внеклеточный капсула облегчить приверженность к клетка-хозяин.[6] M. pneumoniae единственные бактериальный клетки, которые обладают холестерин в их клеточной мембране (полученной от хозяина) и обладают большим количеством генов, которые кодируют мембрану липопротеин вариации, чем у других микоплазм,[25] которые, как полагают, связаны с его паразитическим образом жизни. M. pneumoniae клетки также имеют прикрепление органелла, который используется в скользящая подвижность организма по неизвестному механизму.[6]
Геномика и метаболическая реконструкция
Последовательность действий из M. pneumoniae Геном в 1996 г. выявил его размер 816 394 п.н.[24] Геном содержит 687 генов, которые кодируют белки, из которых около 56,6% кодируют основные метаболические ферменты; особенно те, кто участвует в гликолиз и органическая кислота ферментация.[6][24][25][27] M. pneumoniae следовательно, очень подвержен потере ферментативная функция к генные мутации, поскольку единственные буферные системы против функциональной потери точечными мутациями предназначены для поддержания пентозофосфатный путь и нуклеотид метаболизм.[27] Предполагается, что потеря функции в других путях компенсируется метаболизмом клетки-хозяина.[27] В дополнение к возможности потери функции метаболических путей, уменьшенный геном M. pneumoniae прямо не хватает ряда путей, в том числе Цикл TCA, дыхательная цепь переноса электронов, и биосинтез пути для аминокислоты, жирные кислоты, холестерин и пурины и пиримидины.[6][25][27] Эти ограничения делают M. pneumoniae зависят от систем импорта для получения необходимых строительных блоков от своего хоста или среды, которые не могут быть получены через гликолитические пути.[25][27]Наряду с энергоемким белком и РНК производство, большая часть энергетического обмена идет на поддержание протонные градиенты (до 80%) из-за высокого отношение площади поверхности к объему из M. pneumoniae клетки. Только 12-29% энергетического обмена направлено на рост клеток, что необычно низко для бактериальных клеток и считается приспособление его паразитического образа жизни.[27] В отличие от других бактерий, M. pneumoniae использует кодон UGA кодировать для триптофан вместо использования его в качестве стоп-кодона.[6][24]
Хост и воспроизведение
Mycoplasma pneumoniae растет исключительно за счет паразитирующий млекопитающие. Размножение, следовательно, зависит от прикрепления к клетке-хозяину. Согласно Уэйту и Токингтону, специализированное воспроизведение происходит с помощью «двойное деление, временно связанная с дупликацией прикрепляющейся к ней органеллы, которая мигрирует к противоположному полюсу клетки во время репликации и до нуклеоид разделение ».[6] Мутации которые влияют на формирование прикрепительной органеллы, не только мешают подвижность и деление клеток, но также снижают способность M. pneumoniae клетки прикрепляются к клетке-хозяину.[25]
Патогенность

Mycoplasma pneumoniae паразитирует то дыхательные пути эпителий людей.[6] Считается, что прикрепление к респираторным эпителиальным клеткам происходит через прикрепляющуюся органеллу с последующим уклонением от хозяин иммунная система к внутриклеточный локализация и настройка клеточная мембрана состав для имитации мембраны клетки-хозяина.
Цитоадгезия
Соблюдение M. pneumoniae к клетке-хозяину (обычно дыхательные пути ячейка, но иногда эритроцит или же подкладка мочеполовой системы ячейка) является исходным событием для легочная болезнь и сопутствующие симптомы.[6] Специализированная насадка органелла это полярный, электронно-плотный и удлиненное расширение ячеек, что облегчает подвижность и прилипание к клеткам-хозяевам.[6][25] Он состоит из центрального нить окруженный внутреннимцитоплазматический пространство, а также ряд адгезины и конструктивно-вспомогательный белки локализуется на кончике органеллы.[6][25]Известно, что различные белки вносят вклад в формирование и функционирование органеллы прикрепления, включая вспомогательные белки HMW1 – HMW5, P30, P56 и P90, которые придают структуру и адгезиновую поддержку, а также P1, P30 и P116, которые непосредственно участвуют в вложение.[6][28][29] Эта сеть белков участвует не только в инициации образования и адгезии прикрепляющих органелл, но и в подвижность.[29] Адгезин P1 (трипсин-чувствительный белок) составляет 120 кДа белок сильно скоплен на поверхности кончика прикрепительной органеллы в ядовитый микоплазмы.[6][29][30] Как присутствие P1, так и его концентрация на поверхности клетки необходимы для прикрепления M. pneumoniae к клетке-хозяину. M. pneumoniae клетки, обработанные моноклональные антитела специфический для иммуногенный C-конец адгезина P1 подавляется в их способности прикрепляться к поверхности клетки-хозяина примерно на 75%, предполагая, что P1 является основным компонентом прилипания.[6][28][29] Эти антитела также снижали способность клетки к скользить быстро, что может способствовать снижению сцепления с хозяином, препятствуя их способности определять местонахождение клетки-хозяина.[28] Кроме того, мутации в P1 или деградация трипсин выход лечения авирулент M. pneumoniae клетки.[6] Потеря белков в цитоскелет участвуют в локализации P1 в структуре кончика, такой как HMW1 – HMW3, также вызывают авирулентность из-за отсутствия кластеризации адгезина.[29][30] Другой белок, который, как считается, играет важную роль в соблюдении режима лечения, - это P30, поскольку M. pneumoniae клетки с мутациями в этом белке или которые имели антитела вызванные против P30, неспособны прикрепляться к клеткам-хозяевам.[6][25] P30 не участвует в локализации P1 в структуре кончика, поскольку P1 транспортируется к органелле прикрепления у мутантов P30, но скорее он может функционировать как рецептор -вяжущий аксессуар адгезин.[25][30] Мутанты P30 также демонстрируют отчетливые морфологический такие функции, как несколько доли и округлая форма в противоположность удлиненной, что предполагает, что P30 может взаимодействовать с цитоскелетом во время формирования органеллы прикрепления.[25]Номер эукариотический Компоненты клеточной поверхности участвуют в присоединении M. pneumoniae клетки в дыхательные пути эпителий. Среди них есть сиалогликоконъюгаты, сульфатированный гликолипиды, гликопротеины, фибронектин, и нейраминовая кислота рецепторы.[6][28][31] Лектины на поверхности бактериальные клетки способны связывать олигосахарид цепочки на гликолипидах и гликопротеинах для облегчения прикрепления в дополнение к белкам TU и пируватдегидрогеназа E1 β, которые связываются с фибронектином.[6][28]

Внутриклеточная локализация
Mycoplasma pneumoniae известно уклонение от хозяина иммунная система обнаружение сопротивляться лечению антибиотиками, и крест слизистая оболочка барьеры, которые могут быть связаны с его способностью сливаться с клетками-хозяевами и выживать внутриклеточно.[6][26] Помимо непосредственной физической близости M. pneumoniae и клетки-хозяева, отсутствие клеточная стенка и своеобразный клеточная мембрана компоненты, такие как холестерин, может способствовать слиянию (1). Внутренняя локализация может привести к хронический или скрытые инфекции, как M. pneumoniae способен настойчивый, синтезируя ДНК, и копирование внутри клетки-хозяина даже после лечения антибиотиками.[26] Точный механизм внутриклеточной локализации неизвестен, однако возможность цитоплазматической секвестрации в организме хозяина объясняет сложность полного устранения M. pneumoniae инфекции у больных людей.[6]
Иммунная реакция
Помимо уклонения от иммунной системы хозяина за счет внутриклеточной локализации, M. pneumoniae может изменить состав своей клеточной мембраны, чтобы имитировать мембрану клетки-хозяина и избежать обнаружения с помощью клетки иммунной системы. M. pneumoniae клетки обладают рядом белков и гликолипидов антигены что выявить иммунные ответы, но изменение этих поверхностных антигенов позволит инфекции сохраняться достаточно долго для M. pneumoniae клетки сливаются с клетками-хозяевами и избегают обнаружения. Сходство составов M. pneumoniae мембраны клеток человека также могут приводить к аутоиммунные реакции в нескольких органах и тканях.[6]
Цитотоксичность и влияние на организм
Главный цитотоксический эффект M. pneumoniae представляет собой локальное нарушение тканевой и клеточной структуры эпителия дыхательных путей из-за его непосредственной близости к клеткам-хозяевам. Присоединение бактерий к клеткам-хозяевам может привести к потере реснички, сокращение метаболизм, биосинтез, и импорт макромолекулы, и, в конечном итоге, инфицированные клетки могут выделяться из эпителиальный оболочка.[6] M. pneumoniae продуцирует уникальный фактор вирулентности, известный как токсин внебольничного респираторного дистресс-синдрома (CARDS).[32] Токсин CARDS, скорее всего, способствует колонизации и патогенезу M. pneumoniae, что приводит к воспалению и дисфункции дыхательных путей. Кроме того, формирование пероксид водорода это ключ фактор вирулентности в M. pneumoniae инфекции.[6] Прикрепление M. pneumoniae к эритроциты разрешения распространение перекиси водорода из бактерий в клетку-хозяин без детоксикация к каталаза или же пероксидаза, которые могут повредить клетку-хозяина, уменьшив глутатион, повреждение липид мембраны и вызывающие денатурация белка.[6][31] Местный ущерб также может быть результатом лактоферрин приобретение и последующие гидроксильный радикал, супероксид-анион и перекись формирование.[6] Цитотоксические эффекты M. pneumoniae инфекции превращаются в общие симптомы, такие как кашляющий и легкое раздражение это может сохраняться в течение нескольких месяцев после исчезновения инфекции. Местный воспаление и гиперреактивность на инфекцию, вызванную цитокин производство было связано с хроническими состояниями, такими как бронхиальная астма а также было связано с прогрессированием симптомов у людей с кистозный фиброз и ХОБЛ.[6]
Эпидемиология
Заболеваемость не связана с сезоном или географией; однако инфекция, как правило, чаще возникает в летние и осенние месяцы, когда другие респираторные патогены менее распространены. Реинфекция и эпидемия Считается, что циклирование является результатом вариации подтипа адгезина P1.[6] Примерно 40% приобретенных сообществом пневмония связано с M. pneumoniae инфекции, при этом дети и пожилые люди восприимчивый, однако нет личных факторов риска для приобретения M. pneumoniae индуцированная пневмония.[6][33] Передача инфекции из M. pneumoniae может происходить только при тесном контакте и обмене аэрозоли при кашле из-за повышенной восприимчивости клеточная стенка недостаток организма в высыхание. Вспышки из M. pneumoniae инфекции, как правило, происходят в группах людей, находящихся в непосредственной и продолжительной близости, включая школы, учреждения, военные базы и домохозяйства.[6]
Симптомы инфекции
M. pneumoniae как известно, вызывает множество симптомов, таких как первичная атипичная пневмония, трахеобронхит, и заболевание верхних дыхательных путей. Первичная атипичная пневмония - один из самых тяжелых типов проявления, при этом трахеобронхит является наиболее частым симптомом, и еще 15% случаев, обычно взрослых, остаются бессимптомными.[6][33] Симптоматические инфекции, как правило, развиваются в течение нескольких дней, и проявления пневмонии можно спутать с рядом других бактериальных патогенов и состояний, вызывающих пневмонию. Трахеобронхит чаще всего встречается у детей из-за сниженного потенциала иммунной системы, и до 18% инфицированных детей нуждаются в госпитализация.[6] Общие легкие симптомы включают: больное горло, хрипы и кашляющий, высокая температура, Головная боль, ринит, миалгия и чувство беспокойства, при котором интенсивность и продолжительность симптомов могут быть ограничены ранним лечением антибиотики. Редко, M. pneumoniae пневмония приводит к смерти из-за поражения и изъязвление эпителиальной выстилки, отек легких, и облитерирующий бронхиолит. Внелегочные симптомы, такие как аутоиммунные реакции, Центральная нервная система осложнения и дерматологический расстройства были связаны с M. pneumoniae инфекции до 25% случаев.[6]
Диагностика
Диагностика из Mycoplasma pneumoniae инфекции осложняется отсроченным началом симптомы и сходство симптомов с другими легочными заболеваниями. Часто, M. pneumoniae инфекции диагностируются как другие состояния и иногда непатогенный микоплазмы, присутствующие в дыхательных путях, ошибочно принимаются за M. pneumoniae.[6] Исторически диагноз M. pneumoniae заражение производилось на основании наличия простуды агглютинины и способность инфицированного материала уменьшать тетразолий. Причинный диагноз зависит от лаборатория тестирование, однако эти методы более практичны в эпидемиологический исследования, чем в диагностике пациента.[6] Культура тесты редко используются в качестве диагностических инструментов; скорее иммуноблоттинг, иммунофлуоресцентный окрашивание, пробы гемадсорбции, восстановление тетразолия, метаболический тесты на ингибирование, серологический анализы, и полимеразной цепной реакции (ПЦР) используются для диагностики и характеристики бактериальные легочные инфекции.[6] ПЦР - самый быстрый и эффективный способ определения наличия M. pneumoniae, однако процедура не указывает на активность или жизнеспособность присутствующих клеток.[33] Иммуноферментный анализ (EIA) серологические анализы являются наиболее распространенным методом M. pneumoniae обнаружение, используемое в диагностике пациентов из-за низкой стоимости и относительно короткого времени тестирования. Одним из недостатков серологии является то, что требуются жизнеспособные организмы, которые могут преувеличивать тяжесть инфекции.[6] Ни один из этих методов, наряду с другими, не был доступен медицинским работникам в быстрой, эффективной и достаточно недорогой форме для использования в повседневной диагностике, что привело к снижению способности врачей ставить диагноз. M. pneumoniae инфекции.
Лечение и профилактика
Большинство антибиотиков, используемых для лечения M. pneumoniae инфекции нацелены на бактериальные рРНК в рибосомальный комплексы, в том числе макролиды, тетрациклин, кетолиды, и фторхинолон, многие из которых можно вводить перорально.[6][34] Макролиды способны снижать гиперреактивность и защищать эпителиальную выстилку от окислительный и структурные повреждения, однако они способны только подавлять бактерии (бактериостатический ) и не способны вызывать гибель бактериальных клеток.[6][26] Наиболее распространенными макролидами, используемыми для лечения инфицированных детей в Японии, являются: эритромицин и кларитромицин, которые ингибируют синтез бактериального белка путем связывания 23S рРНК.[34] Доказано, что прием антибиотиков снижает продолжительность и интенсивность M. pneumoniae инфекции по сравнению со случаями, оставшимися без лечения. Кроме того, некоторые методы лечения высокими дозами стероидов показали обратное неврологический эффекты у детей с осложненными инфекциями.[6]
Трудность искоренения Mycoplasma pneumoniae инфекции возникают из-за способности бактерии сохраняться в организме человека, а также из-за отсутствия клеточной стенки в M. pneumoniae, что делает несколько антибиотиков, направленных на клеточную стенку бактерий, неэффективными при лечении инфекций.[6] M. pneumoniae поэтому проявляет устойчивость к противомикробным препаратам, таким как β-лактамы, гликопептиды, сульфаниламиды, триметоприм, полимиксины, налидиксовая кислота, и рифампицин.[6][33] Показатели устойчивости к противомикробным препаратам для Mycoplasma pneumoniae были определены в клинических образцах и изолятах, полученных в течение 2011–2012 гг. в Онтарио, Канада. Из 91 M. pneumoniae лекарственно-устойчивые образцы, 11 (12,1%) несли нуклеотидные мутации, связанные с макролид сопротивление в 23S рРНК ген. Ни один из M. pneumoniae образцы были устойчивы к фторхинолоны или же тетрациклины.[35]
Вакцина дизайн для M. pneumoniae был сосредоточен в первую очередь на предотвращении прикрепления клеток-хозяев, что могло бы предотвратить инициирование цитотоксичность и последующие симптомы.[6] На сегодняшний день вакцины, нацеленные на адгезин P1, не показали уменьшения начала инфекции, а некоторые испытания вакцин привели к ухудшению симптомов из-за иммунной системы. сенсибилизация.[6] Недавние эксперименты на мышиных моделях связали этот феномен с сенсибилизацией иммунной системы липидными фрагментами M. pneumoniae липопротеины.[36] Представление о пептиды которые блокируют рецепторы адгезии на поверхности клетки-хозяина, также могут предотвращать прикрепление M. pneumoniae.[28]
Передача Mycoplasma pneumoniae инфекции трудно ограничить из-за нескольких дней заражения до появления симптомов.[37] Отсутствие надлежащих диагностических инструментов и эффективного лечения бактерии также способствует возникновению инфекции.[37] С помощью теория сети, Мейерс и другие. проанализировал передачу M. pneumoniae инфекции и разработали стратегии борьбы на основе созданной модели. Они определили, что когортация пациенты менее эффективны из-за длительного период инкубации, поэтому лучший метод профилактики - ограничить опекун -взаимодействие с пациентами и сокращение перемещения лиц, осуществляющих уход, до нескольких палаты.[37]
Смотрите также
| Внешнее видео | |
|---|---|
Рекомендации
- ^ а б c d е Хейфлик Л., Чанок Р.М. (июнь 1965 г.). «Виды микоплазм человека». Бактериологические обзоры. 29 (2): 185–221. Дои:10.1128 / mmbr.29.2.185-221.1965. ЧВК 441270. PMID 14304038.
- ^ а б c Хейфлик Л. (май 1965 г.). "Виды Mycoplasma (Pplo) человека *, †". Труды Нью-Йоркской академии наук. 27 (7 серия II): 817–27. Дои:10.1111 / j.2164-0947.1965.tb02241.x. PMID 14333465.
- ^ а б Хейфлик Л. (1967). Hayflick L (ред.). Биология микоплазм. Вторая конференция по биологии микоплазм. 143. Летопись Н.Я. акад. наук. С. 5–6.
- ^ а б c Hayflick L, ed. (1969). Mycoplasmatales и L-фаза бактерий. Нью-Йорк: Appleton-Century-Croft s.
- ^ Мармион Б.П. (1990). «Агент Eaton - наука и научное признание: исторический комментарий». Отзывы об инфекционных заболеваниях. 12 (2): 338–53. Дои:10.1093 / Clinids / 12.2.338. PMID 2109871.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай aj ак аль являюсь ан ао ap водный ар в качестве в au средний ау топор Уэйтс КБ, Токингтон Д.Ф. (октябрь 2004 г.). «Mycoplasma pneumoniae и ее роль в качестве патогена для человека». Обзоры клинической микробиологии. 17 (4): 697–728, содержание. Дои:10.1128 / CMR.17.4.697-728.2004. ЧВК 523564. PMID 15489344.
- ^ а б Разин С., Хейфлик Л. (март 2010 г.). «Основные моменты исследования микоплазм - историческая перспектива». Биологические препараты. 38 (2): 183–90. Дои:10.1016 / j.biologicals.2009.11.008. PMID 20149687.
- ^ Хейфлик Л. (1956). Рост организмов, подобных плевропневмонии у человека и птицы, в тканевых культурах и in ovo, а также характеристика инфекционного агента, вызывающего тендовагинит с артритом у кур (Кандидат наук.). Пенсильванский университет.
- ^ Hayflick L, Stinebring WR (январь 1960 г.). «Внутриклеточный рост плевропневмониоподобных организмов (PPLO) в культуре тканей и in ovo». Летопись Нью-Йоркской академии наук. 79 (10): 433–49. Bibcode:1960НЯСА..79..433Х. Дои:10.1111 / j.1749-6632.1960.tb42709.x. PMID 14400338.
- ^ Eaton MD, Meiklejohn G, van Herick W (июнь 1944 г.). «Исследования по этиологии первичной атипичной пневмонии: фильтруемый агент, передающийся хлопковым крысам, хомякам и куриным эмбрионам». Журнал экспериментальной медицины. 79 (6): 649–68. Дои:10.1084 / jem.79.6.649. ЧВК 2135382. PMID 19871393.
- ^ Даджани А.С., Клайд В.А., Денни Ф.В. (июнь 1965 г.). «Экспериментальная инфекция Mycoplasma Pneumoniae (агент Eaton)». Журнал экспериментальной медицины. 121 (6): 1071–86. Дои:10.1084 / jem.121.6.1071. ЧВК 2138014. PMID 14319403.
- ^ Хейфлик Л. (1969). «Фундаментальная биология класса Mollicutes, отряд Mycoplasmatales». В Hayflick L (ред.). Mycoplasmatales и L-фаза бактерий. Нью-Йорк: Appleton-Century-Crofts.
- ^ Хейфлик Л. (1971). «Биология Mycoplasmatales». В Madoff S (ред.). Микоплазмы и L-формы бактерий. Нью-Йорк: Гордон и Брич. Дои:10.1002 / jobm.19720120516.
- ^ а б c Хейфлик Л. (1965). «Тканевые культуры и микоплазмы». Отчеты Техаса по биологии и медицине. 23 (1): 285–303. PMID 5833547.
- ^ Хейфлик Л. (1966). «Роль микоплазм в болезнях человека». Новый Врач. Декабрь: 328–333, 348–350.
- ^ Хейфлик Л. (1972). Микоплазмы как патогены. Симпозиум Ciba Foundation: патогенные микоплазмы. Амстердам: Северная Голландия: Elsevier Excerpta Medica. С. 17–31.
- ^ Хейфлик Л. (1993). «Citation Classic: выделение и идентификация микоплазмы как этиологического агента первичной атипичной пневмонии у людей». Текущее содержание. 4 октября: 8.
- ^ Чанок Р.М., Хейфлик Л., Бариль М.Ф. (январь 1962 г.). «Рост на искусственной среде возбудителя атипичной пневмонии и его идентификация как PPLO». Труды Национальной академии наук Соединенных Штатов Америки. 48 (1): 41–9. Bibcode:1962ПНАС ... 48 ... 41С. Дои:10.1073 / pnas.48.1.41. ЧВК 285494. PMID 13878126.
- ^ а б "Роберт Чанок и агент Eaton". Сеть историй. 8 августа 2012 г.
- ^ а б Шаррер Т. (2007). «Инвертированные микроскопы Leitz, около 1958 г.». Ученый. 21 (3): 96.
- ^ Клинебергер-Нобель Э (1980). Воспоминания (Англ. Ред.). 24/28 Oval Road, Лондон NW1: Academic Press Inc. (London) Ltd. ISBN 0-12-414850-6.CS1 maint: location (связь)
- ^ Чанок Р.М. (май 1963 г.). «Mycoplasma pneumoniae: предлагаемая номенклатура для организма атипичной пневмонии (агент Eaton)». Наука. 140 (3567): 662. Bibcode:1963 г., наука ... 140..662C. Дои:10.1126 / science.140.3567.662. PMID 14020096.
- ^ Эдвард Д.Г., Фройндт Е.А., Чанок Р.М., Фабрикант Дж., Хейфлик Л., Лемке Р.М. и др. (Март 1967). «Рекомендации по номенклатуре отряда Mycoplasmatales». Наука. 155 (3770): 1694–6. Bibcode:1967Научный ... 155.1694E. Дои:10.1126 / science.155.3770.1694. PMID 6020298.
- ^ а б c d е Weisburg WG, Tully JG, Rose DL, Petzel JP, Oyaizu H, Yang D, et al. (Декабрь 1989 г.). «Филогенетический анализ микоплазм: основы их классификации». Журнал бактериологии. 171 (12): 6455–67. Дои:10.1128 / jb.171.12.6455-6467.1989. ЧВК 210534. PMID 2592342.
- ^ а б c d е ж грамм час я j k л м Ромеро-Арройо С.Э., Джордан Дж., Пикок С.Дж., Уилби М.Дж., Фармер М.А., Краузе, округ Колумбия (февраль 1999 г.). «Белок P30 Mycoplasma pneumoniae необходим для соблюдения цитапсиса и связан с правильным развитием клеток». Журнал бактериологии. 181 (4): 1079–87. Дои:10.1128 / JB.181.4.1079-1087.1999. ЧВК 93483. PMID 9973332.
- ^ а б c d Далло С.Ф., Бейсмен Дж. Б. (ноябрь 2000 г.). «Внутриклеточная репликация ДНК и долгосрочное выживание патогенных микоплазм». Микробный патогенез. 29 (5): 301–9. Дои:10.1006 / mpat.2000.0395. PMID 11031124.
- ^ а б c d е ж Водке Ю.А., Пухалка Дж., Ллух-Сенар М., Маркос Дж., Юс Э., Годиньо М. и др. (2013). «Анализ энергетического метаболизма Mycoplasma pneumoniae с помощью метаболического моделирования в масштабе генома». Молекулярная системная биология. 9: 653. Дои:10.1038 / msb.2013.6. ЧВК 3658275. PMID 23549481.
- ^ а б c d е ж Драсбек М., Кристиансен Г., Драсбек К.Р., Холм А., Биркелунд С. (ноябрь 2007 г.). «Взаимодействие между белком P1 Mycoplasma pneumoniae и рецепторами на клетках HEp-2». Микробиология. 153 (Pt 11): 3791–3799. Дои:10.1099 / mic.0.2007 / 010736-0. PMID 17975088.
- ^ а б c d е Бейсмен Дж. Б., Коул Р. М., Краузе, округ Колумбия, Лейт, Д. К. (сентябрь 1982 г.). «Молекулярная основа цитадсорбции Mycoplasma pneumoniae». Журнал бактериологии. 151 (3): 1514–22. Дои:10.1128 / JB.151.3.1514-1522.1982. ЧВК 220433. PMID 6809731.
- ^ а б c Хан Т.В., Уилби М.Дж., Краузе округ Колумбия (март 1998 г.). «HMW1 необходим для доставки цитадгезина P1 к органелле прикрепления у Mycoplasma pneumoniae». Журнал бактериологии. 180 (5): 1270–6. Дои:10.1128 / JB.180.5.1270-1276.1998. ЧВК 107017. PMID 9495768.
- ^ а б Собеславский О., Прескотт Б., Чанок Р.М. (сентябрь 1968 г.). «Адсорбция Mycoplasma pneumoniae на рецепторах нейраминовой кислоты различных клеток и возможная роль в вирулентности». Журнал бактериологии. 96 (3): 695–705. Дои:10.1128 / JB.96.3.695-705.1968. ЧВК 252361. PMID 4183967.
- ^ «CDC Mycoplasma Pneumoniae». CDC. CDC. Получено 23 сентября 2015.
- ^ а б c d Daxboeck F, Krause R, Wenisch C (апрель 2003 г.). «Лабораторная диагностика инфекции Mycoplasma pneumoniae». Клиническая микробиология и инфекции. 9 (4): 263–73. Дои:10.1046 / j.1469-0691.2003.00590.x. PMID 12667235.
- ^ а б Мацуока М., Нарита М., Окадзаки Н., Охя Х., Ямадзаки Т., Оучи К. и др. (Декабрь 2004 г.). «Характеристика и молекулярный анализ клинических изолятов Mycoplasma pneumoniae, устойчивых к макролидам, полученных в Японии». Противомикробные препараты и химиотерапия. 48 (12): 4624–30. Дои:10.1128 / AAC.48.12.4624-4630.2004. ЧВК 529214. PMID 15561835.
- ^ Eshaghi A, Memari N, Tang P, Olsha R, Farrell DJ, Low DE и др. (2013). «Устойчивые к макролидам Mycoplasma pneumoniae у людей, Онтарио, Канада, 2010-2011 гг.». Возникающие инфекционные заболевания. 19 (9). Дои:10.3201 / eid1909.121466. ЧВК 3810904. PMID 23968896.
- ^ Мара А.Б., Гавитт Т.Д., Тулман Э.Р., Гири С.Дж., Щепанек С.М. (2020-04-08). «Липопротеины Mycoplasma pneumoniae являются причинным фактором вакцино-усиленного заболевания». NPJ вакцины. 5 (1): 31. Дои:10.1038 / с41541-020-0181-х. ЧВК 7142147. PMID 32284882.
- ^ а б c Ансель Мейерс Л., Ньюман М.Э., Мартин М., Шраг С. (февраль 2003 г.). «Применение сетевой теории к эпидемиям: меры борьбы со вспышками Mycoplasma pneumoniae». Возникающие инфекционные заболевания. 9 (2): 204–10. Дои:10.3201 / eid0902.020188. ЧВК 3369603. PMID 12603991.
Эта статья включает текст, являющийся общественным достоянием, из процитированного CDC.
дальнейшее чтение
- Бейсмен Дж. Б., Редди С. П., Далло С.Ф. (октябрь 1996 г.). «Взаимодействие между поверхностными белками микоплазмы, клетками дыхательных путей и разнообразными проявлениями инфекций человека, опосредованных микоплазмами». Американский журнал респираторной медицины и реанимации. 154 (4 ч. 2): S137-44. Дои:10.1164 / ajrccm / 154.4_Pt_2.S137. PMID 8876532.
- Разин С., Йогев Д., Наот Ю. (декабрь 1998 г.). «Молекулярная биология и патогенность микоплазм». Обзоры микробиологии и молекулярной биологии. 62 (4): 1094–156. Дои:10.1128 / MMBR.62.4.1094-1156.1998. ЧВК 98941. PMID 9841667.
- Кашьяп С., Саркар М. (апрель 2010 г.). «Микоплазменная пневмония: клинические особенности и лечение». Легкое Индия. 27 (2): 75–85. Дои:10.4103/0970-2113.63611. ЧВК 2893430. PMID 20616940.
- Нарита М (сентябрь 2009 г.). «Патогенез неврологических проявлений инфекции Mycoplasma pneumoniae». Детская неврология. 41 (3): 159–66. Дои:10.1016 / j.pediatrneurol.2009.04.012. PMID 19664529.
- Ферверда А., Молл Х.А., де Грот Р. (август 2001 г.). «Инфекции дыхательных путей, вызываемые Mycoplasma pneumoniae у детей: обзор диагностических и лечебных мероприятий». Европейский журнал педиатрии. 160 (8): 483–91. Дои:10.1007 / s004310100775. PMID 11548186.
- Эспозито С., Дрогетти Р., Бозис С., Клаут Л., Маркизио П., Принципи Н. (август 2002 г.). «Секреция цитокинов у детей с острой инфекцией Mycoplasma pneumoniae и хрипом». Детская пульмонология. 34 (2): 122–7. Дои:10.1002 / ppul.10139. PMID 12112778.
- Риос А.М., Мехиас А., Чавес-Буэно С., Фонсека-Атен М., Кац К., Хатфилд Дж. И др. (Август 2004 г.). «Влияние терапии цетромицином (ABT-773) на микробиологические, гистологические, иммунологические и респираторные показатели в мышиной модели инфекции нижних дыхательных путей Mycoplasma pneumoniae». Противомикробные препараты и химиотерапия. 48 (8): 2897–904. Дои:10.1128 / AAC.48.8.2897-2904.2004. ЧВК 478543. PMID 15273098.
- См. Также комментарии Хейфлика к книге Мередит Вадман «Гонка за вакцинами: наука, политика и человеческая цена победы над болезнью», 2017 г. Ошибки в книге «Гонка вакцин»
