Оксазиридин - Oxaziridine
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Оксазиридин | |
| Систематическое название ИЮПАК 1-окса-2-азациклопропан | |
| Другие имена Оксаазиридин[1] Оксазациклопропан | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Свойства | |
| CЧАС3NО | |
| Молярная масса | 45.041 г · моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |

An оксазиридин является органическая молекула который имеет трехчленный гетероцикл содержащие кислород, азот и углерод. В своем наиболее широком применении оксазиридины являются промежуточными продуктами в промышленном производстве гидразин. Производные оксазиридина также используются в качестве специализированных реагентов в органической химии для различных окислений, включая альфа-гидроксилирование енолатов, эпоксидирование и азиридинирование олефинов и другие реакции переноса гетероатомов. Оксазиридины также служат предшественниками амидов и участвуют в [3 + 2] циклоприсоединениях с различными гетерокумуленами с образованием замещенных пятичленных гетероциклов. Хиральные производные оксазиридина осуществляют асимметричный перенос кислорода к прохиральным енолятам, а также к другим субстратам. Некоторые оксазиридины также обладают свойством высокого барьера для инверсии азота, что делает возможным хиральность в азотном центре.
История
О производных оксазиридина впервые сообщили в середине 1950-х гг. Эммонс[2] а затем Кримм[3] и Хорнер и Юргенс.[4] В то время как кислород и азот обычно действуют как нуклеофилы из-за их высокого электроотрицательность, оксазиридины позволяют электрофильный перенос обоих гетероатомов. Эта необычная реакционная способность обусловлена наличием сильно напряженного трехчленного кольца и относительно слабой связи N-O. Нуклеофилы имеют тенденцию атаковать азиридиновый азот, когда азотный заместитель мал (R1= H), и у атома кислорода, когда у заместителя азота больше стерическая масса. Необычная электроника оксазиридиновой системы может быть использована для выполнения ряда реакций переноса кислорода и азота, включая, но не ограничиваясь: α-гидроксилирование енолирует, эпоксидирование алкенов, селективное окисление сульфиды и селениды, аминирование из N-нуклеофилы и N-ациламидирование.
В перекисный процесс для промышленного производства гидразин за счет окисления аммиак с участием пероксид водорода в присутствии кетонов был разработан в начале 1970-х годов.[5][6]
Хиральный камфорсульфонилоксазиридины оказались полезными в синтезе сложных продуктов, таких как таксол, который продается как химиотерапевтический агент. Оба Общий синтез таксола Холтона и Полный синтез таксола Вендера обладают асимметричным α-гидроксилированием камфорсульфонилоксазиридином.
Синтез
N-H, N-алкил, N-арилоксазиридины
Двумя основными подходами к синтезу N-H, N-алкил и N-арилоксазиридинов являются окисление имины с участием перкислоты (А) и аминирование карбонилы (В).

Кроме того, окисление хиральных иминов и окисление иминов хиральными надкислотами может давать энантиочистые оксазиридины. Некоторые оксазиридины обладают уникальным свойством конфигурационно стабильных атомов азота при комнатной температуре из-за барьера инверсии от 100 до 130 кДж / моль. Сообщается о энантиочистых оксазиридинах, стереохимия которых полностью обусловлена конфигурационно стабильным азотом.[7]
N-сульфонилоксазиридины
В конце 1970-х - начале 1980-х гг. Франклин А. Дэвис синтезировал первый N-сульфонилоксазиридины, которые действуют исключительно как реагенты переноса кислорода, и сегодня являются наиболее часто используемым классом оксазиридинов.[8] Первоначально синтезированный с mCPBA и катализатор межфазного переноса бензилтриметиламмоний хлорид, улучшенный синтез с использованием оксон как окислитель сейчас наиболее распространен.[9]
Сегодня используется много N-сульфонилоксазиридинов, каждый из которых обладает немного разными свойствами и реакционной способностью. Эти реагенты сведены в таблицу ниже.[10][11][12][13][14][15][16][17][18]

Перфторированные оксазиридины
С сильным отводом электронов перфторалкильные заместители, оксазиридины проявляют реактивность, более близкую к реакционной способности диоксираны чем типичные оксазиридины.[19] В частности, перфторалкилоксазиридины гидроксилируют определенные связи C-H с высокой селективностью. Перфторированные оксазиридины могут быть синтезированы путем воздействия на перфторированный имин перфторметилфторкарбонилпероксидом и фторидом металла, которые действуют как поглотитель HF.[19]

Реакции
Производство гидразина
Оксазиридины являются промежуточными продуктами в перекисный процесс для производства гидразин. Многие миллионы килограммов гидразина производятся ежегодно этим методом, который включает стадию, на которой аммиак окисляется в присутствии метилэтилкетон чтобы дать оксазиридину:[20]
- Me (Et) C = O + NH3 + H2О2 → Me (Et) CONH + H2О
На последующих этапах оксазиридин превращается в гидразон, который немедленно превращается в гидразин:
- Me (Et) CONH + NH3 → Me (Et) C = NNH2 + H2О
Перенос кислорода
α-гидроксилирование енолятов
α-гидроксикетоны или ацилоины, являются важными синтетическими мотивами, присутствующими во многих натуральных продуктах. α-Гидроксикетоны были синтезированы многими способами, включая восстановление α-дикетонов, замещение гидроксила уходящей группы и прямое окисление енолята. Оксодипероксимолибден (пиридин) - (триамид гексаметилфосфорной кислоты) (MoOPH) и N-сульфонилоксазиридины являются наиболее распространенными электрофильными источниками кислорода, используемыми в этом процессе. Одно из преимуществ использования N-сульфонилоксазиридинов заключается в том, что почти всегда наблюдается более высокая хиральная индукция по сравнению с MoOPH и другими окислителями.[21] Высокая доходность (77–91%) и доктор (95: 5 - 99: 1) сообщаются для α-гидроксилирования с Хиральный вспомогательный элемент Эванса с участием N-сульфонилоксазиридин как электрофил.[21] Хиральная индукция была продемонстрирована для многих других хиральных кетонов и кетонов с хиральные вспомогательные вещества, в том числе SAMP и RAMP.[10]

Сообщается об обширной работе по асимметричному гидроксилированию прохиральных енолятов производными камфорсульфонилоксазиридина с достижением от умеренного до высокого энантиомерный избыток.[13] Общепринятое предлагаемое переходное состояние, которое оправдывает этот стереохимический результат, включает открытое переходное состояние, в котором стерическая масса R1 определяет лицо подхода.[10]

В некоторых случаях селективность некоторых гидроксилирований может быть значительно улучшена путем добавления координирующих групп альфа к оксазиридиновому кольцу в виде оксазиридинов. 3b и 3c в таблице выше.[16] В этих случаях предполагается, что реакция протекает через закрытое переходное состояние, в котором оксианион металла стабилизируется с помощью хелатирование из сульфатных и координационных групп на камфорном скелете.[10]

α-Гидроксилирование оксазиридинами широко применяется в полном синтезе. Это ключевой шаг как в Общий синтез таксола Холтона и Полный синтез таксола Вендера. Кроме того, Форсайт реализовал преобразование в своем синтезе C3-C14 (замещенный 1,7-диоксаспиро [5.5] ундец-3-ен) системы окадаиновая кислота.[22]

Эпоксидирование алкенов
Эпоксидирование алкенов является обычной реакцией, потому что эпоксиды можно дериватизировать несколькими полезными способами. Обычно лабораторное эпоксидирование проводят с mCPBA или другими надкислотами. Было обнаружено, что оксазиридины полезны для образования высокочувствительных к кислоте эпоксидов.[7] (-) - Хетоминин был синтезирован путем эпоксидирования оксазиридина на поздней стадии превращения, как показано ниже.[23]

Еще одно преобразование высокой синтетической полезности: асимметричный эпоксидирование. Существует ряд асимметричных эпоксидных покрытий: Эпоксидирование по методу Sharpless, то Эпоксидирование Якобсена-Кацуки, а Эпоксидирование Хулиа-Колонна. Эти методы требуют определенных функций для достижения селективности. Эпоксидирование по Шарплесу специфично для аллильных спиртов, эпоксидирование Якобсена требует СНГ-дизамещенные арилалкены, и для эпоксидирования Julia требуется α-β ненасыщенные кетоны. Хиральные оксазиридины действуют стереоспецифично на многих нефункционализированных алкенах.[7] Возможно даже каталитическое стереоспецифическое эпоксидирование в хиральном звене оксазиридина. Может потребоваться дальнейшее исследование этих реакций до того, как уровни энантиометрического избытка станут практичными для крупномасштабного синтеза. Lusinichi et al. исследовали асимметричное эпоксидирование хиральной солью оксазиридиния с использованием оксона в качестве стехиометрического окислителя, показанного ниже.[24]

Гидроксилирование неактивированных углеводородов
Известно, что перфторированные оксазиридины гидроксилируют неактивированные углеводороды с замечательной регио- и диастереоспецифичностью.[19] Это очень желанная трансформация, и подобная реакционная способность и специфичность редко соперничают, особенно с учетом неметаллической природы окислителя. Перфторированные оксазиридины обладают высокой селективностью к высшее водороды. Гидроксилирование первичных углеродов и дигидроксилирование соединения с двумя окисляемыми центрами никогда не наблюдались. Сохранение стереохимии очень высокое, часто 95-98%. (сохранение стереохимии может быть дополнительно усилено добавлением фторидной соли).[25]

Перенос азота
Оксазиридины с незамещенными или ацилированными атомами азота способны переносить атом азота, хотя этой реакционной способности уделяется значительно меньше внимания.[26]
Аминация N-нуклеофилы
Аминирование нуклеофилов N-Незамещенные оксазиридины весьма универсальны в отношении множества возможных нуклеофилов и соответствующих продуктов. Гидразины могут быть получены аминированием вторичных или третичных аминов, гидроксиламин и тиогидроксамины могут быть образованы из их соответствующих спирты и тиолы, сульфимиды могут образовываться из тиоэфиры и α-аминокетоны могут быть образованы атакой соответствующих енолятов.[27]
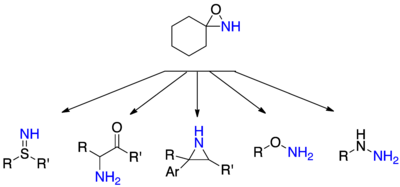
N-ациламидирование
Перенос ацилированных аминов сложнее, чем перенос незамещенных аминов, хотя, в отличие от переноса амина оксазиридинами, нет альтернативных методов, которые непосредственно переносят ацилированные амины.[27] Перенос ациламина в основном осуществляли с использованием аминов и гидразинов в качестве нуклеофилов. Было успешно выполнено очень мало случаев переноса ацилированных атомов азота в углеродные нуклеофилы, хотя некоторые из них существуют в литературе.[27]

Перестановки
Было обнаружено, что оксазиридины претерпевают реакции перегруппировки через радикальный механизм при облучении УФ-светом или в присутствии одного реагента переноса электрона, такого как Cuя. спироциловый оксазиридины подвергаются расширению цикла до соответствующих лактам.[28] Мигрирующий заместитель определяется стереоэлектронный эффект где группа, трансформированная в неподеленную пару по азоту, всегда будет преобладающим продуктом миграции.[29] В свете этого эффекта можно воспользоваться преимуществом хирального азота из-за высокого барьера инверсии, чтобы направить перегруппировку. Это явление демонстрируется наблюдаемыми селективностями в перегруппировках ниже. В перестановке слева термодинамически наблюдается исключительно неблагоприятный продукт, тогда как в реакции справа предпочтение отдается продукту, полученному из менее стабильного радикального промежуточного соединения.[28]

Обе использует эту перестановку как ключевой шаг в своем синтезе (+) -йохимбин,[28] натуральное лекарство, классифицированное Национальные институты здравоохранения США как возможно эффективен при лечении Эректильная дисфункция и сексуальные проблемы, вызванные селективные ингибиторы обратного захвата серотонина.[30]

Также примечательно, что оксазиридины термически перегруппируются в нитроны. Цис-транс селективность полученного нитрона низкая, однако выходы от хороших до отличных. Считается, что некоторые оксазиридины со временем рацемизируются через промежуточный нитрон.[7]

Циклоприсоединения с гетерокумуленами
Оксазиридины подвергаются циклоприсоединение реакции с гетерокумулены чтобы получить ряд уникальных пятичленных гетероциклов, как показано на рисунке ниже. Эта реакционная способность обусловлена напряженным трехчленным кольцом и слабой связью N-O.[7]

использованная литература
- ^ «CID 15817734 - Государственная химическая база данных PubChem». Проект PubChem. США: Национальный центр биотехнологической информации.
- ^ Эммонс, В. Д. (1956). «Синтез оксазиранов». Варенье. Chem. Soc. 78 (23): 6208. Дои:10.1021 / ja01604a072.
- ^ Кримм, Генрих (1958). «Убер Изонитрон». Chemische Berichte (на немецком). 91 (5): 1057–1068. Дои:10.1002 / cber.19580910532. ISSN 0009-2940.
- ^ Хорнер, Л .; Юргенс, Э. (1957). "Notiz Über Darstellung und Eigenschaften Einiger Isonitrone (Oxazirane)". Chemische Berichte. 90 (10): 2184. Дои:10.1002 / cber.19570901010.
- ^ США 3972878, Ширманн, Жан-Пьер; Жан Комбру и Серж Ивон Делаварен, "Метод получения азинов и гидразонов", выпущенный 1976-08-03, передан Produits Chimiques Ugine Kuhlmann. США 3978049, Ширманн, Жан-Пьер; Пьер Теллье и Анри Матаис и др., "Процесс получения соединений гидразина", выпущенный 31 августа 1976 г., передан Produits Chimiques Ugine Kuhlmann..
- ^ США 4724133, Ширманн, Жан-Пьер; Жан Комбру и Серж Й. Делаварен, «Приготовление концентрированного водного раствора гидразингидрата», выпущенный 9 февраля 1988 г., передан Atochem.
- ^ а б c d е Дэвис, Ф. А .; Шеппард А.С. (1989). «Применение оксазиридинов в органическом синтезе». Тетраэдр. 45 (18): 5703. Дои:10.1016 / с0040-4020 (01) 89102-х.
- ^ Дэвис, Ф. А .; Стрингер, О. Д. (1982). «Химия оксазиридинов. 2. Улучшенный синтез 2-сульфонилоксазиридинов». Журнал органической химии. 47 (9): 1774. Дои:10.1021 / jo00348a039.
- ^ Дэвис, Ф. А .; Chattopadhyay, S .; Towson, J. C .; Lal, S .; Редди, Т. (1988). «Химия оксазиридинов. 9. Синтез 2-сульфонил- и 2-сульфамилоксазиридинов с использованием пероксимоносульфата (оксона) калия». Журнал органической химии. 53 (9): 2087. Дои:10.1021 / jo00244a043.
- ^ а б c d Дэвис, Ф. А .; Чен, Б.С. (1992). «Асимметричное гидроксилирование енолятов N-сульфонилоксазиридинами». Chem. Ред. 92 (5): 919. Дои:10.1021 / cr00013a008.
- ^ Дэвис, Ф. А .; Jenkins, R.H .; Awad, S. B .; Стрингер, О.Д .; Watson, W. H .; Галлой, Дж. (1982). «Химия оксазиридинов. 3. Асимметричное окисление сероорганических соединений с использованием хиральных 2-сульфонилоксазиридинов». Журнал Американского химического общества. 104 (20): 5412. Дои:10.1021 / ja00384a028.
- ^ Дэвис, Ф. А .; Reddy, R.T .; McCauley, J.P .; Przeslawski, R.M .; Harakal, M.E .; Кэрролл, П. Дж. (1991). «Химия оксазиридинов. 15. Асимметрические окисления с использованием 3-замещенных 1,2-бензизотиазол-1,1-диоксидов». Журнал органической химии. 56 (2): 809. Дои:10.1021 / jo00002a056.
- ^ а б Towson, J. C .; Weismiller, M.C .; Lal, S. G .; Sheppard, A.C .; Дэвис, Ф.А. (1990). «(+) - (2R, 8aS) -10- (КАМФОРИЛСУЛЬФОНИЛ) ОКСАЗИРИДИН». Орг. Synth. 69: 158. Дои:10.15227 / orgsyn.069.0158.
- ^ Дэвис, Ф. А .; Towson, J. C .; Weismiller, M.C .; Lal, S .; Кэрролл, П. Дж. (1988). «Химия оксазиридинов. 11. (Камфорилсульфонил) оксазиридин: синтез и свойства». Журнал Американского химического общества. 110 (25): 8477. Дои:10.1021 / ja00233a025.
- ^ Bach, R.D .; Coddens, B.A .; McDouall, J. J. W .; Schlegel, H.B .; Дэвис, Ф.А. (1990). «Механизм переноса кислорода от оксазиридина к сульфиду и сульфоксиду: теоретическое исследование». Журнал органической химии. 55 (10): 3325. Дои:10.1021 / jo00297a062.
- ^ а б Дэвис, Ф. А .; Кумар, А .; Чен, Б.С. (1991). «Химия оксазиридинов. 16. Короткий, высокоэнантиоселективный синтез сегментов AB-кольца γ-родомиционона и α-цитромицинона с использованием (+) - [(8,8-диметоксикамфорил) сульфонил] оксазиридина». Журнал органической химии. 56 (3): 1143. Дои:10.1021 / jo00003a042.
- ^ Дэвис, Ф. А .; Weismiller, M.C .; Lal, G. S .; Chen, B.C .; Пржеславский, Р. М. (1989). «(Камфорилсульфонил) иминдианион в синтезе новых оптически чистых производных (камфорилсульфонил) оксазиридина». Буквы Тетраэдра. 30 (13): 1613. Дои:10.1016 / с0040-4039 (00) 99534-0.
- ^ Chen, B.C .; Weismiller, M.C .; Дэвис, Ф. А .; Boschelli, D .; Empfield, J. R .; Смит, А. Б. (1991). «Энантиоселективный синтез (+) - кьеллманианона». Тетраэдр. 47 (2): 173–82. Дои:10.1016 / S0040-4020 (01) 80914-5.
- ^ а б c Петров В.А., Реснати Г. (1996). «Полифторированные оксазиридины: синтез и реакционная способность». Химические обзоры. 96 (5): 1809. Дои:10.1021 / cr941146h.
- ^ Жан-Пьер Ширманн, Поль Бурдодук «Гидразин» в Энциклопедии промышленной химии Ульмана, Wiley-VCH, Weinheim, 2002. Дои:10.1002 / 14356007.a13_177.
- ^ а б Эванс, Д. А .; Моррисси, М. М .; Доров Р. Л. (1985). «Асимметрическая оксигенация енолятов хиральных имидов. Общий подход к синтезу энантиомерно чистых синтонов альфа-гидроксикарбоновой кислоты». Журнал Американского химического общества. 107 (14): 4346. Дои:10.1021 / ja00300a054.
- ^ Дунай, Эми Б.; Форсайт, Крейг Дж. (1999). «Сокращенный синтез системы C3-C14 (замещенный 1,7-диоксаспиро [5.5] ундец-3-ен) окадаиновой кислоты». Орг. Lett. 1 (3): 451. Дои:10.1021 / ol9906615.
- ^ Мальгезини, Беатрис; Форте, Барбара; Борги, Даниэла; Куартьери, Франческа; Дженнари, Чезаре; Папео, Джанлука (2009). «Непосредственный тотальный синтез (-) - хетоминина». Chem. Евро. Дж. 15 (32): 7922. Дои:10.1002 / chem.200900793.
- ^ Бохе, Луис; Анке, Жиль; Лусинчи, Мари; Лусинчи, Ксавьер (1993). «Стереоспецифический синтез новой хиральной соли оксазиридиния». Буквы Тетраэдра. 34 (45): 7271. Дои:10.1016 / S0040-4039 (00) 79306-3.
- ^ Арноне, Альберто; Фолетто, Стефания; Метранголо, Пьеранджело; Прегнолато, Массимо; Реснати, Джузеппе (1999). «Высокоэнантиоспецифическая оксифункционализация неактивированных углеводородных сайтов перфтор-цис-2-н-бутил-3-н-пропилоксазиридином». Орг. Lett. 1 (2): 281. Дои:10.1021 / ol990594e.
- ^ Schmitz, E .; Ом, Р. (1964). "Изомер оксим мит дрейрингструктура". Chem. Бер. 97 (9): 2521. Дои:10.1002 / cber.19640970916.
- ^ а б c Andreae, S .; Шмитц, Э. (1991). "ХимИнформ Реферат: Электрофильные аминации оксазиридинами". ХимИнформ. 22 (46): 327. Дои:10.1002 / чин.199146339.
- ^ а б c Обе, Джеффри (1997). «Оксизиридиновые перегруппировки в асимметричном синтезе». Обзоры химического общества. 26 (4): 269. Дои:10.1039 / CS9972600269.
- ^ Латте, Арманд; Оливерос, Эстер; Ривьер, Моник; Белжек, Чеслав; Мостович, Данута; Абрамский, Войцех; Пиччинни-Леопарди, Карла; Жермен, Габриэль; Ван Мерсше, Морис (1982). «Фотохимическая и термическая перегруппировка оксазиридинов. Экспериментальные данные в поддержку теории стереоэлектронного управления». Журнал Американского химического общества. 104 (14): 3929. Дои:10.1021 / ja00378a024.
- ^ «Йохимбе: добавки MedlinePlus». nlm.nih.gov. 19 ноября 2010 г.. Получено 13 декабря, 2010.

