Стереоэлектронный эффект - Stereoelectronic effect
Эта статья требует внимания эксперта по предмету. Конкретная проблема: Многочисленные ошибки в примерах. (Декабрь 2019 г.) |
В химия, в первую очередь органический и вычислительная химия, а стереоэлектронный эффект[1] влияет на молекулярная геометрия, реактивность, или физические свойства из-за пространственных отношений в молекулы ' электронная структура, в частности, взаимодействие между атомный и / или молекулярные орбитали.[2] Другими словами, стереоэлектронные эффекты можно также определить как геометрические ограничения, налагаемые на основные и / или переходные состояния молекул, которые возникают из соображений перекрытия орбиталей.[3] Таким образом, стереоэлектронный эффект объясняет конкретное молекулярное свойство или реакционную способность, вызывая стабилизирующие или дестабилизирующие взаимодействия, которые зависят от относительной ориентации электронов (связывающих или несвязанных) в пространстве.[4]
Основанный на нескольких общих принципах, которые определяют взаимодействие орбиталей, стереоэлектронный эффект, наряду со стерическим эффектом, индуктивным эффектом, эффектом растворителя, мезомерным эффектом и ароматичностью, является важным типом объяснения наблюдаемых закономерностей селективности, реакционной способности и стабильности в органическая химия. Несмотря на относительно простые предпосылки, стереоэлектронные эффекты часто объясняют противоречивые или неожиданные наблюдения. В результате стереоэлектронные факторы теперь широко рассматриваются и используются при разработке новой органической методологии и синтез сложных мишеней. Изучение стереоэлектронных эффектов также вошло в сферу биохимия и фармацевтическая химия в былые времена.
Стереоэлектронный эффект обычно включает стабилизирующее донорно-акцепторное (т.е. заполненное-пустое, 2-электронное 2-орбитальное) взаимодействие. Донор обычно представляет собой более высокую связь или несвязывающая орбиталь а акцептор - часто низкорасположенный разрыхляющая орбиталь как показано на схеме ниже. По возможности, если этот стереоэлектронный эффект должен быть благоприятным, донорно-акцепторные орбитали должны иметь (1) небольшую запрещенную зону и (2) быть геометрически хорошо расположенными для взаимодействия. В частности, это означает, что формы донорных и акцепторных орбиталей (включая симметрию π или σ и размер взаимодействующих лепестков) должны быть хорошо согласованы для взаимодействия; ан антиперипланарный ориентация особенно благоприятна. Некоторые авторы требуют стабилизации стереоэлектронных эффектов.[1] Однако дестабилизирующие взаимодействия донор-донор (т.е. заполненные, 4-электронно-2-орбитальные) взаимодействия иногда вызываются и также иногда упоминаются как стереоэлектронные эффекты, хотя такие эффекты трудно отличить от обычного стерического отталкивания.[3][5]
Важные явления, в которых стереоэлектронные эффекты и выравнивание орбиты могут играть важную роль (или даже могут быть доминирующими), включают: аномерный эффект и сверхсопряжение.[5]
Период, термин стереоэлектронный эффект не следует неправильно использовать для обозначения простой комбинации стерических и электронных эффектов.
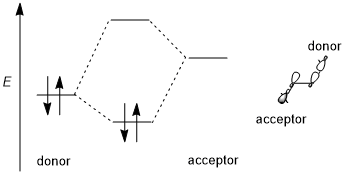
Тренд разных орбиталей
Возьмите простейший СН2X – CH3 система в качестве примера; донорная орбиталь - σ (C – H) орбиталь, а акцептор - σ * (C – X). При переходе от фтор к хлор, затем к бром, электроотрицательность галоген и уровень энергии орбиталей σ * (C – X) уменьшается.[6] Следовательно, общую тенденцию акцепторов можно суммировать следующим образом: π * (C = O)> σ * (C – Hal)> σ * (C – O)> σ * (C – N)> σ * (C – C ), σ * (C – H). Для донорных орбиталей несвязывающие орбитали или неподеленные пары обычно более эффективны, чем связывающие орбитали из-за высоких уровней энергии. Кроме того, в отличие от акцепторов, донорные орбитали требуют менее поляризованных связей. Таким образом, общие тенденции для донорных орбиталей будут следующими: n (N)> n (O)> σ (C – C), σ (C – H)> σ (C – N)> σ (C – O)> σ (C – S)> σ (C – Hal).[5]

В отдельных случаях стереоэлектронный эффект может быть направленным. Радиус сера намного больше, чем радиус углерод и кислород. Таким образом, различия в расстояниях связей C – S создают значительно усиленную разницу в двух стереоэлектронных эффектах в 1,3-Дитиан (σ (C – H) → σ * (C – S)), чем в 1,3-диоксан (σ (C – H) → σ * (C – O)).[6] Различия между связями C – C и C – S, показанные ниже, вызывают значительную разницу в расстояниях между C – S и двумя связями C – H. Чем короче разница, тем лучше взаимодействие и сильнее стереоэлектронный эффект.[6]

Влияние на стабильность
Если есть электроположительный заместитель (например, –SiR3, –SnR3, –HgR и др.) В β-положении карбокатион, положительный заряд может быть стабилизирован, что также в значительной степени связано со стереоэлектронным эффектом (проиллюстрировано ниже на примере –SiR3). Ориентация двух взаимодействующих орбиталей может иметь существенное влияние на эффект стабилизации (σ (C – Si) → пустая p-орбиталь), где антиперипланарный (180 °)> перпендикулярный (90 °)> синх. (0 °).[7]
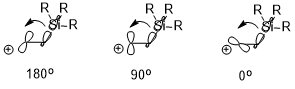
Влияние на экстерьер
Эффект Гоша
Одним из структурных последствий ациклических систем из-за стереоэлектронного эффекта является безвкусный эффект.[8] В 1,2-дифторэтан Несмотря на стерическое столкновение, предпочтительной конформацией является гош, потому что σ (C – H) - хороший донор, а σ * (C – F) - хороший акцептор и стереоэлектронный эффект (σ (C – H) → σ * (C – F)) требует, чтобы минимум энергии был гош, а не анти.[9]

Этот грубый эффект имеет огромное значение для биохимических исследований. В (2С, 4Р) -4-гидроксипролиновый фрагмент, гош-взаимодействие способствует конформеру, который может избирательно связываться с активным сайтом pVHL, доменом в коллаген, одно из самых распространенных животных белок структур и может привести к протеасомной деградации субъединицы HIF-α.[10]

Специальные эффекты заместителя фтора
Стереоэлектронные эффекты могут иметь значительное влияние на фармацевтические исследования. Как правило, замена водород фтором можно рассматривать как способ настройки как гидрофобность и метаболическая стабильность кандидата в лекарство. Более того, он может оказывать сильное влияние на конформации, часто из-за стереоэлектронных эффектов, в дополнение к нормальным стерическим эффектам, возникающим из-за большего размера атома фтора. Например, геометрия основного состояния анизола (метоксибензола) и (трифторметокси) бензола резко различается. В анизол, то метильная группа предпочитает быть компланарным фенильная группа, в то время как (трифторметокси) бензол предпочитает геометрию, в которой [C (арил) –C (арил) –O – C (F3)] двугранный угол составляет около 90 °. Другими словами, O – CF3 связь перпендикулярна плоскости фенильной группы.[11]

Дальнейшие исследования показывают, что даже для одного или двух атомов водорода в метильной группе, заменяемых атомом фтора, искажение в структуре также может быть значительным, поскольку [C (арил) –C (арил) –O – C ( ЧАС2F)] двугранный угол в структуре с минимальной энергией составляет около 24 °, а [C (арил) –C (арил) –O – C (HF2)] двугранный угол 33 °.[11]
Влияние на селективность реакции
Восстановительные циклизации
Хотя разница в энергии между копланарным анизолом и его изомер достаточно велико, вращение между O – CH3 связь становится выгодной, когда электронные свойства метокси группа на ароматические кольца необходимо изменить, чтобы стабилизировать необычное промежуточное или переходное состояние. В следующей реакции региоселективность может быть объяснена как вращение связи O – C вне плоскости, которое изменяет метоксигруппу с донорной группы в плоскости на группу акцептора вне плоскости.[12]

Промежуточным продуктом вышеуказанной реакции является дианион, а стереоэлектронный эффект, который стабилизирует этот промежуточный продукт по сравнению с другим, заключается в том, что анионный заряд в пара-положении может делокализоваться на атом кислорода через орбитальное взаимодействие: π (бензол) → σ * (O – CH3).[12]
Гидрирование
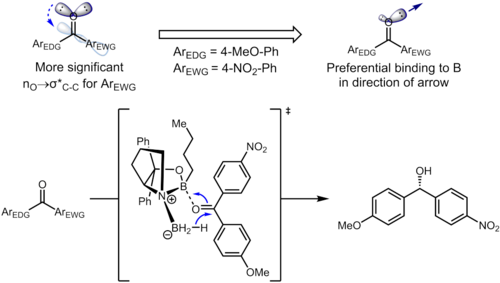
Даже удаленные заместители на бензольное кольцо может влиять на электронную плотность ароматического кольца и, в свою очередь, влиять на селективность. При гидрировании кетоны с помощью Катализаторы CBS, кетон координируется с бор атом с неподеленной парой на атоме кислорода. В следующем примере индуктивное влияние заместителей может привести к дифференциации двух sp2 неподеленные пары на атоме кислорода.[13]
Соответствующим стереоэлектронным взаимодействием в исходном материале является nО → σ * (Cкарбонил–Cарил) взаимодействие. Электроноакцепторный заместитель на бензольном кольце истощает электронную плотность на ароматическом кольце и, таким образом, делает σ * (Cкарбонил–Cарил (нитро)) орбитали лучший акцептор, чем σ * (Cкарбонил–Cарил (метокси)). Эти два стереоэлектронных взаимодействия используют разные неподеленные пары на атоме кислорода (одна антиперипланарная к рассматриваемому σ * для каждого из них), что приводит к образованию неподеленных пар с различной электронной плотностью. В частности, повышенное истощение электронной плотности от неподеленной пары, антиперипланарной, к 4-нитрофенильной группе, приводит к ослаблению способности этой неподеленной пары координироваться с бором. Это, в свою очередь, приводит к тому, что неподеленная пара антиперипланарна по отношению к 4-метоксифенилу, связывающемуся преимущественно с катализатором, что приводит к четко определенной лицевой селективности. В оптимизированных условиях образуется продукт с превосходным уровнем энантиоселективности (95% ее).[13]
Влияние на термодинамику
Влияние на равновесие
Стереоэлектронный эффект влияет на термодинамика равновесия. Например, следующее равновесие может быть достигнуто с помощью каскада перициклический реакции.
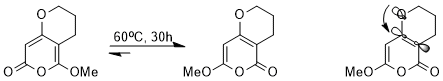
Несмотря на очень похожую структуру, один из двух изомеров имеет сильное преимущество перед другим из-за стереоэлектронного эффекта. Поскольку σ *C-C орбиталь, смежная с электроноакцепторной карбонильной группой, имеет меньшую энергию и, следовательно, является лучшим акцептором, чем σ *C-C орбиталь, смежная с метокси, изомер, в котором nО(σ) неподеленная пара, способная отдавать энергию на эту антисвязывающую орбиталь с более низкой энергией, будет стабилизирована (показано орбитальное взаимодействие).[14]
Другой пример предпочтения равновесия в области перициклической реакции показан ниже. Стереоэлектронный эффект, влияющий на равновесие, - это взаимодействие между делокализованными «банановыми связями» и пустой p-орбиталью на атоме бора.[15]

Влияние на резонансные структуры
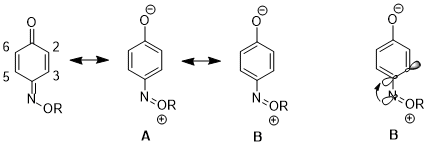
В другом случае стереоэлектронный эффект может привести к увеличению вклада одной резонансной структуры по сравнению с другой, что приводит к дальнейшим последствиям в реактивность. Для 1,4-бензохинон моноксимом, существуют значительные различия в физических свойствах и реакционной способности между двойной связью C2-C3 и двойной связью C5-C6. Например, в 1H ЯМР, 3J23 выше чем 3J56.[16] Двойная связь C2-C3 также избирательно подвергается Реакция Дильса – Альдера с циклопентадиен, несмотря на увеличенные стерические препятствия на этой стороне молекулы.[17] Эти данные демонстрируют повышенный вклад резонансной структуры. B над структурой А. Авторы утверждают, что пожертвование от nN к σ *C4-C3 орбиталь удлиняет связь C4 – C3 (C4 - это углерод, несущий азотный заместитель), что уменьшает p-p-перекрытие между этими двумя атомами. Это, в свою очередь, снижает относительную важность структуры А который имеет двойную связь между C4 и C3.[18]
Применение в асимметричных реакциях Дильса – Альдера.
В асимметричных реакциях Дильса – Альдера вместо использования хиральный лиганды или хиральные вспомогательные вещества для дифференциации боковой селективности диенолфилов, дифференциации лицевой селективности диены (особенно для циклопентадиен производные), использующие стереоэлектронные эффекты, сообщалось Вудвордом с 1955 года.[19] Были проведены систематические исследования селективности лица с использованием замещенных производных циклопентадиена или перметилциклопентадиена, и результаты могут быть перечислены ниже.[20]

Стереоэлектронный эффект, влияющий на результат лицевой селективности диена в реакции Дильса-Альдера, представляет собой взаимодействие между σ (C (sp2) –CH3) (когда σ (C (sp2) –X) является лучшим акцептором, чем донор) или σ (C (sp2) –X) (когда σ (C (sp2) –X) является лучшим донором, чем акцептор) и σ * -орбиталь образующей связи между диеном и диенофилом.[20]

Если два геминальных заместителя являются ароматическими кольцами с разными заместителями, регулирующими электронную плотность, дифференциация лицевой селективности также проста там, где диенофил приближается к диену против более богатой электронами связи C – C, где стереоэлектронный эффект в этом корпус аналогичен предыдущему.[21]
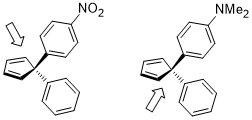
Открытие кольца циклобутен в условиях нагрева может иметь два продукта: вращение внутрь и наружу.

Переходное состояние с вращением внутрь второго, показанного ниже, относительно благоприятно для акцепторных заместителей R (например, NO2), но особенно нежелательны заместители донора R (например, NMe2).[22]
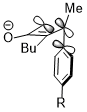
Стереоэлектронный эффект против стерического столкновения
Иногда стереоэлектронные эффекты могут победить крайнее стерическое столкновение. В аналогичной реакции раскрытия цикла циклобутена триметилсилильная группа, который очень громоздкий, по-прежнему способствует вращению внутрь. Стереоэлектронный эффект, который представляет собой взаимодействие, показанное выше, когда акцепторной орбиталью является σ * (Si – CH3), по-видимому, является более преобладающим фактором в определении избирательности реакции против стерических препятствий и даже побеждает наказание за нарушение системы конъюгации продукта из-за стерического конфликта.[23]
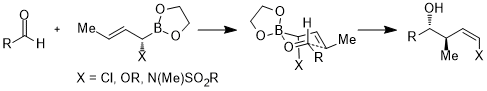
Кроме того, акцепторные орбитали не ограничиваются антисвязывающими орбиталями углерод-гетероатомных связей или пустыми орбиталями; в следующем случае акцепторной орбиталью является орбиталь σ * (B – O). В переходном состоянии с шестичленным кольцом стереоэлектронное взаимодействие имеет вид σ (C – X) → σ * (B – O).[24]
Рекомендации
- ^ а б Алабугин И.В. Стереоэлектронные эффекты: мост между структурой и реактивностью. John Wiley & Sons Ltd, Чичестер, Великобритания, 2016 г. http://eu.wiley.com/WileyCDA/WileyTitle/productCd-1118906349.html
- ^ Крамер, Кристофер Дж. (1996). «Гиперконъюгация, влияющая на конформационный анализ». Журнал молекулярной структуры: ТЕОХИМА. 370 (2–3): 135–146. Дои:10.1016 / S0166-1280 (96) 04567-8. ISSN 0166-1280.
- ^ а б Эванс, Д. А. (2006). Химия 206 Конспект лекций. Кембридж, Массачусетс: Гарвардский университет (не опубликовано). С. 1–2 (Лекция 1).
- ^ Pierre., Deslongchamps (1983). Стереоэлектронные эффекты в органической химии (1-е изд.). Оксфорд [Оксфордшир]: Pergamon Press. ISBN 0080261841. OCLC 9412829.
- ^ а б c Кирби, А. Дж. (1996). Стереоэлектронные эффекты. Оксфорд: Издательство Оксфордского университета. ISBN 9780198558934.
- ^ а б c Алабугин, Игорь В .; Зейдан, Тарек А. (2002). «Стереоэлектронные эффекты и общие тенденции в гиперконъюгативной акцепторной способности σ-связей». Журнал Американского химического общества. 124 (12): 3175–3185. Дои:10.1021 / ja012633z. ISSN 0002-7863. PMID 11902907.
- ^ Кэри, Ф. А .; Сандберг, Р. Дж. (2007). Продвинутая органическая химия, часть A: структура и механизм (5-е изд.). Нью-Йорк: Спрингер. ISBN 978-0387448978.
- ^ Ханак, М. (1965). Конформационная теория. Нью-Йорк и Лондон: Academic Press.
- ^ Anslyn, E. V .; Догерти, Д. А. (2004). Современная физико-органическая химия. Саусалито, Калифорния: Университетские научные книги. ISBN 1891389319.
- ^ Фухимори, Д. (2009). «Чувство гипоксии идет неуклюже». Nat. Chem. Биол. 5 (4): 202–203. Дои:10.1038 / nchembio0409-202. PMID 19295524.
- ^ а б Müller, K .; Faeh, C .; Дидерих, Ф. (2007). «Фтор в фармацевтике: за гранью интуиции». Наука. 317 (5846): 1881–1886. Bibcode:2007Научный ... 317.1881M. Дои:10.1126 / science.1131943. ISSN 0036-8075. PMID 17901324.
- ^ а б Петерсон, Пол У .; Шевченко, Николай; Алабугин, Игорь В. (2013). ""Stereoelectronic Umpolung ": преобразование p-донора в σ-акцептор посредством инжекции электронов и изменения конформации". Органические буквы. 15 (9): 2238–2241. Дои:10.1021 / ol400813d. ISSN 1523-7060. PMID 23639080.
- ^ а б Кори, E.J .; Хелал, Кристофер Дж. (1995). «Новые электронные эффекты удаленных заместителей на катализируемое оксазаборолидином энантиоселективное восстановление кетонов». Буквы Тетраэдра. 36 (50): 9153–9156. Дои:10.1016 / 0040-4039 (95) 01961-Г. ISSN 0040-4039.
- ^ Венкатараман, Хемалатха; Ча, Джин К. (1989). «Объем и механизм перегруппировки 4,6-диалкокси-2-пиронов». Буквы Тетраэдра. 30 (27): 3509–3512. Дои:10.1016 / S0040-4039 (00) 99426-7. ISSN 0040-4039.
- ^ Гриднев, Илья Д .; Ток, Олег Л .; Гриднева Наталья А .; Бубнов, Юрий Н .; Шрайнер, Питер Р. (1998). «Синтез и динамические свойства циклогептатриенил (дипропил) борана. Равновесие с 7-дипропилборилноркарадиеном». Журнал Американского химического общества. 120 (5): 1034–1043. Дои:10.1021 / ja9724699. ISSN 0002-7863.
- ^ Норрис, Р. К .; Стернхелл, С. (1969). «2-Замещенные и 2,6-дизамещенные 1,4-бензохинон-4-оксимы (« п-нитрозофенолы »)». Aust. J. Chem. 22 (5): 935–970. Дои:10.1071 / CH9690935.
- ^ Болдуин, Дж. Э .; Норрис, Р. К. (1981). «Стереоэлектронный контроль в органической химии: реакции присоединения некоторых 1,4-бензохинон-4- (O-метилоксимов)». J. Org. Chem. 46 (4): 697–703. Дои:10.1021 / jo00317a011.
- ^ Perrin, C.L .; Энглер, Р. Э. (1997). «Происхождение очевидных стереоэлектронных эффектов в структуре и реакционной способности монооксимов бензохинона». J. Org. Chem. 62 (3): 687–692. Дои:10.1021 / jo961386s. PMID 11671465.
- ^ Винштейн, S .; Шатавский, М .; Нортон, С .; Вудворд, Р. Б. (1955). «7-норборненильные и 7-норборнильные катионы». Варенье. Chem. Soc. 77 (15): 4183–4184. Дои:10.1021 / ja01620a078.
- ^ а б Мехта, Говердхан; Ума, Р. (2000). "Стереоэлектронный контроль в реакции Дильса-Альдера диссимметричных 1,3-диенов". Отчеты о химических исследованиях. 33 (5): 278–286. Дои:10.1021 / ar990123s. ISSN 0001-4842. PMID 10813872.
- ^ Halterman, R.L .; McCarthy, B.A .; Макэвой, М.А. (1992). "Стереоэлектронный контроль лицевой селективности в циклоприсоединении Дильса-Альдера стерически несмещенных 5,5-диарилциклопентадиенов". J. Org. Chem. 57 (21): 5585–5589. Дои:10.1021 / jo00047a009.
- ^ Шиндо, М .; Sato, Y .; Шишидо, Дж. (1998). «Высокостереоселективный синтез три- и тетразамещенных олефинов через инолаты». Tetrahedron Lett. 39 (27): 4857–4860. Дои:10.1016 / с0040-4039 (98) 00921-6.
- ^ Мураками, М .; Хасегава, М. (2004). «Синтез и термическое раскрытие кольца транс-3,4-дисилилциклобутена». Энгью. Chem. Int. Эд. 43 (37): 4874–4876. Дои:10.1002 / anie.200460144. PMID 15372640.
- ^ Schlapbach, A .; Хоффманн, Р. В. (2001). «(E) -α-Сульфонамидокротилборонаты как реагенты для стереоселективного синтеза гомоальдола». J. Org. Chem. 66 (2): 323–328. Дои:10.1002 / 1099-0690 (200101) 2001: 2 <323 :: aid-ejoc323> 3.0.co; 2-а.
