Искусственный кардиостимулятор - Artificial cardiac pacemaker
Было высказано предположение, что Кардиостимулятор спроса быть слился в эту статью. (Обсуждать) Предлагается с августа 2020 года. |
| Искусственный кардиостимулятор | |
|---|---|
 St Jude Medical кардиостимулятор с линейкой |
Сердечный кардиостимулятор (или же искусственный кардиостимулятор, чтобы не путать с естественный кардиостимулятор из сердце ), представляет собой медицинское устройство, которое генерирует электрические импульсы, доставляемые электроды вызвать камеры сердечной мышцы (верхнюю или предсердие и / или нижний, или желудочки ) сокращаться и, следовательно, перекачивать кровь; тем самым это устройство заменяет и / или регулирует функцию электрическая проводящая система сердца.
Основная цель кардиостимулятора - поддерживать адекватный частота сердцебиения либо потому, что естественный кардиостимулятор сердца работает недостаточно быстро, либо потому, что блокировать в системе электрической проводимости сердца. Современные кардиостимуляторы программируются извне и позволяют кардиологу, в частности кардиолог-электрофизиолог для выбора оптимальных режимов стимуляции для каждого пациента. Определенный тип кардиостимулятора, называемый дефибриллятор сочетает в себе функции кардиостимулятора и дефибриллятора в одном имплантируемом устройстве, которое для ясности следует называть дефибриллятором. Другие, называемые бивентрикулярные кардиостимуляторы иметь несколько электродов, стимулирующих разные положения в нижних камерах сердца, чтобы улучшить синхронизацию желудочки, нижние камеры сердца.
Методы стимуляции
Перкуссионная стимуляция
Перкуссионная кардиостимуляция, также известная как трансторакальная механическая стимуляция, представляет собой использование сжатого кулака, обычно на левом нижнем крае грудина над Правый желудочек в полая вена, нанося удары с расстояния 20-30 см, чтобы вызвать сокращение желудочков ( Британский журнал анестезии предполагает, что это необходимо сделать, чтобы поднять желудочковое давление до 10–15 мм рт. ст. и вызвать электрическую активность). Это старая процедура, которая используется только как средство спасения жизни, пока пациенту не будет установлен электрический кардиостимулятор.[1]
Чрескожная стимуляция
Чрескожная стимуляция (TCP), также называемая внешней стимуляцией, рекомендуется для начальной стабилизации гемодинамически значимых брадикардии всех типов. Процедура выполняется путем размещения двух электродов для стимуляции на груди пациента в переднем / боковом положении или в переднем / заднем положении. Спасатель выбирает частоту кардиостимуляции и постепенно увеличивает ток стимуляции (измеряется в мА) до тех пор, пока электрический захват (характеризуется широким QRS комплекс с высоким, широким Зубец Т на ЭКГ ) достигается соответствующим импульсом. Артефакт кардиостимуляции на ЭКГ и сильные подергивания мышц могут затруднить это определение. Не следует полагаться на внешнюю стимуляцию в течение длительного периода времени. Это экстренная процедура, которая действует как мост до тех пор, пока не будет применена трансвенозная кардиостимуляция или другие методы лечения.
Эпикардиальная стимуляция (временная)

Временная эпикардиальная кардиостимуляция используется во время операции на открытом сердце, если хирургическая процедура создает атриовентрикулярную блокаду. Электроды помещают в контакт с внешней стенкой желудочка (эпикарда) для поддержания удовлетворительного сердечного выброса до тех пор, пока не будет вставлен временный трансвенозный электрод.
Трансвенозная стимуляция (временная)
При использовании для временной стимуляции трансвенозная стимуляция является альтернативой чрескожной стимуляции. Провод кардиостимулятора вводится в вену в стерильных условиях, а затем вводится либо в правое предсердие, либо в правый желудочек. Затем провод для стимуляции подключается к внешнему кардиостимулятору вне тела. Трансвенозная кардиостимуляция часто используется как мост к установке постоянного кардиостимулятора. Его можно держать на месте до тех пор, пока не будет имплантирован постоянный кардиостимулятор или пока необходимость в кардиостимуляторе отпадет, а затем он будет удален.

Постоянная трансвенозная кардиостимуляция
Постоянная кардиостимуляция с имплантируемым кардиостимулятором включает трансвенозное размещение одного или нескольких электродов для стимуляции сердца в камере или камерах сердца, в то время как кардиостимулятор имплантируется под кожу под ключицей. Процедура выполняется путем разреза подходящей вены, в которую вводится электрод. вести вводится и проходит вдоль вены через клапан сердца до тех пор, пока не окажется в камере. Процедура облегчается рентгеноскопия что позволяет врачу видеть прохождение электрода. После подтверждения удовлетворительной фиксации электрода противоположный конец провода электрода подключается к генератору кардиостимулятора.
Существует три основных типа постоянных кардиостимуляторов, классифицируемых по количеству камеры задействованы и их основной рабочий механизм:[2]
- Однокамерный кардиостимулятор. В этом типе только один электрод для стимуляции помещается в камеру сердца, либо Атриум или желудочек.[2]
- Двухкамерный кардиостимулятор. Здесь провода помещены в две камеры сердца. Один электрод ходит по предсердию, а другой - по желудочку. Этот тип больше напоминает естественную кардиостимуляцию, помогая сердцу координировать функцию между предсердиями и желудочками.[2]
- Бивентрикулярный кардиостимулятор. Этот кардиостимулятор состоит из трех проводов, расположенных в трех камерах сердца. Один в предсердии и два в каждом желудочке. Имплантировать сложнее.[2]
- Частотно-чувствительный кардиостимулятор. В этом кардиостимуляторе есть датчики, которые обнаруживают изменения в физической активности пациента и автоматически регулируют частоту стимуляции для удовлетворения метаболических потребностей организма.[2]
Генератор кардиостимулятора - это герметично запечатан устройство, содержащее источник питания, обычно литиевая батарея, чувствительный усилитель, который обрабатывает электрические проявления естественных сердечных сокращений, воспринимаемые сердечными электродами, компьютер логика для кардиостимулятора и выходная схема, которая подает импульс кардиостимуляции на электроды.
Чаще всего генератор располагается ниже подкожно-жировой клетчатки грудной стенки, над мышцами и костями грудной клетки. Однако размещение может варьироваться в зависимости от конкретного случая.
Внешний корпус кардиостимуляторов спроектирован так, что организм редко отклоняет его. иммунная система. Обычно это делается из титан, инертный в организме.
Бесцельная стимуляция
Безвыводные кардиостимуляторы - это устройства, которые достаточно малы, чтобы позволить разместить генератор внутри сердца, что позволяет избежать необходимости использования электродов для стимуляции.[3] Поскольку электроды для кардиостимуляторов могут со временем выйти из строя, система кардиостимуляции, в которой отсутствуют эти компоненты, дает теоретические преимущества. Безвыводные кардиостимуляторы можно имплантировать в сердце с помощью управляемого катетера, вводимого в сердце. бедренная вена через разрез в паху.[3]
Основная функция
Современные кардиостимуляторы обычно выполняют несколько функций. Самая простая форма контролирует естественный электрический ритм сердца. Когда провод или «электрод» кардиостимулятора не обнаруживает электрическую активность сердца в камере - предсердии или желудочке - в течение обычного периода времени между ударами - чаще всего в одну секунду - он будет стимулировать предсердие или желудочек коротким импульс низкого напряжения. Если он действительно ощущает электрическую активность, он будет сдерживать стимуляцию. Эта сенсорная и стимулирующая активность продолжается от ритма к удару и называется "регулированием спроса". В случае двухкамерного устройства, когда верхние камеры имеют спонтанную или стимулированную активацию, устройство запускает обратный отсчет, чтобы гарантировать, что в приемлемом и программируемом интервале произойдет активация желудочка, в противном случае снова будет импульс. быть доставленным.
Более сложные формы включают способность ощущать и / или стимулировать камеры предсердий и желудочков.
| я | II | III | IV | V |
|---|---|---|---|---|
| Камера (и) с шагом | Камера (и) обнаружена | Ответ на зондирование | Модуляция скорости | Мультисайтовый темп |
| O = нет | O = нет | O = нет | O = нет | O = нет |
| A = Атриум | A = Атриум | T = срабатывает | R = модуляция скорости | A = Атриум |
| V = желудочек | V = желудочек | I = заблокировано | V = желудочек | |
| D = Двойной (A + V) | D = Двойной (A + V) | D = Двойной (T + I) | D = Двойной (A + V) |
Исходя из этого, основным режимом стимуляции желудочков «по требованию» является VVI или с автоматической регулировкой частоты для упражнений VVIR - этот режим подходит, когда не требуется синхронизация с сокращением предсердий, как при фибрилляции предсердий. Эквивалентным режимом стимуляции предсердий является AAI или AAIR, который является режимом выбора, когда атриовентрикулярная проводимость не нарушена, но естественный кардиостимулятор синоатриальный узел ненадежно - заболевание синусового узла (СНД) или синдром слабости синусового узла. Где проблема атриовентрикулярная блокада (AVB) кардиостимулятор необходим для обнаружения (ощущения) предсердного сокращения и после нормальной задержки (0,1–0,2 секунды) запуска желудочкового сокращения, если это еще не произошло - это режим VDD, который может быть достигнут с помощью одного отведения для стимуляции с электродами в правом предсердии (для ощущения) и желудочка (для определения и стимуляции). Эти режимы AAIR и VDD необычны для США, но широко используются в Латинской Америке и Европе.[5][6] Чаще всего используется режим DDDR, поскольку он охватывает все варианты, хотя кардиостимуляторы требуют отдельных предсердных и желудочковых отведений и являются более сложными и требуют тщательного программирования их функций для получения оптимальных результатов.
Бивентрикулярная стимуляция

Сердечная ресинхронизирующая терапия (CRT) используется для людей с сердечная недостаточность у которых левый и правый желудочки не сокращаются одновременно (желудочковая диссинхрония ), который встречается примерно у 25–50% пациентов с сердечной недостаточностью. Для достижения CRT используется бивентрикулярный кардиостимулятор (BVP), который может стимулировать как септальный и боковые стенки левый желудочек. Стимулируя обе стороны левого желудочка, кардиостимулятор может повторно синхронизировать сокращения желудочков.
ЭЛТ-устройства имеют как минимум два вывода, один из которых проходит через полая вена и правое предсердие в Правый желудочек стимулировать перегородка, и еще один, проходящий через полая вена и правое предсердие и вставляется через коронарный синус для стимуляции эпикардиальной стенки левого желудочка. Часто у пациентов с нормальным синусовым ритмом также имеется электрод в правом предсердии, чтобы облегчить синхронизацию с сокращением предсердий. Таким образом, время между сокращениями предсердий и желудочков, а также между перегородкой и боковыми стенками левого желудочка может быть отрегулировано для достижения оптимальной сердечной функции.
Было показано, что устройства CRT снижают смертность и улучшают качество жизни пациентов с симптомами сердечной недостаточности; фракция выброса ЛЖ меньше или равна 35% и продолжительность QRS на ЭКГ 120 мс или больше.[7][8]
Сама бивентрикулярная стимуляция называется CRT-P (для стимуляции). Для отдельных пациентов с риском аритмий СРТ можно сочетать с имплантируемый кардиовертер-дефибриллятор (ICD): такие устройства, известные как CRT-D (для дефибрилляции), также обеспечивают эффективную защиту от опасных для жизни аритмий.[9]
Его свёрток расхаживает
Обычное размещение желудочковых отведений внутри или вокруг кончика или вершина правого желудочка или апикальная стимуляция ПЖ могут отрицательно влиять на функцию сердца. Действительно, это было связано с повышенным риском мерцательная аритмия, сердечная недостаточность, ослабление сердечной мышцы и потенциально более короткая продолжительность жизни. Его свёрток расхаживает (HBP) приводит к более естественной или совершенно естественной активации желудочков и вызывает большой исследовательский и клинический интерес. Стимулируя His – Purkinje Оптоволоконная сеть напрямую с помощью специального вывода и техники размещения, HBP вызывает синхронизированную и, следовательно, более эффективную активацию желудочков и позволяет избежать долгосрочных заболеваний сердечной мышцы. HBP в некоторых случаях также может исправить межжелудочковая блокада узоры.[10][11]
Улучшения в функциях

Важным шагом вперед в развитии функции кардиостимулятора была попытка имитировать природу путем использования различных входных сигналов для создания кардиостимулятора, реагирующего на частоту сердечных сокращений, с использованием таких параметров, как QT интервал, pO2 - pCO2 (растворенный кислород или же углекислый газ уровней) в артериально-венозной системе, физическая активность, определяемая акселерометр, температура тела, АТФ уровни адреналин Такой кардиостимулятор, `` динамический кардиостимулятор '', вместо создания статической заданной частоты сердечных сокращений или периодического контроля мог бы компенсировать как фактическую дыхательную нагрузку, так и потенциально ожидаемую респираторную нагрузку. Первый динамический кардиостимулятор был изобретен Энтони Рикардсом из Национальная кардиологическая больница, Лондон, Великобритания, в 1982 году.[12]
Технология динамической кардиостимуляции также может быть применена в будущем искусственные сердца. Достижения в области сварки переходных тканей будут способствовать этому и другим усилиям по замене искусственных органов / суставов / тканей. Стволовые клетки могут представлять интерес при сварке переходных тканей.[нужна цитата ]
Было сделано много усовершенствований для улучшения контроля кардиостимулятора после имплантации. Многие из них стали возможны благодаря переходу к микропроцессор контролируемые кардиостимуляторы. Кардиостимуляторы, контролирующие не только желудочки, но и предсердие также стали обычным явлением. Кардиостимуляторы, которые контролируют как предсердия, так и желудочки, называются двухкамерными кардиостимуляторами. Хотя эти двухкамерные модели обычно более дороги, синхронизация сокращений предсердий, предшествующих сокращению желудочков, улучшает насосную эффективность сердца и может быть полезна при застойной сердечной недостаточности.
Частотно-чувствительная кардиостимуляция позволяет устройству определять физическую активность пациента и соответствующим образом реагировать, увеличивая или уменьшая базовую частоту стимуляции с помощью алгоритмов частотной реакции.
Судебные процессы над Давидом[13] показали, что ненужная стимуляция правого желудочка может усугубить сердечная недостаточность и увеличивает частоту фибрилляции предсердий. Новые двухкамерные устройства позволяют свести к минимуму стимуляцию правого желудочка и, таким образом, предотвратить ухудшение состояния сердца.
Соображения
Вставка
Пока человек бодрствует, может быть имплантирован кардиостимулятор. местный анестетик онемение кожи с или без седация, или спать с помощью общий наркоз.[14] Обычно назначают антибиотик, чтобы снизить риск заражения.[14] Кардиостимуляторы обычно имплантируются в переднюю часть грудной клетки в область левого или правого плеча. Кожа подготавливается путем стрижки или бритья волос на участке имплантата перед очисткой кожи дезинфицирующим средством, например хлоргексидин. Под ключицей делается разрез и под кожей создается пространство или карман для размещения генератора кардиостимулятора. Этот карман обычно создается чуть выше большая грудная мышца мышца (предпекторальная), но в некоторых случаях устройство может быть введено под мышцу (подмышечная).[15] В вести или ведет вводятся в сердце через большую вену под контролем рентгеновского изображения (рентгеноскопия ). Наконечники выводов могут быть расположены внутри Правый желудочек, то правое предсердие, или коронарный синус, в зависимости от типа кардиостимулятора.[14] Операция обычно длится от 30 до 90 минут. После имплантации хирургическая рана должна быть чистой и сухой, пока она не заживет. Следует проявлять осторожность, чтобы избежать чрезмерного движения плеча в течение первых нескольких недель, чтобы снизить риск смещения выводов кардиостимулятора.[14]
Батареи в генераторе кардиостимулятора обычно служат от 5 до 10 лет. Когда срок службы батарей подходит к концу, заменяют генератор, что обычно проще, чем установка нового имплантата. Замена включает в себя надрез для удаления существующего устройства, отсоединение проводов от старого устройства и их повторное подключение к новому генератору, повторную установку нового устройства и закрытие кожи.[14]
Периодические проверки кардиостимулятора

После имплантации кардиостимулятора его периодически проверяют, чтобы убедиться, что устройство работает и работает надлежащим образом. В зависимости от частоты, установленной следующим врачом, устройство можно проверять так часто, как это необходимо. Регулярные проверки кардиостимулятора обычно проводятся в офисе каждые шесть (6) месяцев, хотя могут варьироваться в зависимости от состояния пациента / устройства и доступности удаленного мониторинга. Более новые модели кардиостимуляторов также можно опрашивать удаленно, когда пациент передает данные своего кардиостимулятора с помощью домашнего передатчика, подключенного к их географической сотовой сети. Затем технический специалист может получить доступ к этим данным через веб-портал производителя устройства.
Во время последующего наблюдения в офисе устройство будет опрошено для проведения диагностического тестирования. Эти тесты включают:
- Ощущение: способность устройства «видеть» внутреннюю сердечную деятельность (деполяризация предсердий и желудочков).
- Импеданс: тест для измерения целостности проводов. Значительное и / или внезапное увеличение импеданса может указывать на перелом свинца, в то время как большое и / или внезапное снижение импеданса может указывать на нарушение изоляции свинца.
- Пороговая амплитуда: минимальное количество энергии (обычно в сотых долях вольт), необходимое для стимуляции предсердия или желудочка, подключенного к отведению.
- Пороговая длительность: количество времени, которое требуется устройству с заданной амплитудой для надежной стимуляции предсердия или желудочка, подключенного к отведению.
- Процент кардиостимуляции: определяет степень зависимости пациента от устройства, процент времени, в течение которого кардиостимулятор активно выполнял кардиостимуляцию с момента предыдущего опроса устройства.
- Расчетное время автономной работы при текущем уровне заряда: поскольку современные кардиостимуляторы работают по запросу, что означает, что они задают ритм только при необходимости, на долговечность устройства влияет степень его использования. К другим факторам, влияющим на долговечность устройства, относятся запрограммированный выход и алгоритмы (функции), вызывающие более высокий уровень утечки тока из батареи.
- Любые события, которые были сохранены с момента последнего наблюдения, в частности аритмии Такие как мерцательная аритмия. Обычно они хранятся на основе определенных критериев, установленных врачом и специфичных для пациента. Некоторые устройства могут отображать внутрисердечные электрограммы начала события, а также самого события. Это особенно полезно для диагностики причины или происхождения события и внесения любых необходимых изменений в программирование.
Магнитные поля, МРТ и другие проблемы с образом жизни
Образ жизни пациента обычно не изменяется в значительной степени после установки кардиостимулятора. Есть несколько неразумных занятий, например, полноконтактные виды спорта и занятия с использованием сильных магнитных полей.
Пациент с кардиостимулятором может обнаружить, что некоторые типы повседневных действий необходимо изменить. Например, плечевой ремень автомобиля. ремень безопасности может быть неудобно, если привязь упадет через место установки кардиостимулятора.
Если пациент хочет заниматься каким-либо видом спорта или физической активности, можно использовать специальную защиту от кардиостимулятора, чтобы предотвратить возможные физические травмы или повреждение проводов кардиостимулятора.
Следует избегать любой деятельности, связанной с интенсивными электромагнитными полями. Сюда входят такие действия, как дуговая сварка возможно, с некоторыми видами оборудования,[16] или обслуживание тяжелого оборудования, которое может генерировать сильные магнитные поля (например, магнитно-резонансная томография (МРТ) аппарат).
Однако в феврале 2011 года FDA одобрило новый кардиостимулятор от Medtronic называется Revo MRI SureScan[17] который первым был отмечен как условный[18] для использования МРТ.[19] Существует несколько ограничений на его использование, включая квалификацию определенных пациентов и настройки сканирования. Условное устройство МРТ необходимо перепрограммировать непосредственно перед и сразу после сканирования МРТ. Все 5 наиболее распространенных производителей кардиостимуляторов (охватывающих более 99% рынка США) теперь имеют утвержденные FDA МР-кардиостимуляторы.[20]
Исследование, проведенное в США в 2008 году, показало, что[21] что магнитное поле, создаваемое некоторыми наушниками, входящими в комплект портативных музыкальных плееров или сотовых телефонов, при размещении в нескольких дюймах от кардиостимуляторов может вызывать помехи.
Кроме того, согласно Американская Ассоциация Сердца, некоторые домашние устройства имеют отдаленную возможность вызывать помехи, иногда подавляя одиночный удар. Мобильные телефоны, доступные в Соединенных Штатах (менее 3 Вт), похоже, не повреждают генераторы импульсов и не влияют на работу кардиостимулятора.[22]
Наличие кардиостимулятора не означает, что пациенту требуется использование антибиотики для введения перед процедурами, такими как стоматологические работы.[23] Пациент должен сообщить всему медицинскому персоналу, что у него есть кардиостимулятор. Использование МРТ может быть исключено из-за наличия у пациента кардиостимулятора, изготовленного до того, как условные устройства МРТ стали обычным явлением, или из-за того, что у пациента старые электроды для кардиостимуляции, оставленные внутри сердца, больше не подключены к своему кардиостимулятору.
Отключение кардиостимулятора
Панель Общество сердечного ритма, специализированная организация, базирующаяся в Вашингтоне, округ Колумбия, обнаружила, что выполнение запросов пациентов или лиц, имеющих законные полномочия принимать решения за пациентов о деактивации имплантированных сердечных устройств, является законным и этичным. Юристы говорят, что правовая ситуация аналогична удалению зонда для кормления, хотя в настоящее время в Соединенных Штатах Америки нет юридических прецедентов, касающихся кардиостимуляторов. Считается, что в США пациент имеет право отказаться от лечения или прекратить его, включая кардиостимулятор, который поддерживает его жизнь. Врачи имеют право отказаться выключать его, но комиссия HRS посоветовала им направить пациента к врачу, который это сделает.[24] Некоторые пациенты считают, что безнадежные, изнурительные состояния, например, вызванные тяжелым инсультом или поздней стадией деменции, могут причинить столько страданий, что они предпочли бы не продлевать свою жизнь поддерживающими мерами, такими как кардиологические устройства.[25]
Конфиденциальность и безопасность
Проблемы безопасности и конфиденциальности были подняты в связи с кардиостимуляторами, обеспечивающими беспроводную связь. Неавторизованные третьи стороны могут иметь возможность читать записи пациентов, содержащиеся в кардиостимуляторе, или перепрограммировать устройства, как было продемонстрировано группой исследователей.[26] Демонстрация работала на близком расстоянии; они не пытались разработать антенну дальнего действия. Эксплуатация «Подтверждение концепции» помогает продемонстрировать необходимость повышения уровня безопасности и оповещения пациентов о медицинских имплантатах с удаленным доступом.[26] В ответ на эту угрозу исследователи из Университета Пердью и Принстонского университета разработали прототип устройства межсетевого экрана под названием MedMon, который предназначен для защиты беспроводных медицинских устройств, таких как кардиостимуляторы и инсулиновые помпы, от злоумышленников.[27]
Осложнения
Осложнения от наличия хирургия имплантировать кардиостимулятор встречаются редко (примерно каждые 1-3%), но могут включать: инфекцию в месте имплантации кардиостимулятора или в кровоток; аллергическая реакция к красителю или анестезия используется во время процедуры; отек, синяк или кровотечение в месте расположения генератора или вокруг сердца, особенно если пациент принимает разбавители крови, пожилые, тонкие или другие хронические стероиды использовать. [29]
Возможным осложнением использования двухкамерных искусственных кардиостимуляторов является «тахикардия, опосредованная кардиостимулятором» (PMT), форма возвратной тахикардии. В PMT искусственный кардиостимулятор формирует антероградную (от предсердия к желудочку) конечность цепи, а атриовентрикулярный (AV) узел образует ретроградную конечность (от желудочка к предсердию) цепи.[30] Лечение PMT обычно включает перепрограммирование кардиостимулятора.[30]
Еще одно возможное осложнение - это «тахикардия с отслеживанием кардиостимулятора», когда суправентрикулярная тахикардия Такие как мерцательная аритмия или же трепетание предсердий отслеживается кардиостимулятором и производит удары желудочкового отведения. Это становится чрезвычайно редким явлением, поскольку новые устройства часто запрограммированы на распознавание наджелудочковой тахикардии и переключение в режимы без отслеживания.
Иногда необходимо удалить отведения, которые представляют собой провода небольшого диаметра, от кардиостимулятора до места имплантации в сердечной мышце. Наиболее частой причиной удаления свинца является инфекция, однако со временем электроды могут разрушиться из-за ряда причин, таких как изгибание электродов.[31] Изменения в программировании кардиостимулятора могут в некоторой степени преодолеть деградацию свинца. Однако пациенту, которому в течение одного или двух десятилетий было заменено несколько кардиостимуляторов, в которых электроды использовались повторно, может потребоваться операция по замене электродов.
Замена свинца может быть произведена одним из двух способов. Вставьте новый набор отведений, не удаляя токопроводы (не рекомендуется, поскольку это создает дополнительные препятствия для кровотока и функции сердечного клапана) или удалите токопроводы, а затем вставьте новые. Техника удаления электрода будет варьироваться в зависимости от оценки хирурга вероятности того, что простая тракция будет достаточной для более сложных процедур. Отведения обычно можно легко отсоединить от кардиостимулятора, поэтому замена устройства обычно влечет за собой простую операцию по доступу к устройству и замене его путем простого отсоединения электродов от устройства для замены и подсоединения электродов к новому устройству. Возможные осложнения, такие как перфорация сердечной стенки, возникают при удалении электрода (-ов) из тела пациента.
Другой конец электрокардиостимулятора имплантируется в сердечную мышцу с помощью миниатюрного винта или фиксируется маленькими пластиковыми крючками, называемыми зубцами. Кроме того, чем дольше были имплантированы электроды, начиная с года или двух, тем больше вероятность того, что они будут прикреплены к телу пациента в различных местах на пути от устройства к сердечной мышце, поскольку человеческое тело имеет тенденцию включать инородные устройства. в ткань. В некоторых случаях, если провод был вставлен на короткое время, удаление может потребовать простого вытягивания, чтобы вытащить провод из тела. В других случаях удаление обычно выполняется с помощью лазера или режущего устройства, которое, как канюля с режущей кромкой, проходит над проводом и перемещается вниз по проводнику, чтобы удалить любые органические насадки с помощью крошечных режущих лазеров или аналогичного устройства.
Неправильное положение электродов кардиостимулятора в различных местах описано в литературе. В зависимости от расположения электрода кардиостимулятора и симптомов лечение варьируется.[32]
Еще одно возможное осложнение называется синдром тиддлера происходит, когда пациент манипулирует кардиостимулятором и приводит к удалению электродов с их предполагаемого местоположения и вызывает возможную стимуляцию других нервов.
Другие устройства
Иногда устройства, напоминающие кардиостимуляторы, называются имплантируемые кардиовертеры-дефибрилляторы (ИКД) имплантированы. Эти устройства часто используются при лечении пациентов с риском внезапной сердечной смерти. ИКД может лечить многие типы нарушений сердечного ритма с помощью стимуляции, кардиоверсия, или же дефибрилляция. Некоторые устройства ИКД могут различать фибрилляцию желудочков и вентрикулярная тахикардия (ЖТ) и может попытаться установить ритм сердца быстрее, чем его собственная частота в случае ЖТ, чтобы попытаться прервать тахикардию до того, как она перейдет в фибрилляцию желудочков. Это известно как быстрый темп, ускоренный темп, или же стимуляция тахикардии (АТФ). АТФ эффективен только в том случае, если основным ритмом является желудочковая тахикардия, и никогда не эффективен, если ритм представляет собой фибрилляцию желудочков.
| я | II | III | IV |
|---|---|---|---|
| Ударная камера | Камера стимуляции антитахикардии | Обнаружение тахикардии | Камера для стимуляции антибрадикардии |
| O = нет | O = нет | E = Электрограмма | O = нет |
| A = Атриум | A = Атриум | H = гемодинамический | A = Атриум |
| V = желудочек | V = желудочек | V = желудочек | |
| D = Двойной (A + V) | D = Двойной (A + V) | D = Двойной (A + V) |
| МКБ-С | ИКД только с возможностью разряда |
| МКБ-Б | ИКД с кардиостимуляцией брадикардии и шоком |
| МКБ-Т | ИКД с тахикардией (и брадикардией), стимуляцией, а также шоком |
История

Источник
В 1889 г. Джон Александр МакВильям сообщается в Британский медицинский журнал (BMJ) своих экспериментов, в которых приложение электрического импульса к сердцу человека в асистолия вызвал желудочковый сокращение и что сердечный ритм 60–70 ударов в минуту может быть вызван импульсами, подаваемыми с интервалом 60–70 ударов в минуту.[34]
В 1926 г. Марк С. Лидвилл из Королевский госпиталь принца Альфреда Сиднея при поддержке физика Эдгара Х. Бута из Сиднейский университет, разработал переносное устройство, которое «подключалось к точке освещения» и в котором «один полюс прикладывался к подушечке для кожи, смоченной сильным солевым раствором», а другой полюс »состоял из изолированной иглы, за исключением ее острия, и погружался в соответствующая сердечная камера ». «Частота кардиостимулятора варьировалась от 80 до 120 импульсов в минуту, а напряжение - от 1,5 до 120 вольт». В 1928 году аппарат был использован для возрождения мертворожденный младенец в Женская больница Crown Street, Сидней чье сердце продолжало «биться само по себе» «по истечении 10 минут» стимуляции.[35][36]
В 1932 году американский физиолог Альберт Хайман с помощью своего брата описал собственный электромеханический инструмент, приводимый в действие пружинным двигателем с ручным заводом. Сам Хайман называл свое изобретение «искусственным кардиостимулятором», и этот термин используется по сей день.[37][38]
Очевидный перерыв в публикации исследований, проведенных с начала 1930-х до Вторая Мировая Война может быть связано с общественным восприятием вмешательства в природу посредством «воскрешения мертвых». Например, Хайман не публиковал данные об использовании своего кардиостимулятора у людей из-за негативной огласки как среди его коллег-врачей, так и из-за сообщений в газетах того времени. Лидвелл, возможно, знал об этом и не продолжал эксперименты на людях ".[36]
Чрескожный
В 1950 году канадский инженер-электрик Джон Хоппс спроектировал и изготовил первый внешний кардиостимулятор на основе наблюдений кардио-торакальных хирургов Уилфред Гордон Бигелоу и Джон Каллаган в Больница общего профиля Торонто,[39] хотя сначала устройство было протестировано на собаке в Университет Торонто Институт Бантинга.[40] Существенное внешнее устройство, использующее вакуумная труба технология для предоставления чрескожная стимуляция, это было несколько грубым и болезненным для пациента при использовании и, питаясь от розетки переменного тока, несло потенциальную опасность поражение электрическим током пациента и побуждая мерцание желудочков.
Ряд новаторов, в том числе Пол Золль, сделанные в 1952 году меньшими, но все еще громоздкими устройствами для чрескожной кардиостимуляции, использующими в качестве источника питания большую аккумуляторную батарею.[41]
В 1957 году Уильям Л. Вейрих опубликовал результаты исследований, проведенных в Университет Миннесоты. Эти исследования продемонстрировали восстановление частоты сердечных сокращений, сердечного выброса и среднего аортального давления у животных с полным блокада сердца за счет использования миокард электрод.[42]
В 1958 году колумбийский врач Альберто Вехарано Лаверде и колумбийский инженер-электрик Хорхе Рейнольдс Помбо constructed an external pacemaker, similar to those of Hopps and Zoll, weighing 45 kg and powered by a 12 volt car свинцово-кислотная батарея, but connected to electrodes attached to the heart. This apparatus was successfully used to sustain a 70-year-old priest, Gerardo Florez.[43]
Развитие кремний транзистор and its first commercial availability in 1956 was the pivotal event that led to rapid development of practical cardiac pacemaking.
Носимый
In 1958, engineer Earl Bakken of Minneapolis, Minnesota, produced the first wearable external pacemaker for a patient of К. Уолтон Лиллехей. This transistorized pacemaker, housed in a small plastic box, had controls to permit adjustment of pacing heart rate and output voltage and was connected to electrode ведет which passed through the skin of the patient to terminate in electrodes attached to the surface of the миокард of the heart.
One of the earliest patients to receive this Lucas pacemaker device was a woman in her early 30s in an operation carried out in 1964 at the Radcliffe Infirmary в Оксфорд by cardiac surgeon Alf Gunning from South Africa and later Professor Gunning[44][45] who was a student of Кристиан Барнард. This pioneering operation was carried out under the guidance of cardiac consultant Peter Sleight at the Radcliffe Infirmary in Oxford and his cardiac research team at St George's Hospital in London. Sleight later became Professor of Cardiovascular Medicine at Оксфордский университет.[46][47]
Implantable
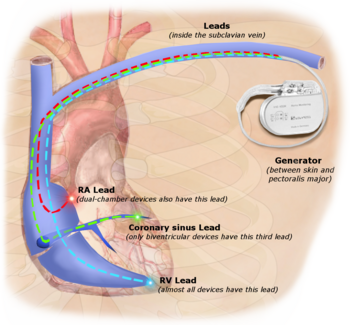
The first clinical implantation into a human of a fully implantable pacemaker was in 1958 at the Каролинский институт in Solna, Швеция, using a pacemaker designed by inventor Rune Elmqvist и хирург Åke Senning (in collaboration with Elema-Schönander AB, later Siemens-Elema AB), connected to electrodes attached to the миокард of the heart by thoracotomy. The device failed after three hours. A second device was then implanted which lasted for two days. The world's first implantable pacemaker patient, Arne Larsson, went on to receive 26 different pacemakers during his lifetime. He died in 2001, at the age of 86, outliving the inventor as well as the surgeon.[48]
In 1959, temporary трансвенозная стимуляция was first demonstrated by Seymour Furman and John Schwedel, whereby the катетер electrode was inserted via the patient's basilic vein.[49]
In February 1960, an improved version of the Swedish Elmqvist design was implanted in Монтевидео, Уругвай in the Casmu 1 Hospital by Doctors Orestes Fiandra and Roberto Rubio. That device lasted until the patient died of other ailments, nine months later. The early Swedish-designed devices used rechargeable batteries, which were charged by an induction coil from the outside. It was the first pacemaker implanted in America.
Implantable pacemakers constructed by engineer Уилсон Грейтбэтч entered use in humans from April 1960 following extensive тестирование животных. The Greatbatch innovation varied from the earlier Swedish devices in using primary cells (ртутная батарея ) as the energy source. The first patient lived for a further 18 months.
The first use of трансвенозная стимуляция in conjunction with an implanted pacemaker was by Parsonnet in the United States,[50][51][52] Lagergren in Sweden[53][54] and Jean-Jacques Welti in France[55] in 1962–63.The transvenous, or pervenous, procedure involved incision of a vein into which was inserted the катетер electrode lead under рентгеноскопический guidance, until it was lodged within the трабекулы of the right ventricle. This method was to become the method of choice by the mid-1960s.
Кардиоторакальный хирург Leon Abrams and medical engineer Рэй Лайтвуд developed and implanted the first patient-controlled variable-rate heart pacemaker in 1960 at Бирмингемский университет. The first implant took place in March 1960, with two further implants the following month. These three patients made good recoveries and returned to a high quality of life. By 1966, 56 patients had undergone implantation with one surviving for over 5 1⁄2 годы.[56][57]
Lithium battery

The preceding implantable devices all suffered from the unreliability and short lifetime of the available primary cell technology which was mainly that of the ртутная батарея. In the late 1960s, several companies, including ARCO in the USA, developed isotope-powered pacemakers, but this development was overtaken by the development in 1971 of the иодид лития cell battery к Уилсон Грейтбэтч. Литий-йодидные или литиевые анодные элементы стали стандартом для будущих конструкций кардиостимуляторов.
A further impediment to reliability of the early devices was the diffusion of water vapour from the body fluids through the epoxy resin encapsulation affecting the electronic circuitry. This phenomenon was overcome by encasing the pacemaker generator in a hermetically sealed metal case, initially by Электроника of Australia in 1969 followed by Cardiac Pacemakers Inc of Minneapolis in 1972. This technology, using титан as the encasing metal, became the standard by the mid-1970s.
On July 9, 1974, Manuel A. Villafaña and Anthony Adducci founders of Cardiac Pacemakers, Inc. (Guidant ) in St. Paul, Minnesota, manufactured the world's first pacemaker with a lithium anode and a lithium-iodide electrolyte solid-state battery.[59][60]
Intra-cardial
In 2013, multiple firms announced devices that could be inserted via a leg catheter rather than invasive surgery. The devices are roughly the size and shape of a pill, much smaller than the size of a traditional pacemaker. Once implanted, the device's prongs contact the muscle and stabilize heartbeats. Engineers and scientists are currently working on this type of device.[61] In November 2014 a patient, Bill Pike of Fairbanks, Alaska, received a Medtronic Micra pacemaker in Providence St Vincent Hospital in Portland Oregon. D. Randolph Jones was the EP doctor. In 2014 also St. Jude Medical Inc. announced the first enrollments in the company’s leadless Pacemaker Observational Study evaluating the Nanostim leadless pacing technology. The Nanostim pacemaker received CE marking in 2013. The post-approval implants have occurred in Europe.[62] The European study was recently stopped, after there were reports of six perforations that led to two patient deaths. After investigations St Jude Medical restarted the study.[63] But in the United States this therapy is still not approved by the FDA.[64] While the St Jude Nanostim and the Medtronic Micra are just single-chamber pacemakers it is anticipated that leadless dual-chamber pacing for patients with atrioventricular block will become possible with further development.[65]
Reusable pacemakers
Thousands of pacemakers are removed by funeral home personnel each year all over the world. They have to be removed postmortem from bodies that are going to be cremated to avoid explosions. It is a fairly simple procedure that can be carried out by a mortician. Pacemakers with significant battery life are potentially life-saving devices for people in low and middle income countries (LMICs).[66] В Институт медицины, а Соединенные Штаты не государственная организация, has reported that inadequate access to advanced cardiovascular technologies is one of the major contributors to cardiovascular disease morbidity and mortality in LMICs. Ever since the 1970s, multiple studies all over the world have reported on the safety and efficacy of pacemaker reuse. По состоянию на 2016 год[Обновить], widely acceptable standards for safe pacemaker and ICD reuse have not been developed, and there continue to be legal and regulatory barriers to widespread adoption of medical device reuse.[67]
Смотрите также
- Biological pacemaker
- Button cell
- Electrical conduction system of the heart
- Имплантируемый кардиовертер-дефибриллятор
- Инфекционный эндокардит
- Синдром кардиостимулятора
Рекомендации
- ^ Eich C, Bleckmann A, Paul T (October 2005). "Percussion pacing in a three-year-old girl with complete heart block during cardiac catheterization". Br J Anaesth. 95 (4): 465–7. Дои:10.1093/bja/aei209. PMID 16051649.
- ^ а б c d е "Pacemakers, Patient and Public Information Center : Heart Rhythm Society". Архивировано из оригинал 19 июня 2010 г.
- ^ а б "The leadless pacemaker: A new era in cardiac pacing". Hospital Healthcare Europe. Архивировано из оригинал на 2019-02-02. Получено 2019-02-01.
- ^ Bernstein AD, Daubert JC, Fletcher RD, Hayes DL, Lüderitz B, Reynolds DW, Schoenfeld MH, Sutton R (2002). "The revised NASPE/BPEG generic code for antibradycardia, adaptive-rate, and multisite pacing. North American Society of Pacing and Electrophysiology/British Pacing and Electrophysiology Group". Pacing Clin Electrophysiol. 25 (2): 260–4. Дои:10.1046/j.1460-9592.2002.00260.x. PMID 11916002. S2CID 12887364.
- ^ Böhm A, Pintér A, Székely A, Préda I (1998). "Clinical Observations with Long-term Atrial Pacing". Pacing Clin Electrophysiol. 21 (1): 246–9. Дои:10.1111/j.1540-8159.1998.tb01097.x. PMID 9474681. S2CID 23277568.
- ^ Crick JC (1991). "European Multicenter Prospective Follow-Up Study of 1,002 Implants of a Single Lead VDD Pacing System". Pacing Clin Electrophysiol. 14 (11): 1742–4. Дои:10.1111/j.1540-8159.1991.tb02757.x. PMID 1749727. S2CID 698053.
- ^ Cleland JG, Daubert JC, Erdmann E, Freemantle N, Gras D, Kappenberger L, Tavazzi L (2005). "The effect of cardiac resynchronization on morbidity and mortality in heart failure" (PDF). N. Engl. J. Med. 352 (15): 1539–49. Дои:10.1056/NEJMoa050496. PMID 15753115.
- ^ Bardy GH, Lee KL, Mark DB, Poole JE, Packer DL, Boineau R, Domanski M, Troutman C, Anderson J, Johnson G, McNulty SE, Clapp-Channing N, Davidson-Ray LD, Fraulo ES, Fishbein DP, Luceri RM, Ip JH (2005). "Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure". N. Engl. J. Med. 352 (3): 225–37. Дои:10.1056/NEJMoa043399. PMID 15659722. S2CID 19118406.
- ^ Ganjehei L, Razavi M, Massumi A (2011). "Cardiac resynchronization therapy: a decade of experience and the dilemma of nonresponders". Журнал Техасского института сердца. 38 (4): 358–60. ЧВК 3147217. PMID 21841860.
- ^ Sharma, Parikshit S.; Vijayaraman, Pugazhendhi; Ellenbogen, Kenneth A. (2020). "Permanent His bundle pacing: shaping the future of physiological ventricular pacing". Nature Reviews Cardiology. 17 (1): 22–36. Дои:10.1038/s41569-019-0224-z. PMID 31249403. S2CID 195698761.
- ^ "Focus on Electrophysiology: His Bundle Pacing: A More Physiologic Alternative For Pacing". Американский колледж кардиологии. 26 апреля 2019.
- ^ "Anthony Francis Rickards". Сердце. 90 (9): 981–2. 2004. Дои:10.1136/hrt.2004.045674. ЧВК 1768450.
- ^ Wilkoff BL, Cook JR, Epstein AE, Greene HL, Hallstrom AP, Hsia H, Kutalek SP, Sharma A (December 2002). "Dual-chamber pacing or ventricular backup pacing in patients with an implantable defibrillator: the Dual Chamber and VVI Implantable Defibrillator (DAVID) Trial". JAMA. 288 (24): 3115–23. Дои:10.1001/jama.288.24.3115. PMID 12495391.
- ^ а б c d е Ramsdale, David R. (2012). Cardiac pacing and device therapy. Rao, Archana. Лондон: Спрингер. ISBN 978-1-4471-2939-4. OCLC 822576869.
- ^ Pena, Rafael E.; Shepard, Richard K.; Ellenbogen, Kenneth A. (December 2006). "How to make a submuscular pocket". Journal of Cardiovascular Electrophysiology. 17 (12): 1381–1383. Дои:10.1111/j.1540-8167.2006.00665.x. ISSN 1540-8167. PMID 17081202. S2CID 38032736.
- ^ Marco D, Eisinger G, Hayes DL (November 1992). "Testing of work environments for electromagnetic interference". Pacing Clin Electrophysiol. 15 (11 Pt 2): 2016–22. Дои:10.1111/j.1540-8159.1992.tb03013.x. PMID 1279591. S2CID 24234010.
- ^ FDA, "Recently-Approved Devices: Revo MRI SureScan Pacing System".2013.
- ^ magneticresonancesafetytesting.com
- ^ Larry Husten. "FDA Approves Second Generation MRI-Friendly Pacemaker System From Medtronic". Forbes, 2013-02-13.
- ^ Ferreira, António M; Коста, Франциско; Tralhão, António; Marques, Hugo; Cardim, Nuno; Adragão, Pedro (7 May 2014). "MRI-conditional pacemakers: current perspectives". Медицинское оборудование. 7: 115–124. Дои:10.2147/MDER.S44063. ЧВК 4019608. PMID 24851058.
- ^ "MP3 Headphones Interfere With Implantable Defibrillators, Pacemakers – Beth Israel Deaconess Medical Center". www.bidmc.org. Получено 2008-11-10.
- ^ "What is a pacemaker?". HRMReview. Архивировано из оригинал 22 мая 2014 г.. Получено 22 мая 2014.
- ^ Баддур, Ларри М .; Epstein, Andrew E.; Erickson, Christopher C.; Knight, Bradley P.; Levison, Matthew E.; Lockhart, Peter B.; Masoudi, Frederick A.; Okum, Eric J.; Wilson, Walter R.; Beerman, Lee B.; Bolger, Ann F.; Estes, N.A. Mark; Gewitz, Michael; Newburger, Jane W.; Schron, Eleanor B.; Taubert, Kathryn A. (26 January 2010). "Update on Cardiovascular Implantable Electronic Device Infections and Their Management". Тираж. 121 (3): 458–477. Дои:10.1161/circulationaha.109.192665. PMID 20048212.
- ^ "Heart devices can be turned off near end of life". amednews.com. 31 мая 2010 г.
- ^ Butler, Katy (18 June 2010). "What Broke My Father's Heart". Нью-Йорк Таймс.
- ^ а б Halperin, Daniel; Thomas S. Heydt-Benjamin; Benjamin Ransford; Shane S. Clark; Benessa Defend; Will Morgan; Kevin Fu; Tadayoshi Kohno; William H. Maisel (May 2008). Pacemakers and Implantable Cardiac Defibrillators: Software Radio Attacks and Zero-Power Defenses (PDF). IEEE Symposium on Security and Privacy. Получено 2008-08-10.
- ^ "Researchers Develop Personal Firewall Solution for Pacemakers, Insulin Pumps". eSecurityPlanet.com. 2012-04-20. Получено 2012-04-20.
- ^ "UOTW #15 - Ultrasound of the Week". УЗИ недели. 26 августа 2014 г.. Получено 27 мая 2017.
- ^ "Risks - Pacemaker - Mayo Clinic". www.mayoclinic.org. Получено 2016-12-01.
- ^ а б Pacemaker-Mediated Tachycardia в eMedicine
- ^ Transvenous Lead Extraction: Heart Rhythm Society Expert Consensus on Facilities, Training, Indications, and Patient Management В архиве 2014-12-12 at the Wayback Machine Author: Bruce L. Wilkoff, MD. Coauthor(s): Charles J. Love, MD, FHRS, Charles L. Byrd, MD, Maria Grazia Bongiorni, MD, Roger G. Carrillo, MD, FHRS, George H. Crossley, III, MD, FHRS, Laurence M. Epstein, MD, Richard A. Friedman, MD, MBA, FHRS, Charles E. H. Kennergren, MD, PhD, FHRS, Przemyslaw Mitkowski, MD, Raymond H. M. Schaerf, MD, FHRS, Oussama M. Wazni, MD
- ^ Kalavakunta, Jagadeesh Kumar; Гупта, Вишал; Paulus, Basil; Lapenna, William (2014). "An Unusual Cause of Transient Ischemic Attack in a Patient with Pacemaker". Case Reports in Cardiology. 2014: 265759. Дои:10.1155/2014/265759. ЧВК 4008350. PMID 24826308.
- ^ а б Bernstein AD, Camm AJ, Fisher JD, Fletcher RD, Mead RH, Nathan AW, Parsonnet V, Rickards AF, Smyth NP, Sutton R (1993). "North American Society of Pacing and Electrophysiology policy statement. NASPE/BPEG defibrillator code". Pacing Clin Electrophysiol. 16 (9): 1776–80. Дои:10.1111/j.1540-8159.1993.tb01809.x. PMID 7692407. S2CID 72106633.
- ^ McWilliam JA (1889). "Electrical stimulation of the heart in man". Br Med J. 1 (1468): 348–50. Дои:10.1136/bmj.1.1468.348. ЧВК 2154721. PMID 20752595.
- ^ Lidwell M C, "Cardiac Disease in Relation to Anaesthesia" in Transactions of the Third Session, Australasian Medical Congress, Sydney, Australia, Sept. 2–7, 1929, p. 160.
- ^ а б Mond HG, Sloman JG, Edwards RH (1982). "The first pacemaker". Электрокардиостимуляция и клиническая электрофизиология. 5 (2): 278–82. Дои:10.1111/j.1540-8159.1982.tb02226.x. PMID 6176970. S2CID 22049678.
- ^ Aquilina, O (2006). "A brief history of cardiac pacing". Images in Paediatric Cardiology. 8 (2): 17–81. ЧВК 3232561. PMID 22368662.
- ^ Furman S, Szarka G, Layvand D (2005). "Reconstruction of Hyman's second pacemaker". Pacing Clin Electrophysiol. 28 (5): 446–53. Дои:10.1111/j.1540-8159.2005.09542.x. PMID 15869680. S2CID 29138993.
- ^ "John Alexander Hopps fonds". Archival description. Библиотека и архивы Канады. 2008-03-19. Архивировано из оригинал on 2020-07-28. Получено 16 Sep 2016.
- ^ "IEEE Milestone in Electrical Engineering and Computing". Получено 5 сентября, 2009.
- ^ "Paul Maurice Zoll". Harvard Gazette. 19 April 2001.
- ^ Weirich WL, Gott VL, Lillehei CW (1957). "The treatment of complete heart block by the combined use of a myocardial electrode and an artificial pacemaker". Surg Forum. 8: 360–3. PMID 13529629.
- ^ Reynolds, Jorge (March 1988). "The Early History of Cardiac Pacing in Colombia". Электрокардиостимуляция и клиническая электрофизиология. 11 (3): 355–361. Дои:10.1111/j.1540-8159.1988.tb05018.x. PMID 2452427. S2CID 20374411.
- ^ "Gunning, Alfred James – Biographical entry – Plarr's Lives of the Fellows Online". Livesonline.rcseng.ac.uk. Получено 2013-12-29.
- ^ "Наша история". Наффилдское отделение хирургических наук. Оксфордский университет. Получено 26 октября 2020.
- ^ "British Cardiovascular Society". Bcs.com. Архивировано из оригинал на 2013-12-12. Получено 2013-12-29.
- ^ Record, C O; Sleight, P; Gunning, A J; Kenworthy-Browne, J M; Richings, M (1 November 1971). "Treatment of chronic heart block with the Lucas induction coil pacemaker". Сердце. 33 (6): 938–942. Дои:10.1136/hrt.33.6.938. ЧВК 458452. PMID 5120241.
- ^ Altman, Lawrence (18 Jan 2002). "Arne H. W. Larsson, 86; Had First Internal Pacemaker". Нью-Йорк Таймс. Получено 3 марта 2014.
- ^ Furman S, Schwedel JB (1959). "An intracardiac pacemaker for Stokes-Adams seizures". N. Engl. J. Med. 261 (5): 943–8. Дои:10.1056/NEJM195911052611904. PMID 13825713.
- ^ Parsonnet V (1978). "Permanent transvenous pacing in 1962". Pacing Clin Electrophysiol. 1 (2): 265–8. Дои:10.1111/j.1540-8159.1978.tb03472.x. PMID 83641. S2CID 12263609.
- ^ Parsonnet V, Zucker IR, Asa MM (1962). "Preliminary Investigation of the Development of a Permanent Implantable Pacemaker Using an Intracardiac Dipolar Electrode". Clin. Res. 10: 391.
- ^ Parsonnet V, Zucker IR, Gilbert L, Asa M (1962). "An intracardiac bipolar electrode for interim treatment of complete heart block". Являюсь. Дж. Кардиол. 10 (2): 261–5. Дои:10.1016/0002-9149(62)90305-3. PMID 14484083.
- ^ Lagergren H (1978). "How it happened: my recollection of early pacing". Pacing Clin Electrophysiol. 1 (1): 140–3. Дои:10.1111/j.1540-8159.1978.tb03451.x. PMID 83610. S2CID 9118036.
- ^ Lagergren H, Johansson L (1963). "Intracardiac stimulation for complete heart block". Acta Chirurgica Scandinavica. 125: 562–566. PMID 13928055.
- ^ Jean Jacques Welti:Biography, Heart Rhythm Foundation[требуется полная цитата ]
- ^ Blue Plaque Guide
- ^ «Бирмингемский университет». bhamalumni.org. Архивировано из оригинал на 2014-10-06.
- ^ US 3822707
- ^ "Pioneers of the Medical Device Industry". Историческое общество Миннесоты.
- ^ US US3822707
- ^ "Medtronic's Minimally Invasive Pacemaker the Size of a Multivitamin". Singularity Hub. 2013-12-27. Получено 2013-12-29.
- ^ "European Post-Approval Trial for Nanostim". DAIC. 2014-03-18.[постоянная мертвая ссылка ]
- ^ "First-in-Human Data". Medscape. Получено 2014-06-19.
- ^ "Leadless Pacing from St. Jude Medical". Архивировано из оригинал 2014-10-29.
- ^ "First Published Data on Leadless Pacemaker Supports Efficacy". Medscape.
- ^ Mazumdar, Tulip (2013-11-19). "British charity calls for re-use of pacemakers abroad". Новости BBC. Получено 2018-07-31.
- ^ Crawford, TC; Eagle, KA (2017). "Reuse of cardiac implantable electronic devices to improve and extend lives: a call to action". Heart Asia. 9 (1): 34–35. Дои:10.1136/heartasia-2016-010835. ЧВК 5278341. PMID 28191825.

