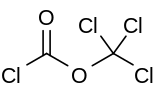
Дифосген - Diphosgene
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Трихлорметил карбонохлоридат | |
| Другие имена Трихлорметил хлорформиат | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.007.242 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| C2Cl4О2 | |
| Молярная масса | 197,82 г / моль |
| Внешность | жидкость комнатной температуры |
| Плотность | 1,65 г / см3 |
| Температура плавления | -57 ° С (-71 ° F, 216 К) |
| Точка кипения | 128 ° С (262 ° F, 401 К) |
| нерастворимый | |
| Опасности | |
| Главный опасности | токсичный |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H300, H314, H330 | |
| P260, P264, P270, P271, P280, P284, P301 + 310, P301 + 330 + 331, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P320, P321, P330, P363, P403 + 233, P405, P501 | |
| точка возгорания | 32 ° С (90 ° F, 305 К) |
| Родственные соединения | |
Родственные соединения | COCl2, Cl2 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Дифосген это химическое соединение с формулой ClCO2CCl3. Эта бесцветная жидкость является ценным реагентом в синтез органических соединений. Дифосген относится к фосген и имеет сопоставимую токсичность, но с ним удобнее обращаться, поскольку он представляет собой жидкость, а фосген - газ.
Производство и использование
Дифосген получают радикальный хлорирование метилхлорформиат под УФ-излучение:[1]
- Cl-CO-OCH3 + 3 Cl2 - (hv) → Cl-CO-OCCl3 + 3 HCl
Другой метод - радикальное хлорирование метилформиата:[2]
- H-CO-OCH3 + 4 кл2 - (hv) → Cl-CO-OCCl3 + 4 HCl
Дифосген превращается в фосген при нагревании или при катализ с уголь. Таким образом, он полезен для реакций, традиционно основанных на фосгене. Например, он конвертирует амины в изоцианаты, вторичные амины в карбамоил хлориды, карбоновые кислоты в хлорангидриды, и формамиды в изоцианиды. Дифосген служит источником двух эквивалентов фосгена:
- 2 РНХ2 + ClCO2CCl3 → 2 RNCO + 4 HCl
С α-аминокислоты дифосген дает хлорангидрид-изоцианаты, OCNCHRCOCl или Nангидриды карбоксиаминокислот в зависимости от условий.[3]
Он гидролизуется с выделением HCl во влажном воздухе.
Дифосген используется в некоторых лабораторных препаратах, потому что с ним легче обращаться, чем с фосгеном.
Роль в войне
Дифосген изначально разрабатывался как легочный агент за химическая война через несколько месяцев после первого применения фосгена. Его использовали как отравляющий газ в артиллерия снаряды Германия в течение Первая Мировая Война. Первое зарегистрированное использование поля боя было в мае 1916 года.[4] Дифосген был разработан, потому что пары могут разрушить фильтры в противогазы в использовании в то время.
Безопасность
Дифосген имеет относительно высокий давление газа 10 мм рт. ст. (1,3 кПа) при 20 ° C и разлагается до фосген около 300 ° C. Воздействие дифосгена аналогично фосгену.
Смотрите также
Рекомендации
- ^ Кейсуке Курита и Ёсио Ивакура (1979). «Трихлорметилхлорформиат в качестве эквивалента фосгена: 3-изоцианатопропаноилхлорид». Органический синтез. 59: 195.; Коллективный объем, 6, п. 715
- ^ Лос, К. Х .: Synthetische Gifte; Берлин (восток), 1974 (нем.).
- ^ Курита, К. "Трихлорметилхлорформиат" в Энциклопедия реагентов для органического синтеза (Ред: Л. Пакетт) 2004, J. Wiley & Sons, Нью-Йорк. Дои:10.1002 / 047084289X.
- ^ Джонс, Саймон; Крюк, Ричард (2007). Тактика и оборудование газовой войны Первой мировой войны. Osprey Publishing. ISBN 1-84603-151-6.
внешняя ссылка
- руководство по медицинскому обслуживанию.
- Гид НАТО, включает рекомендации по лечению
- паспорт безопасности материала (PDF, для фосгена и дифосгена, рассматриваемых как одно целое).
- MSDS специально для дифосгена
