Биливердин редуктаза - Biliverdin reductase
| биливердин редуктаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.3.1.24 | ||||||||
| Количество CAS | 9074-10-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| биливердин редуктаза А | |||||||
|---|---|---|---|---|---|---|---|
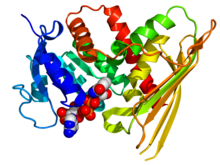 Кристаллографическая структура биливердинредуктазы А человека на основе PDB: 2H63Координаты. Фермент отображается в виде мультяшного изображения цвета радуги (N-конец = синий, C-конец = красный), а НАДФ кофактор отображается как модель, заполняющая пространство (углерод = белый, кислород = красный, азот = синий, фосфор = оранжевый). | |||||||
| Идентификаторы | |||||||
| Символ | BLVRA | ||||||
| Альт. символы | BLVR | ||||||
| Ген NCBI | 644 | ||||||
| HGNC | 1062 | ||||||
| OMIM | 109750 | ||||||
| RefSeq | NM_000712 | ||||||
| UniProt | P53004 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 1.3.1.24 | ||||||
| Locus | Chr. 7 p14-cen | ||||||
| |||||||
| биливердин редуктаза B | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | BLVRB | ||||||
| Альт. символы | FLR | ||||||
| Ген NCBI | 645 | ||||||
| HGNC | 1063 | ||||||
| OMIM | 600941 | ||||||
| RefSeq | NM_000713 | ||||||
| UniProt | P30043 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 1.3.1.24 | ||||||
| Locus | Chr. 19 q13.1-13.2 | ||||||
| |||||||
| Биливердинредуктаза, каталитическая | |||||||||
|---|---|---|---|---|---|---|---|---|---|
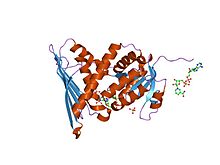 кристаллическая структура комплекса фермент-кофактор биливердинредуктазы | |||||||||
| Идентификаторы | |||||||||
| Символ | Biliv-reduc_cat | ||||||||
| Pfam | PF09166 | ||||||||
| ИнтерПро | IPR015249 | ||||||||
| SCOP2 | 1lc0 / Объем / СУПФАМ | ||||||||
| |||||||||
Биливердин редуктаза (BVR) является фермент (EC 1.3.1.24 ) обнаруживается во всех тканях в нормальных условиях, но особенно в ретикуло-макрофагах печени и селезенки. BVR облегчает преобразование биливердин к билирубин через снижение двойной связи между вторым и третьим пиррол кольцо в одинарную связь.
Есть два изоферменты, у человека каждый кодируется собственным геном, биливердин редуктаза А (BLVRA) и биливердин редуктаза B (BLVRB).
Механизм катализа
BVR действует на биливердин за счет уменьшения своей двойной связи между пиррольными кольцами до одинарной связи.[1] Это достигается с помощью НАДФН + Н.+ как донор электронов, образуя билирубин и НАДФ+ как продукты.
BVR катализирует эту реакцию через перекрывающийся сайт связывания, включая Lys18, Lys22, Lys179, Арг183, и Arg185 как ключевые остатки.[2] Этот сайт связывания прикрепляется к биливердину и вызывает его диссоциацию от гемоксигеназы (HO) (которая катализирует реакцию гема трехвалентного железа -> биливердин ), вызывая последующее восстановление до билирубина.[3]
 Восстановление биливердина до билирубина, катализируемое биливердинредуктазой. |
Структура
BVR состоит из двух плотно упакованных доменов длиной от 247 до 415 аминокислот, содержащих Россманн фолд.[4] Также было установлено, что BVR является цинк-связывающим белком, причем каждый ферментный белок имеет один сильно связывающийся атом цинка.[5][6]
В C-терминал половина BVR содержит каталитический домен, который принимает структура содержащий шесть нитей бета-лист который с одной стороны окружен несколькими альфа-спирали. Этот домен содержит каталитический активный сайт, который восстанавливает гамма-метеновый мостик открытого тетрапиррола, биливердина IX альфа, до билирубин с сопутствующим окисление НАДН или НАДФН кофактор.[7]
Функция
BVR работает с окислительно-восстановительным циклом биливердин / билирубин. Он превращает биливердин в билирубин (сильный антиоксидант), который затем превращается обратно в биливердин под действием активные формы кислорода (ROS). Этот цикл позволяет нейтрализовать АФК и повторно использовать продукты биливердина. Биливердин также пополняется в цикле за счет образования его из гемовых единиц через гемоксигеназа (HO) локализуется из эндоплазматического ретикулума.[8]
Билирубин, являющийся одним из последних продуктов гем деградация в печени, далее обрабатывается и выводится с желчью после конъюгации с глюкуроновая кислота.[9] Таким образом, BVR необходим для многих млекопитающих для избавления от катаболитов гема - особенно у плода, где плацентарные мембраны проницаемы для билирубина, но не проницаемы для биливердина, что способствует удалению накопления потенциально токсичного белка.[10]
BVR также недавно был признан регулятором метаболизм глюкозы и в контроле роста клеток и апоптоза благодаря его киназному характеру двойной специфичности.[11] Этот контроль метаболизма глюкозы указывает на то, что BVR может играть роль в патогенезе множества метаболических заболеваний, наиболее заметным из которых является сахарный диабет, путем контроля вышестоящего активатора фактора роста инсулина-1 (IGF-1) и сигнальный путь митоген-активируемой протеинкиназы (MAPK).[12]
Актуальность болезни
BVR действует как средство регенерации билирубина в повторяющемся окислительно-восстановительном цикле без значительного изменения концентрации доступного билирубина. При сохранении этих уровней кажется, что BVR представляет собой новую стратегию лечения рассеянный склероз и другие типы заболеваний, опосредованных окислительным стрессом.[13] Механизм связан с усилением мощного антиоксидантного действия билирубина, поскольку это может облегчить заболевания, опосредованные свободными радикалами.[14]
Исследования показали, что окислительно-восстановительный цикл BVR необходим для обеспечения физиологической цитопротекции. Генетические нокауты и пониженные уровни BVR продемонстрировали повышенное образование ROS и приводят к усиленной гибели клеток. Клетки, у которых наблюдалось снижение BVR на 90%, имели в три раза больше нормальных уровней ROS.[15] Через этот защитный и усиливающий цикл BVR позволяет низким концентрациям билирубина преодолевать в 10 000 раз более высокие концентрации ROS.[16]
Рекомендации
- ^ Rigney E, Mantle TJ (ноябрь 1988 г.). «Механизм реакции биливердинредуктазы бычьей почки». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 957 (2): 237–42. Дои:10.1016/0167-4838(88)90278-6. PMID 3191141.
- ^ Ван Дж., PR de Montellano (май 2003 г.). «Сайты связывания гемоксигеназы-1 человека для цитохром p450 редуктазы и биливердин редуктазы». Журнал биологической химии. 278 (22): 20069–76. Дои:10.1074 / jbc.M300989200. PMID 12626517.
- ^ Ахмад З., Салим М., Мэриленд штата Мэн (март 2002 г.). «Биливердинредуктаза человека представляет собой ДНК-связывающий белок, похожий на лейциновую молнию, и участвует в транскрипционной активации гемоксигеназы-1 под действием окислительного стресса». Журнал биологической химии. 277 (11): 9226–32. Дои:10.1074 / jbc.M108239200. PMID 11773068.
- ^ Bellamacina CR (сентябрь 1996 г.). «Никотинамид-динуклеотид-связывающий мотив: сравнение нуклеотид-связывающих белков». Журнал FASEB. 10 (11): 1257–69. Дои:10.1096 / fasebj.10.11.8836039. PMID 8836039.
- ^ Мэнс, доктор медицины, Полевода Б.В., Хуанг Т.Дж., МакКубри В.К. (январь 1996 г.). «Биливердин IX-альфа-редуктаза человека представляет собой цинк-металлопротеин. Характеристика очищенных и экспрессируемых Escherichia coli ферментов». Европейский журнал биохимии / FEBS. 235 (1–2): 372–81. Дои:10.1111 / j.1432-1033.1996.00372.x. PMID 8631357.
- ^ PDB: 1GCU; Кикучи А., Пак С.И., Миятаке Х., Сун Д., Сато М., Ёсида Т., Сиро Ю. (март 2001 г.). «Кристаллическая структура биливердинредуктазы крысы». Структурная биология природы. 8 (3): 221–5. Дои:10.1038/84955. PMID 11224565. S2CID 42293456.
- ^ Уитби Ф. Г., Филлипс Дж. Д., Хилл С. П., Мак-Кубри В., Мэн, Мэриленд (июнь 2002 г.). «Кристаллическая структура комплекса фермент-кофактор биливердин IXalpha редуктаза». Журнал молекулярной биологии. 319 (5): 1199–210. Дои:10.1016 / S0022-2836 (02) 00383-2. PMID 12079357.
- ^ Кравец А., Ху З., Миралем Т., Торно, Мэриленд, штат Мэн (май 2004 г.). «Биливердинредуктаза, новый регулятор для индукции активации фактора транскрипции-2 и гемоксигеназы-1». Журнал биологической химии. 279 (19): 19916–23. Дои:10.1074 / jbc.M314251200. PMID 14988408.
- ^ Босма П.Дж., Сеппен Дж., Голдхорн Б., Баккер С., Ауд Эльферинк Р.П., Чоудхури-младший, Чоудхури Н.Р., Янсен П.Л. (июль 1994 г.). «Билирубин UDP-глюкуронозилтрансфераза 1 является единственной релевантной глюкуронирующей изоформой билирубина у человека». Журнал биологической химии. 269 (27): 17960–4. PMID 8027054.
- ^ McDonagh AF, Palma LA, Schmid R (январь 1981 г.). «Снижение биливердина и плацентарный перенос билирубина и биливердина у беременной морской свинки». Биохимический журнал. 194 (1): 273–82. Дои:10.1042 / bj1940273. ЧВК 1162741. PMID 7305981.
- ^ Флорчик У. М., Йожкович А., Дулак Дж. (Январь – февраль 2008 г.). «Биливердинредуктаза: новые свойства старого фермента и его потенциальное терапевтическое значение». Фармакологические отчеты. 60 (1): 38–48. ЧВК 5536200. PMID 18276984.
- ^ Капитульник Дж., Мэриленд штата Мэн (март 2009 г.). «Плейотропные функции биливердинредуктазы: клеточная передача сигналов и генерация цитопротекторного и цитотоксического билирубина». Тенденции в фармакологических науках. 30 (3): 129–37. Дои:10.1016 / j.tips.2008.12.003. PMID 19217170.
- ^ Maghzal GJ, Leck MC, Collinson E, Li C, Stocker R (октябрь 2009 г.). «Ограниченная роль цикла редокс-амплификации билирубин-биливердин в антиоксидантной защите клеток с помощью биливердинредуктазы». Журнал биологической химии. 284 (43): 29251–9. Дои:10.1074 / jbc.M109.037119. ЧВК 2785555. PMID 19690164.
- ^ Лю Ю., Ли П., Лу Дж., Сюн В., Огер Дж., Тецлафф В., Сайнадер М. (август 2008 г.). «Билирубин обладает мощным иммуномодулирующим действием и подавляет экспериментальный аутоиммунный энцефаломиелит». Журнал иммунологии. 181 (3): 1887–97. Дои:10.4049 / jimmunol.181.3.1887. PMID 18641326.
- ^ Baranano DE, Rao M, Ferris CD, Снайдер SH (декабрь 2002 г.). «Биливердинредуктаза: главный физиологический цитопротектор». Труды Национальной академии наук Соединенных Штатов Америки. 99 (25): 16093–8. Bibcode:2002PNAS ... 9916093B. Дои:10.1073 / pnas.252626999. ЧВК 138570. PMID 12456881.
- ^ Седлак Т.В., Снайдер С.Х. (июнь 2004 г.). «Преимущества билирубина: защита клеток с помощью антиоксидантного цикла биливердинредуктазы». Педиатрия. 113 (6): 1776–82. Дои:10.1542 / педс.113.6.1776. PMID 15173506.
внешняя ссылка
- биливердин + редуктаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
