Гексафторид урана - Uranium hexafluoride
эта статья может быть расширен текстом, переведенным с соответствующая статья на немецком. (Ноябрь 2012 г.) Щелкните [показать] для получения важных инструкций по переводу.
|
 | |
 | |
 | |
| Имена | |
|---|---|
| Имена ИЮПАК Гексафторид урана Фторид урана (VI) | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.029.116 |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 2978 (<1% 235U) 2977 (>1% 235U) |
| |
| |
| Свойства | |
| UF6 | |
| Молярная масса | 352.02 г / моль |
| Внешность | Бесцветное твердое вещество |
| Плотность | 5.09 г / см3, твердый |
| Температура плавления | 64,052 ° С (147,294 ° F, 337,202 К) (тройная точка при 151 кПа[1]) |
| Точка кипения | 56,5 ° C (133,7 ° F, 329,6 K) (возгоняется, при атмосферном давлении) |
| Гидролизует | |
| Растворимость |
|
| Структура | |
| Орторомбический, oP28 | |
| ПНМА, № 62 | |
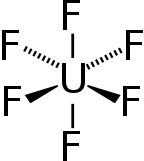
| Октаэдр (Очас) | |
| 0 | |
| Термохимия | |
Стандартный моляр энтропия (S | |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | |
| Опасности | |
| Паспорт безопасности | ICSC 1250 |
Классификация ЕС (DSD) (устарело) | |
| R-фразы (устарело) | R26 / 28, R33, R51 / 53 |
| S-фразы (устарело) | (S1 / 2), S20 / 21, S45, S61 |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Не воспламеняется |
| Родственные соединения | |
Другой анионы | Гексахлорид урана |
Другой катионы | Гексафторид нептуния Гексафторид плутония |
Родственные фториды урана | Фторид урана (III) Фторид урана (IV) Фторид урана (V) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Гексафторид урана (UF6), в просторечии известный как "шестнадцатеричный"в атомной промышленности, это соединение, используемое в процессе обогащение урана, который производит топливо для ядерные реакторы и ядерное оружие.
Hex образует твердые серые кристаллы при стандартная температура и давление, очень токсичен, реагирует с водой и вызывает коррозию большинства металлов. Соединение мягко реагирует с алюминий, образуя тонкий поверхностный слой AlF3 который сопротивляется любой дальнейшей реакции со стороны соединения.
Подготовка
Руда измельченная урановая - U3О8 или "желтый кекс "- растворяется в азотная кислота, давая решение уранилнитрат UO2(НЕТ3)2. Чистый нитрат уранила получают экстракция растворителем, затем обработали аммиак производить диуранат аммония ("ADU", (NH4)2U2О7). Снижение с водород дает UO2, который конвертируется с плавиковая кислота (HF) в тетрафторид урана, UF4. Окисление фтор дает UF6.
В течение ядерная переработка, уран реагирует с трифторид хлора дать УФ6:
- U + 2 ClF3 → УФ6 + Cl2
Свойства
Физические свойства
В атмосферное давление, Это возвышенный при 56,5 ° С.[3]

Структура твердого тела определялась нейтронография при 77 К и 293 К.[4][5]

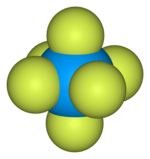
Шаровая модель элементарной ячейки гексафторида урана[6]

Длины и углы связи газообразного гексафторида урана[7]
Химические свойства
Было показано, что гексафторид урана является окислитель[8] и Кислота Льюиса который может связываться с фторид; например, реакция фторид меди (II) с гексафторидом урана в ацетонитрил как сообщается, образует гептафторуранат (VI) меди (II), Cu (UF7)2.[9]
Полимерный Фториды урана (VI), содержащие органические катионы, были выделены и охарактеризованы методом дифракции рентгеновских лучей.[10]
Применение в ядерном топливном цикле
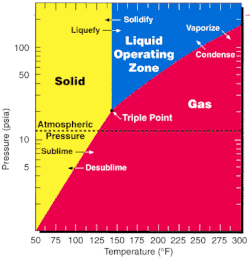
UF6 используется в обоих основных урановых обогащение методы - газовая диффузия и газовая центрифуга метод - потому что его тройная точка имеет температуру 64,05 ° C (147 ° F, 337 K) и лишь немного выше нормального атмосферного давления. У фтора есть только один стабильный изотоп природного происхождения, поэтому изотопологи УФ6 различаются по своей молекулярной массе, исходя исключительно из урана изотоп подарок.[11]
Все остальные фториды урана являются нелетучими твердыми веществами, которые координационные полимеры.
Газовая диффузия требует примерно в 60 раз больше энергии, чем процесс газовой центрифуги: ядерное топливо, полученное путем газовой диффузии, производит в 25 раз больше энергии, чем используется в процессе диффузии, в то время как топливо, произведенное на центрифуге, производит в 1500 раз больше энергии, чем используется в центрифуге обработать.
Помимо использования при обогащении, гексафторид урана использовался в усовершенствованном методе переработки (летучесть фторида ), который был разработан в Чехия. В этом процессе используются окись ядерное топливо обрабатывается газообразным фтором с образованием смеси фторидов. Затем эту смесь перегоняют для разделения материалов различных классов.
Обогащение урана дает большие количества обедненный уран гексафторид, или DUF6, как отходы производства. Долгосрочное хранение DUF6 представляет опасность для окружающей среды, здоровья и безопасности из-за своей химической нестабильности. Когда УФ6 подвергается воздействию влажного воздуха, он реагирует с водой в воздухе с образованием UO2F2 (фторид уранила ) и ВЧ (фтороводород ) оба являются очень едкими и токсичными. В 2005 году 686 500 тонн DUF6 был размещен в 57122 баллонах, расположенных вблизи Портсмут, Огайо; Ок-Ридж, Теннесси; и Падука, Кентукки.[12][13] Баллоны для хранения необходимо регулярно проверять на предмет коррозии и утечек. Расчетный срок службы стальных баллонов измеряется десятилетиями.[14]
В США произошло несколько аварий с участием гексафторида урана, в том числе авария с наполнением баллонов и выбросом материала на заводе. Sequoyah Fuels Corporation в 1986 г.[15] Правительство США конвертирует DUF6 к твердому оксиды урана для утилизации.[16] Такая утилизация всего DUF6 инвентарь может стоить от $ От 15 миллионов до 450 миллионов долларов.[17]

Разорванный 14-тонный УФ6 транспортный цилиндр. 1 погиб, несколько десятков ранены. Выпущено ~ 29500 фунтов материала. Sequoyah Fuels Corporation 1986.

DUF6 склад издалека

DUF6 цилиндры: окрашенные (слева) и корродированные (справа)
использованная литература
- ^ «Архивная копия». Архивировано из оригинал на 2013-09-16. Получено 2013-08-08.CS1 maint: заархивированная копия как заголовок (ссылка на сайт)
- ^ а б c d Джонсон, Джеральд К. (1979). «Энтальпия образования гексафторида урана». Журнал химической термодинамики. 11 (5): 483–490. Дои:10.1016/0021-9614(79)90126-5.
- ^ Brickwedde, Ferdinand G .; Hoge, Гарольд Дж .; Скотт, Рассел Б. (1948). "Низкотемпературная теплоемкость, энтальпии и энтропии UF4 и УФ6". J. Chem. Phys. 16 (5): 429–436. Дои:10.1063/1.1746914.
- ^ Дж. Х. Леви; Джон С. Тейлор; Пол Уилсон (1976). "Структура фторидов. Часть XII. Монокристаллическое нейтронографическое исследование гексафторида урана при 293 K". J. Chem. Soc., Dalton Trans. (3): 219–224. Дои:10.1039 / DT9760000219.
- ^ Дж. Х. Леви, Дж. К. Тейлор и А. Б. Во (1983). "Нейтронные порошковые структурные исследования УФ6, Минфин6 и WF6 при 77 К ". Журнал химии фтора. 23: 29–36. Дои:10.1016 / S0022-1139 (00) 81276-2.
- ^ Дж. К. Тейлор, П. В. Уилсон, Дж. В. Келли: «Структуры фторидов. I. Отклонения от идеальной симметрии в структуре кристаллического УФ6: нейтронографический анализ », Acta Crystallogr., 1973, B29, п. 7–12; Дои:10.1107 / S0567740873001895.
- ^ Кимура, Масао; Шомакер, Вернер; Смит, Дарвин В .; Бернар (1968). «Электронно-дифракционное исследование гексафторидов вольфрама, осмия, иридия, урана, нептуния и плутония». J. Chem. Phys. 48 (8): 4001–4012. Дои:10.1063/1.1669727.
- ^ Г. Х. Олах; Дж. Велч (1978). «Синтетические методы и реакции. 46. Окисление органических соединений гексафторидом урана в растворах галогеналканов». Варенье. Chem. Soc. 100 (17): 5396–5402. Дои:10.1021 / ja00485a024.
- ^ Дж. А. Берри; Р. Т. Пул; А. Прескотт; Д. В. А. Шарп; Дж. М. Уинфилд (1976). «Окислительные и акцепторные свойства фторид-иона гексафторида урана в ацетонитриле». J. Chem. Soc., Dalton Trans. (3): 272–274. Дои:10.1039 / DT9760000272.
- ^ С. М. Уокер; П. С. Халасямани; С. Аллен; Д. О'Хара (1999). «От молекул к каркасу: переменная размерность в UO2(CH3COO)2· 2H2Система O / HF (водн.) / Пиперазин. Синтез, структуры и характеристика нуль-мерного (C4N2ЧАС12) UO2F4· 3H2O, Одномерный (C4N2ЧАС12)2U2F12·ЧАС2O, двумерный (C4N2ЧАС12)2(U2О4F5)4· 11H2O и трехмерный (C4N2ЧАС12) U2О4F6". Варенье. Chem. Soc. 121 (45): 10513–10521. Дои:10.1021 / ja992145f.
- ^ «Обогащение урана и газодиффузионный процесс». USEC Inc. Архивировано из оригинал на 2007-10-19. Получено 2007-09-24.
- ^ «Сколько обедненного гексафторида урана хранится в Соединенных Штатах?». Обедненный УФ6 FAQs. Аргоннская национальная лаборатория.[постоянная мертвая ссылка ]
- ^ Документы
- ^ "Что такое DUF6? Это опасно и что с этим делать? ". Институт энергетики и экологических исследований. 2007-09-24.
- ^ «Были ли аварии с участием гексафторида урана?». Обедненный УФ6 FAQs. Аргоннская национальная лаборатория. Архивировано из оригинал на 2017-06-09.
- ^ "Что произойдет с гексафторидом урана, хранящимся в Соединенных Штатах?". Обедненный УФ6 FAQs. Аргоннская национальная лаборатория.[постоянная мертвая ссылка ]
- ^ "Существуют ли какие-либо действующие в настоящее время установки для захоронения, которые могут принять весь обедненный оксид урана, который будет образован в результате конверсии обедненного UF Министерства энергетики?6 инвентарь? ". Обедненный УФ6 FAQs. Аргоннская национальная лаборатория.[постоянная мертвая ссылка ]
дальнейшее чтение
- Gmelins Handbuch der anorganischen Chemie, Система №. 55, Уран, Тейл А, стр. 121–123.
- Gmelins Handbuch der anorganischen Chemie, Система №. 55, Уран, Тейл С 8, стр. 71–163.
- Р. ДеВитт: Гексафторид урана: обзор физико-химических свойств, Технический отчет, GAT-280; Goodyear Atomic Corp., Портсмут, Огайо; 12. августа 1960 г .; Дои:10.2172/4025868.
- Ингмар Гренте, Януш Дроджински, Такео Фуджино, Эдгар К. Бак, Томас Э. Альбрехт-Шмитт, Стивен Ф. Вольф: Уран, в: Лестер Р. Морсс, Норман М. Эдельштейн, Жан Фугер (Hrsg.): Химия актинидных и трансактинидных элементов, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, п. 253–698; Дои:10.1007/1-4020-3598-5_5 (стр. 530–531, 557–564).
- Патент США 2535572: Приготовление УФ6; 26 декабря 1950 г.
- Патент США 5723837: Очистка гексафторида урана; 3. Март 1998 г.
внешние ссылки
- Саймон Коттон (Школа Аппингема, Ратленд, Великобритания): Гексафторид урана.
- Гексафторид урана (UF6) - Физико-химические свойства УФ6, и его использование в переработке урана - гексафторид урана и его свойства
- Импорт западного обедненного гексафторида урана (урановые хвосты) в Россию [неактивная ссылка 30 июня 2017 г.]
- Гексафторид урана на www.webelements.com






