Убиквитин-активирующий фермент - Ubiquitin-activating enzyme
| Убиквитин-активирующие ферменты | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Кристаллическая структура комплекса дрожжевого убиквитин-активирующего фермента E1 / убиквитина.[1] | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 6.2.1.45 | ||||||||
| Количество CAS | 74812-49-0 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Убиквитин-активирующие ферменты, также известный как Ферменты E1, катализировать первый шаг в убиквитинирование реакция, которая (среди прочего) может нацеливаться на белок для разложения через протеасома. Этот Ковалентная связь из убиквитин или же убиквитиноподобные белки к целевым белкам является основным механизмом регуляции функции белков в эукариотические организмы.[2] Многие процессы, такие как деление клеток, иммунные ответы и эмбриональное развитие также регулируются посттрансляционная модификация убиквитином и убиквитин-подобными белками.[2]
Убиквитинирование (убиквитилирование)
Фермент, активирующий убиквитин (E1), запускает процесс убиквитинирования (рис. 1). Фермент E1 вместе с АТФ, связывается с белком убиквитин. Затем фермент E1 передает белок убиквитина второму белку, называемому носителем убиквитина или белок конъюгации (E2). Комплексы белка E2 с убиквитин протеинлигаза (E3). Эта убиквитиновая протеинлигаза распознает, какой протеин необходимо пометить, и катализирует перенос убиквитина к этому протеину. Этот путь повторяется до тех пор, пока к целевому белку не присоединится полная цепь убиквитина.[3]
Устройство и механизм
В начале каскада убиквитинирования фермент E1 (рис. 2) связывает ATP-Mg2+ и убиквитин, и катализирует С-концевое ациладенилирование убиквитина.[4] На следующем этапе каталитический цистеин (Рисунок 3) на ферменте E1 атакует комплекс убиквитин-АМФ посредством ацильного замещения, одновременно создавая тиоэфирная связь и уходящая группа AMP.[2] Наконец, комплекс E1-убиквитин передает убиквитин ферменту E2 посредством реакции транстиоэтерификации, в которой каталитический цистеин E2 атакует обратную сторону комплекса E1-убиквитин.[5] Однако процесс транстиоэтерификации очень сложен, так как ферменты E1 и E2 образуют промежуточный комплекс, в котором оба фермента подвергаются серии конформационные изменения чтобы связать друг друга.[5]
По этому механизму фермент E1 связан с двумя молекулами убиквитина. Хотя этот вторичный убиквитин подобным образом аденилирован, он не образует того же сложного тиоэфира, который описан ранее. Функция вторичного убиквитина остается в значительной степени неизвестной, однако считается, что он может способствовать конформационным изменениям, наблюдаемым в ферменте E1 во время процесса транстиоэтерификации.[2]

Рисунок 1. показывает последовательность того, как фермент, активирующий убиквитин, присоединяется к АТФ и субстрату убиквитина. Это также показывает, как два субстрата убиквитина могут быть связаны одновременно.[6]

Фигура 2. Белок E1 связывает молекулу убиквитина в каждом из двух идентичных активных сайтов (выделено). Важные остатки цистеина и аргинина отмечены красным.[2]

Рисунок 3. Увеличенный вид несвязанного активного сайта. Считается, что Arg (603) перезаряжает каталитический Cys (600), как только убиквитин переносится на фермент E2.[2]
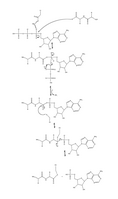
Рисунок 4. Полный механизм аденилирования убиквитина и последующего связывания убиквитина с E1.
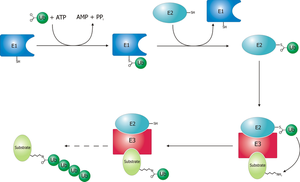
Принципиальная схема системы убиквитилирования.
Изоферменты
Следующие гены кодируют ферменты, активирующие убиквитин:
Ассоциация болезней
Система убиквитин-протеасома важна для деградация белка внутри клеток. Дисфункции этой системы могут нарушить клеточный гомеостаз и привести к множеству нарушений. В нормально функционирующих клетках ковалентная связь убиквитина или убиквитин-подобного белка с целевым белком изменяет поверхность целевого белка. Эти убиквитинированные белки подвержены деградации протеолитическими и непротеолитическими путями.[7] Если эта система не работает, это может привести к многочисленным наследственным и приобретенным заболеваниям, таким как рак, сахарный диабет, Инсульт, Болезнь Альцгеймера, боковой амиотрофический склероз, рассеянный склероз, астма, воспалительное заболевание кишечника, аутоиммунный тиреоидит, воспалительный артрит, и волчанка.[7]
Миссенс в UBE1 и Х-сцепленная детская спинальная мышечная атрофия (XL-SMA)
Среди различных нарушений, связанных с убиквитин-протеасомным путем, есть Х-сцепленный детский спинальная мышечная атрофия (XL-SMA).[8] Детское фатальное расстройство связано с потерей клетки переднего рога и младенческая смерть. Клинические признаки включают гипотонию, арефлексию и множественные врожденные контрактуры. В крупномасштабном анализе мутаций скрининг шести семейств XL-SMA дал результаты, указывающие на два новых миссенс-мутации в двух семьях и новая синонимичная замена C → T еще в трех семьях. Все эти обнаруженные мутации были локализованы в экзоне 15 UBE1 ген (ген, кодирующий фермент, активирующий убиквитин), и было обнаружено, что он разделяется с заболеванием в семьях. Короче говоря, миссенс UBE1 может привести к нарушению сложного здания с гигаксонин, белок, участвующий в структуре аксонов и поддержании нейронов. Это может привести к ухудшению деградации белок, связанный с микротрубочками 1B (MAP1B), что приводит к накоплению белка MAP1B, который может усиливать гибель нейрональных клеток.[8] Таким образом, мутации в UBE1 подозреваются, что они являются причиной генетических дефектов у людей с XL-SMA.
Рекомендации
- ^ PDB: 3 СММ; Ли I, Шинделин Х (июль 2008 г.). «Структурное понимание E1-катализируемой активации убиквитина и передачи конъюгированным ферментам». Клетка. 134 (2): 268–78. Дои:10.1016 / j.cell.2008.05.046. PMID 18662542.
- ^ а б c d е ж Шульман Б.А., Харпер Дж.В. (май 2009 г.). «Активация убиквитиноподобного белка ферментами E1: вершина нисходящих сигнальных путей». Обзоры природы Молекулярная клеточная биология. 10 (5): 319–31. Дои:10.1038 / nrm2673. ЧВК 2712597. PMID 19352404.
- ^ Лекер С.Х., Голдберг А.Л., Митч В.Е. (июль 2006 г.). «Расщепление белков убиквитин-протеасомным путем в нормальных и болезненных состояниях» (PDF). Журнал Американского общества нефрологов. 17 (7): 1807–19. Дои:10.1681 / ASN.2006010083. PMID 16738015.
- ^ Tokgöz Z, Bohnsack RN, Haas AL (май 2006 г.). «Плейотропные эффекты связывания ATP.Mg2 + в каталитическом цикле убиквитин-активирующего фермента». Журнал биологической химии. 281 (21): 14729–37. Дои:10.1074 / jbc.M513562200. PMID 16595681.
- ^ а б Ли I, Шинделин Х (июль 2008 г.). «Структурное понимание E1-катализируемой активации убиквитина и передачи конъюгированным ферментам». Клетка. 134 (2): 268–78. Дои:10.1016 / j.cell.2008.05.046. PMID 18662542.
- ^ Этот рисунок адаптирован из схемы 1 «Механизма фермента, активирующего убиквитин: кинетический и равновесный анализ» Артура Хааса. Хаас А.Л., Роуз И.А. (сентябрь 1982 г.). «Механизм действия фермента, активирующего убиквитин. Кинетический и равновесный анализ». Журнал биологической химии. 257 (17): 10329–37. PMID 6286650.
- ^ а б Ван Дж, Мальдонадо, Массачусетс (август 2006 г.). «Убиквитин-протеасомная система и ее роль в воспалительных и аутоиммунных заболеваниях» (PDF). Клеточная и молекулярная иммунология. 3 (4): 255–61. PMID 16978533.
- ^ а б Рамзер Дж., Ахерн М.Э., Ленски С. и др. (Январь 2008 г.). «Редкие бессмысленные и синонимичные варианты в UBE1 связаны с Х-связанной детской спинальной мышечной атрофией». Американский журнал генетики человека. 82 (1): 188–93. Дои:10.1016 / j.ajhg.2007.09.009. ЧВК 2253959. PMID 18179898.
внешняя ссылка
- Убиквитин-активирующие + ферменты в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)





