Кислота - Acid

An кислота это молекула или ион способный пожертвовать протон (ион водорода H+) (а Кислота Бренстеда – Лоури ), или, альтернативно, способный формировать Ковалентная связь с электронная пара (а Кислота Льюиса ).[1]
К первой категории кислот относятся доноры протонов, или Кислоты Бренстеда – Лоури. В частном случае водные растворы доноры протонов образуют ион гидроксония ЧАС3О+ и известны как Аррениусовы кислоты. Brønsted и Лоури обобщил теорию Аррениуса на неводные растворители. Кислота Бренстеда или Аррениуса обычно содержит атом водорода, связанный с химической структурой, которая остается энергетически выгодной после потери H+.
Водные кислоты Аррениуса обладают характерными свойствами, которые обеспечивают практическое описание кислоты.[2] Форма кислоты водные растворы с кислым вкусом может посинеть лакмусовая бумажка красный и реагировать с базы и некоторые металлы (например, кальций ) сформировать соли. Слово кислота происходит из латинский acidus / acēre, что означает «кислый».[3] Водный раствор кислоты имеет pH меньше 7 и в просторечии также называется «кислота» (как в «растворенном в кислоте»), в то время как строгое определение относится только к растворенное вещество.[1] Более низкий pH означает более высокий кислотность, и, следовательно, более высокая концентрация положительные ионы водорода в решение. Химические вещества или вещества, обладающие свойствами кислоты, называются кислый.
Общие водные кислоты включают соляная кислота (решение хлористый водород который находится в Желудочный сок в желудке и активирует пищеварительные ферменты ), уксусная кислота (уксус - это разбавленный водный раствор этой жидкости), серная кислота (используется в автомобильные аккумуляторы ), и лимонная кислота (содержится в цитрусовых). Как показывают эти примеры, кислоты (в просторечии) могут быть растворами или чистыми веществами и могут быть производными кислот (в строгом смысле слова).[1] смысл), которые являются твердыми телами, жидкостями или газами. Сильные кислоты и некоторые концентрированные слабые кислоты разъедающий, но есть исключения, такие как карбораны и борная кислота.
Вторая категория кислот - это Кислоты Льюиса, которые образуют ковалентную связь с электронной парой. Примером является трифторид бора (BF3), у атома бора которого есть свободный орбитальный которые могут образовывать ковалентную связь, разделяя неподеленную пару электронов на атоме в основании, например атом азота в аммиак (NH3). Льюис рассматривал это как обобщение определения Бренстеда, так что кислота - это химическая разновидность, которая принимает электронные пары либо непосредственно или высвобождая протоны (H+) в раствор, который затем принимает электронные пары. Однако хлористый водород, уксусная кислота и большинство других кислот Бренстеда – Лоури не могут образовывать ковалентную связь с электронной парой и, следовательно, не являются кислотами Льюиса.[4] И наоборот, многие кислоты Льюиса не являются кислотами Аррениуса или Бренстеда – Лоури. В современной терминологии кислота неявно является кислотой Бренстеда, а не кислотой Льюиса, так как химики почти всегда явно называют кислоту Льюиса кислота Льюиса.[4]
Определения и понятия
Современные определения касаются основных химических реакций, общих для всех кислот.
Большинство кислот, встречающихся в повседневной жизни: водные растворы, или может быть растворен в воде, поэтому определения Аррениуса и Бренстеда-Лоури являются наиболее подходящими.
Определение Бренстеда-Лоури - наиболее широко используемое определение; если не указано иное, предполагается, что кислотно-основные реакции включают перенос протона (H+) от кислоты к основанию.
Ионы гидроксония являются кислотами согласно всем трем определениям. Хотя спирты и амины могут быть кислотами Бренстеда-Лоури, они также могут действовать как Базы Льюиса из-за неподеленных пар электронов на их атомах кислорода и азота.
Аррениусовы кислоты

В 1884 г. Сванте Аррениус приписал свойства кислотности ионы водорода (ЧАС+), позже описанный как протоны или гидроны. An Аррениевая кислота это вещество, которое при добавлении в воду увеличивает концентрацию H+ ионы в воде.[4][5] Обратите внимание, что химики часто пишут H+(водный) и обратитесь к ион водорода при описании кислотно-основных реакций, но свободное ядро водорода, протон, не существует только в воде, он существует как ион гидроксония (ЧАС3О+) или другие формы (H5О2+, H9О4+). Таким образом, кислоту Аррениуса можно также описать как вещество, которое увеличивает концентрацию ионов гидроксония при добавлении в воду. Примеры включают молекулярные вещества, такие как хлористый водород и уксусная кислота.
Аррениус база, с другой стороны, это вещество, которое увеличивает концентрацию гидроксид (ОЙ−) ионы при растворении в воде. Это снижает концентрацию гидроксония, потому что ионы реагируют с образованием H2Молекулы O:
ЧАС3О+
(водн.) + ОН−
(водн.) ⇌ H2О(l) + H2О(l)
Из-за этого равновесия любое увеличение концентрации гидроксония сопровождается уменьшением концентрации гидроксида. Таким образом, можно сказать, что кислота Аррениуса снижает концентрацию гидроксида, а основание Аррениуса увеличивает ее.
В кислом растворе концентрация ионов гидроксония больше 10−7 родинки за литр. Поскольку pH определяется как отрицательный логарифм концентрации ионов гидроксония, кислотные растворы, таким образом, имеют pH менее 7.
Кислоты Бренстеда – Лоури

Хотя концепция Аррениуса полезна для описания многих реакций, она также весьма ограничена по своему объему. В 1923 году химики Йоханнес Николаус Бронстед и Томас Мартин Лоури независимо признано, что кислотно-основные реакции включают перенос протона. А Кислота Бренстеда-Лоури (или просто кислота Бренстеда) представляет собой разновидность, которая отдает протон основанию Бренстеда-Лоури.[5] Кислотно-основная теория Бренстеда-Лоури имеет несколько преимуществ перед теорией Аррениуса. Рассмотрим следующие реакции уксусная кислота (CH3COOH), органическая кислота что придает уксусу характерный вкус:
- CH
3COOH + ЧАС
2О ⇌ CH
3COO−
+ ЧАС
3О+ - CH
3COOH + NH
3 ⇌ CH
3COO−
+ NH+
4
Обе теории легко описывают первую реакцию: CH3COOH действует как кислота Аррениуса, потому что он действует как источник H3О+ будучи растворенным в воде, он действует как кислота Бренстеда, отдавая протон воде. Во втором примере CH3COOH претерпевает такое же превращение, в этом случае отдает протон аммиаку (NH3), но не относится к определению кислоты Аррениуса, потому что реакция не дает гидрокония. Тем не менее, CH3COOH одновременно является кислотой Аррениуса и кислотой Бренстеда-Лоури.
Теория Бренстеда-Лоури может использоваться для описания реакций молекулярные соединения в неводном растворе или в газовой фазе. Хлористый водород (HCl) и аммиак объединяются в нескольких различных условиях с образованием хлорид аммония, NH4Cl. В водном растворе HCl ведет себя как соляная кислота и существует в виде ионов гидроксония и хлорида. Следующие реакции иллюстрируют ограниченность определения Аррениуса:
- ЧАС3О+
(водн.) + Cl−
(водн.) + NH3 → Cl−
(водн.) + NH+
4(водн.) + H2О - HCl(бензол) + NH3 (бензол) → NH4Cl(s)
- HCl(г) + NH3 (г) → NH4Cl(s)
Как и в случае реакций с уксусной кислотой, оба определения работают для первого примера, где вода является растворителем, а ион гидроксония образуется растворенным веществом HCl. Следующие две реакции не связаны с образованием ионов, но по-прежнему являются реакциями с переносом протона. Во второй реакции хлористый водород и аммиак (растворенный в бензол ) реагируют с образованием твердого хлорида аммония в бензольном растворителе и в третьем газообразном HCl и NH3 соедините, чтобы сформировать твердое тело.
Кислоты Льюиса
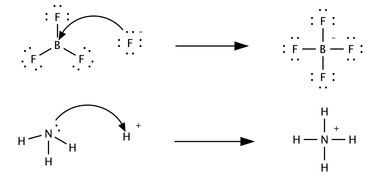
Третья, лишь частично связанная концепция была предложена в 1923 г. Гилберт Н. Льюис, который включает реакции с кислотно-основными характеристиками, которые не включают перенос протона. А Кислота Льюиса вид, который принимает пару электронов от другого вида; другими словами, это акцептор электронной пары.[5] Кислотно-основные реакции Бренстеда - это реакции переноса протона, а кислотно-основные реакции Льюиса - это перенос пары электронов. Многие кислоты Льюиса не являются кислотами Бренстеда-Лоури. Сравните, как следующие реакции описаны с точки зрения кислотно-щелочной химии:
В первой реакции a фторид-ион, F−, отказывается от электронная пара к трифторид бора сформировать продукт тетрафторборат. Фтор «теряет» пару валентные электроны потому что электроны, общие для связи B — F, расположены в области пространства между двумя атомными ядра и поэтому они более удалены от фторидного ядра, чем они находятся в одиночном фторид-ионе. BF3 является кислотой Льюиса, потому что она принимает электронную пару от фторида. Эта реакция не может быть описана в рамках теории Бренстеда, поскольку отсутствует перенос протона. Вторую реакцию можно описать с помощью любой теории. Протон переносится от неуказанной кислоты Бренстеда на аммиак, основание Бренстеда; в качестве альтернативы аммиак действует как основание Льюиса и передает неподеленную пару электронов, образуя связь с ионом водорода. Типом, который получает электронную пару, является кислота Льюиса; например, атом кислорода в H3О+ получает пару электронов, когда одна из связей H — O разрывается, и электроны, общие для связи, локализуются на кислороде. В зависимости от контекста кислота Льюиса также может быть описана как окислитель или электрофил. Органические кислоты Бренстеда, такие как уксусная, лимонная или щавелевая кислота, не являются кислотами Льюиса.[4] Они диссоциируют в воде с образованием кислоты Льюиса, H+, но в то же время также дает равное количество основания Льюиса (ацетат, цитрат или оксалат, соответственно, для упомянутых кислот). Лишь немногие из обсуждаемых ниже кислот являются кислотами Льюиса.
Диссоциация и равновесие
Реакции кислот часто обобщают в виде HA ⇌ H+ + А−, где HA представляет собой кислоту, а A− это сопряженное основание. Эта реакция обозначается как протолиз. Протонированная форма (HA) кислоты также иногда упоминается как свободная кислота.[6]
Пары сопряженных кислот и оснований различаются на один протон и могут быть взаимно преобразованы путем добавления или удаления протона (протонирование и депротонирование соответственно). Обратите внимание, что кислота может быть заряженной разновидностью, а конъюгированное основание может быть нейтральным, и в этом случае обобщенная схема реакции может быть записана как HA+ ⇌ H+ + A. В решении существует равновесие между кислотой и сопряженным с ней основанием. В константа равновесия K является выражением равновесных концентраций молекул или ионов в растворе. Скобки указывают концентрацию, такую что [H2O] означает концентрация H2О. В константа диссоциации кислоты Kа обычно используется в контексте кислотно-основных реакций. Числовое значение Kа равно произведению концентраций продуктов, деленных на концентрацию реагентов, где реагентом является кислота (HA), а продукты - сопряженное основание и H+.
Более сильная из двух кислот будет иметь более высокий Kа чем более слабая кислота; отношение ионов водорода к кислоте будет выше для более сильной кислоты, поскольку более сильная кислота имеет большую тенденцию терять свой протон. Поскольку диапазон возможных значений для Kа охватывает многие порядки величины, более управляемая константа pKа чаще используется, где pKа = −log10 Kа. Более сильные кислоты имеют меньшее pKа чем более слабые кислоты. Экспериментально определенная pKа при 25 ° C в водном растворе часто цитируются в учебниках и справочных материалах.
Номенклатура
Кислоты Аррениуса названы в соответствии с их анионы. В классической системе именования ионный суффикс опускается и заменяется новым суффиксом в соответствии со следующей таблицей. Приставка «гидро-» используется, когда кислота состоит только из водорода и еще одного элемента. Например, HCl имеет хлористый как его анион, поэтому используется префикс hydro-, а суффикс -ide заставляет имя принимать форму соляная кислота.
Классическая система именования:
| Приставка аниона | Суффикс аниона | Кислотный префикс | Кислотный суффикс | пример |
|---|---|---|---|---|
| на | ел | на | ледяная кислота | хлорная кислота (HClO4) |
| ел | ледяная кислота | хлорная кислота (HClO3) | ||
| ите | летучая кислота | хлористая кислота (HClO2) | ||
| гипо | ите | гипо | летучая кислота | хлорноватистая кислота (HClO) |
| язь | гидро | ледяная кислота | соляная кислота (HCl) |
в ИЮПАК В системе наименований «водный» просто добавляется к названию ионного соединения. Таким образом, для хлористого водорода в качестве раствора кислоты ИЮПАК называет водный хлористый водород.
Кислотная сила
Сила кислоты относится к ее способности или тенденции терять протон. Сильная кислота - это кислота, которая полностью диссоциирует в воде; другими словами, один моль сильной кислоты HA растворяется в воде с образованием одного моля H+ и один моль сопряженного основания, A−, и никакой протонированной кислоты HA. Напротив, слабая кислота только частично диссоциирует, и в состоянии равновесия и кислота, и сопряженное основание находятся в растворе. Примеры сильные кислоты находятся соляная кислота (HCl), йодистоводородная кислота (ЗДРАВСТВУЙ), бромистоводородная кислота (HBr), хлорная кислота (HClO4), азотная кислота (HNO3) и серная кислота (ЧАС2ТАК4). В воде каждый из них ионизируется на 100%. Чем сильнее кислота, тем легче она теряет протон, H+. Двумя ключевыми факторами, способствующими легкости депротонирования, являются: полярность связи H-A и размер атома A, который определяет прочность связи H-A. Сила кислоты также часто обсуждается с точки зрения стабильности конъюгированного основания.
Более сильные кислоты имеют больший константа диссоциации кислоты, Kа и более отрицательный pKа чем более слабые кислоты.
Сульфоновые кислоты, которые являются органическими оксикислотами, относятся к классу сильных кислот. Типичный пример: толуолсульфоновая кислота (тозиловая кислота). В отличие от самой серной кислоты, сульфоновые кислоты могут быть твердыми. По факту, полистирол функционализированный в сульфонат полистирола, представляет собой твердый, сильно кислый пластик, который фильтруется.
Суперкислоты кислоты сильнее 100% серной кислоты. Примеры суперкислот: фторантимоновая кислота, волшебная кислота и хлорная кислота. Суперкислоты могут постоянно протонировать воду с образованием ионных, кристаллических гидроксоний «соли». Они также могут количественно стабилизировать карбокатионы.
В то время как Kа измеряет силу кислотного соединения, сила водного раствора кислоты измеряется pH, который является показателем концентрации гидроксония в растворе. PH простого раствора кислотного соединения в воде определяется разбавлением соединения и его Kа.
Сила кислоты Льюиса в неводных растворах
Кислоты Льюиса были классифицированы в Модель ECW и было показано, что не существует одного порядка концентраций кислоты.[7] Относительную акцепторную силу кислот Льюиса по отношению к ряду оснований по сравнению с другими кислотами Льюиса можно проиллюстрировать следующим образом: Графики C-B.[8][9] Было показано, что для определения порядка силы кислоты Льюиса необходимо учитывать по крайней мере два свойства. Для качественного Теория HSAB два свойства твердость и сила, в то время как количественный Модель ECW эти два свойства - электростатическое и ковалентное.
Химические характеристики
Монопротоновые кислоты
Монопротонные кислоты, также известные как одноосновные кислоты, - это кислоты, которые способны отдавать один протон на молекулу в процессе диссоциация (иногда называется ионизацией), как показано ниже (обозначается HA):
- HA(водн.) + H2О(l) ⇌ H3О+
(водн.) + А−
(водн.) Kа
Общие примеры монопротоновых кислот в минеральные кислоты включают соляная кислота (HCl) и азотная кислота (HNO3). С другой стороны, для органические кислоты термин в основном указывает на наличие одного карбоновая кислота группа, а иногда эти кислоты известны как монокарбоновые кислоты. Примеры в органические кислоты включают Муравьиная кислота (HCOOH), уксусная кислота (CH3COOH) и бензойная кислота (C6ЧАС5COOH).
Полипротонные кислоты
Полипротонные кислоты, также известные как многоосновные кислоты, способны отдавать более одного протона на молекулу кислоты, в отличие от монопротонных кислот, которые отдают только один протон на молекулу. Конкретные типы полипротонных кислот имеют более конкретные названия, такие как дипротонная (или двухосновная) кислота (два потенциальных протона для донорства) и трипротонная (или трехосновная) кислота (три потенциальных протона для передачи).
Дипротоновая кислота (здесь обозначается H2A) может подвергаться одной или двум диссоциациям в зависимости от pH. Каждая диссоциация имеет свою константу диссоциации, Kа1 и Kа2.
- ЧАС2А(водн.) + H2О(l) ⇌ H3О+
(водн.) + HA−
(водн.) Kа1 - HA−
(водн.) + H2О(l) ⇌ H3О+
(водн.) + А2−
(водн.) Kа2
Первая константа диссоциации обычно больше второй; т.е. Kа1 > Kа2. Например, серная кислота (ЧАС2ТАК4) может отдать один протон для образования бисульфат анион (HSO−
4), для которого Kа1 очень большой; затем он может отдать второй протон, чтобы сформировать сульфат анион (SO2−
4), при этом Kа2 промежуточная прочность. Большой Kа1 для первой диссоциации серная кислота становится сильной. Аналогичным образом слабые нестабильные угольная кислота (ЧАС2CO3) может потерять один протон, чтобы сформировать бикарбонат анион (HCO−
3) и потерять секунду, чтобы сформировать карбонат анион (CO2−
3). И то и другое Kа значения невелики, но Kа1 > Kа2 .
Трипротонная кислота (H3A) может претерпевать одну, две или три диссоциации и имеет три константы диссоциации, где Kа1 > Kа2 > Kа3.
- ЧАС3А(водн.) + H2О(l) ⇌ H3О+
(водн.) + H2А−
(водн.) Kа1 - ЧАС2А−
(водн.) + H2О(l) ⇌ H3О+
(водн.) + HA2−
(водн.) Kа2 - HA2−
(водн.) + H2О(l) ⇌ H3О+
(водн.) + А3−
(водн.) Kа3
An неорганический Примером трипротонной кислоты является ортофосфорная кислота (H3PO4), обычно просто называют фосфорная кислота. Все три протона могут быть последовательно потеряны, давая H2PO−
4, то HPO2−
4, и, наконец, ПО3−
4, ортофосфат-ион, обычно называемый фосфат. Несмотря на то, что положения трех протонов на исходной молекуле фосфорной кислоты эквивалентны, последующие Kа значения различаются, поскольку потеря протона энергетически менее выгодна, если сопряженное основание заряжено более отрицательно. An органический пример трипротонной кислоты лимонная кислота, который может последовательно потерять три протона, чтобы окончательно сформировать цитрат ион.
Хотя последующая потеря каждого иона водорода менее благоприятна, все конъюгированные основания присутствуют в растворе. Дробная концентрация, α (альфа), для каждого вида можно рассчитать. Например, обычная дипротонная кислота образует в растворе 3 вида: H2А, ГА−, а А2−. Дробные концентрации могут быть рассчитаны, как показано ниже, если задан pH (который может быть преобразован в [H+]) или концентрации кислоты со всеми сопряженными с ней основаниями:
График зависимости этих фракционных концентраций от pH для данного K1 и K2, известен как Сюжет Бьеррума. В приведенных выше уравнениях наблюдается закономерность, которая может быть расширена до общего п -протонная кислота, которая была депротонирована я -раз:
где K0 = 1, а другие K-члены представляют собой константы диссоциации кислоты.
Нейтрализация

Нейтрализация представляет собой реакцию между кислотой и основанием, дающую поваренная соль и нейтрализованная база; Например, соляная кислота и гидроксид натрия форма хлорид натрия и вода:
- HCl(водн.) + NaOH(водн.) → H2О(l) + NaCl(водн.)
Нейтрализация - основа титрование, где индикатор pH показывает точку эквивалентности, когда к кислоте добавлено эквивалентное количество молей основания. Часто ошибочно полагают, что нейтрализация должна привести к получению раствора с pH 7,0, что имеет место только в случае аналогичной силы кислоты и основания во время реакции.
Нейтрализация основанием более слабым, чем кислота, приводит к получению слабокислой соли. Примером может служить слабокислый хлорид аммония, который производится из сильной кислоты хлористый водород и слабая база аммиак. И наоборот, нейтрализация слабой кислоты сильным основанием дает слабощелочную соль, например фторид натрия от фтороводород и гидроксид натрия.
Равновесие слабая кислота – слабое основание
Для того, чтобы протонированная кислота потеряла протон, pH системы должен подняться выше pKа кислоты. Снижение концентрации H+ в этом основном растворе смещает равновесие в сторону конъюгированной основной формы (депротонированной формы кислоты). В растворах с более низким pH (более кислых) достаточно высокий уровень H+ концентрация в растворе, чтобы кислота оставалась в протонированной форме.
Растворы слабых кислот и солей их сопряженных оснований образуют буферные растворы.
Титрование
Для определения концентрации кислоты в водном растворе обычно проводят кислотно-основное титрование. Раствор сильного основания с известной концентрацией, обычно NaOH или КОН, добавляется для нейтрализации раствора кислоты в соответствии с изменением цвета индикатора при добавлении количества основания.[10] Кривая титрования кислоты, титрованной основанием, имеет две оси: объем основания на оси абсцисс, а значение pH раствора - на оси ординат. PH раствора всегда повышается по мере добавления основания в раствор.
Пример: дипротоновая кислота.
Для каждой кривой титрования дипротоновой кислоты слева направо есть две средние точки, две точки эквивалентности и две буферные области.[12]
Точки эквивалентности
Из-за последовательных процессов диссоциации на кривой титрования дипротоновой кислоты есть две точки эквивалентности.[13] Первая точка эквивалентности возникает, когда титруются все первые ионы водорода после первой ионизации.[14] Другими словами, количество ОН− добавлено равняется исходному количеству H2A в первой точке эквивалентности. Вторая точка эквивалентности возникает при титровании всех ионов водорода. Следовательно, количество OH− добавлено в два раза больше H2А в это время. Для слабой дипротоновой кислоты, титрованной сильным основанием, вторая точка эквивалентности должна иметь место при pH выше 7 из-за гидролиза образующихся солей в растворе.[14] В любой точке эквивалентности добавление капли основания вызовет самый резкий рост значения pH в системе.
Буферные области и средние точки
Кривая титрования дипротоновой кислоты содержит две средние точки, где pH = pKа. Поскольку существует два разных Kа значений, первая средняя точка приходится на pH = pKа1 а второй - при pH = pKа2.[15] Каждый сегмент кривой, который содержит среднюю точку в центре, называется буферной областью. Поскольку буферные области состоят из кислоты и ее конъюгированного основания, он может противостоять изменениям pH при добавлении основания до следующих эквивалентных точек.[5]
Применение кислот
Кислоты существуют в нашей жизни повсеместно. Существуют как многочисленные виды природных кислотных соединений с биологическими функциями, так и синтезированные в большом количестве кислоты, которые используются по-разному.
В промышленности
Кислоты являются основными реагентами для обработки практически всех процессов в современной промышленности. Серная кислота, дипротонная кислота, является наиболее широко используемой кислотой в промышленности, а также самым производимым промышленным химическим веществом в мире. Он в основном используется при производстве удобрений, моющих средств, батарей и красителей, а также используется при обработке многих продуктов, таких как удаление примесей.[16] Согласно статистическим данным за 2011 год, годовое производство серной кислоты в мире составляло около 200 миллионов тонн.[17] Например, фосфатные минералы реагируют с серной кислотой с образованием фосфорная кислота для производства фосфорных удобрений и цинк производится путем растворения оксида цинка в серной кислоте, очистки раствора и получения электролита.
В химической промышленности кислоты реагируют в реакциях нейтрализации с образованием солей. Например, азотная кислота реагирует с аммиак производить нитрат аммония, удобрение. Дополнительно, карбоновые кислоты может быть этерифицированный со спиртами, чтобы произвести сложные эфиры.
Кислоты часто используются для удаления ржавчины и другой коррозии с металлов в процессе, известном как травление. Их можно использовать в качестве электролита в аккумулятор с жидкими элементами, такие как серная кислота в автомобильный аккумулятор.
В еде

Винная кислота является важным компонентом некоторых широко используемых продуктов, таких как незрелые манго и тамаринд. Натуральные фрукты и овощи также содержат кислоты. Лимонная кислота присутствует в апельсинах, лимоне и других цитрусовых. Щавелевая кислота присутствует в помидорах, шпинате и особенно в карамбола и ревень; Листья ревеня и незрелые карамболы токсичны из-за высокой концентрации щавелевой кислоты. Аскорбиновая кислота (Витамин C) является важным витамином для человеческого организма и присутствует в таких продуктах, как амла (индийский крыжовник ), лимон, цитрусовые и гуава.
Многие кислоты можно найти в различных продуктах питания в качестве добавок, поскольку они изменяют их вкус и служат консервантами. Фосфорная кислота, например, является составной частью кола напитки. Уксусная кислота используется в повседневной жизни как уксус. Лимонная кислота используется в качестве консерванта в соусах и соленьях.
Угольная кислота одна из самых распространенных кислотных добавок, которые широко добавляются в безалкогольные напитки. В процессе производства CO2 обычно под давлением растворяется в этих напитках с образованием угольной кислоты. Угольная кислота очень нестабильна и имеет тенденцию разлагаться на воду и CO.2 при комнатной температуре и давлении. Поэтому, когда бутылки или банки с такими безалкогольными напитками открываются, безалкогольные напитки шипят и шипят как CO.2 выходят пузыри.[18]
Некоторые кислоты используются в качестве лекарств. Ацетилсалициловая кислота (Аспирин) используется как обезболивающее и для снижения температуры.
В человеческих телах
Кислоты играют важную роль в организме человека. Присутствующая в желудке соляная кислота помогает пищеварению, расщепляя большие и сложные молекулы пищи. Аминокислоты необходимы для синтеза белков, необходимых для роста и восстановления тканей организма. Жирные кислоты также необходимы для роста и восстановления тканей тела. Нуклеиновые кислоты важны для производства ДНК и РНК и передачи признаков потомству через гены. Угольная кислота важна для поддержания равновесия pH в организме.
Человеческие тела содержат множество органических и неорганических соединений, среди которых дикарбоновые кислоты играют важную роль во многих видах биологического поведения. Многие из этих кислот аминокислоты которые в основном служат материалами для синтеза белков.[19] Другие слабые кислоты служат в качестве буферов со своими конъюгированными основаниями, чтобы предохранять pH организма от крупномасштабных изменений, которые могут быть вредными для клеток.[20] Остальные дикарбоновые кислоты также участвуют в синтезе различных биологически важных соединений в организме человека.
Кислотный катализ
Кислоты используются как катализаторы по промышленной и органической химии; Например, серная кислота используется в очень больших количествах в алкилирование процесс производства бензина. Некоторые кислоты, такие как серная, фосфорная и соляная кислоты, также влияют на обезвоживание и реакции конденсации. В биохимии многие ферменты использовать кислотный катализ.[21]
Биологическое происхождение
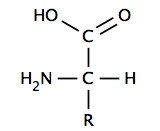
Многие биологически важные молекулы являются кислотами. Нуклеиновых кислот, которые содержат кислотные фосфатные группы, включают ДНК и РНК. Нуклеиновые кислоты содержат генетический код, который определяет многие характеристики организма и передается от родителей к потомству. ДНК содержит химический план синтеза белки которые состоят из аминокислота субъединицы. Клеточные мембраны содержать жирная кислота сложные эфиры такие как фосфолипиды.
У α-аминокислоты есть центральный углерод (α или альфа углерод ), который ковалентно связан с карбоксил группа (таким образом, они карбоновые кислоты ), амино- группа, атом водорода и переменная группа. Вариабельная группа, также называемая группой R или боковой цепью, определяет идентичность и многие свойства конкретной аминокислоты. В глицин В простейшей аминокислоте группа R представляет собой атом водорода, но во всех других аминокислотах она содержит один или несколько атомов углерода, связанных с атомами водорода, и может содержать другие элементы, такие как сера, кислород или азот. За исключением глицина, встречающиеся в природе аминокислоты хиральный и почти всегда встречаются в L-конфигурация. Пептидогликан, содержится в некоторых бактериальных клеточные стенки содержит некоторые D-аминокислоты. При физиологическом pH, обычно около 7, свободные аминокислоты существуют в заряженной форме, где кислая карбоксильная группа (-COOH) теряет протон (-COO−) и основная аминогруппа (-NH2) получает протон (-NH+
3). Вся молекула имеет чистый нейтральный заряд и является цвиттерион, за исключением аминокислот с основными или кислотными боковыми цепями. Аспарагиновая кислота, например, имеет один протонированный амин и две депротонированные карбоксильные группы для суммарного заряда -1 при физиологическом pH.
Жирные кислоты и производные жирных кислот - еще одна группа карбоновых кислот, играющих важную роль в биологии. Они содержат длинные углеводородные цепи и группу карбоновой кислоты на одном конце. Клеточная мембрана почти всех организмов в основном состоит из фосфолипидный бислой, а мицелла гидрофобных эфиров жирных кислот с полярными, гидрофильными фосфат «головные» группы. Мембраны содержат дополнительные компоненты, некоторые из которых могут участвовать в кислотно-основных реакциях.
У людей и многих других животных соляная кислота является частью Желудочный сок спрятан в желудок помочь гидролизу белки и полисахариды, а также преобразование неактивного профермента, пепсиноген в фермент, пепсин. Некоторые организмы вырабатывают кислоты для защиты; например, муравьи производят Муравьиная кислота.
Кислотно-основное равновесие играет решающую роль в регулировании млекопитающее дыхание. Кислород газ (O2) диски клеточное дыхание, процесс, при котором животные выделяют химическое вещество потенциальная энергия хранятся в продуктах питания, производя углекислый газ (CO2) как побочный продукт. Кислород и углекислый газ обмениваются в легкие, и организм реагирует на меняющиеся потребности в энергии, регулируя скорость вентиляция. Например, в периоды нагрузки организм быстро разрушает запасы углеводы и жир, выделяя CO2 в кровоток. В водных растворах, таких как CO в крови2 существует в равновесии с угольная кислота и бикарбонат ион.
- CO2 + H2O ⇌ H2CO3 ⇌ H+ + HCO−
3
Именно снижение pH дает сигнал мозгу дышать быстрее и глубже, удаляя избыток CO.2 и пополняя ячейки O2.

Клеточные мембраны обычно непроницаемы для заряженных или больших полярных молекул из-за липофильный жирные ацильные цепи, составляющие их внутреннюю часть. Многие биологически важные молекулы, включая ряд фармацевтических агентов, представляют собой слабые органические кислоты, которые могут пересекать мембрану в своей протонированной, незаряженной форме, но не в заряженной форме (то есть в виде конъюгированного основания). По этой причине активность многих лекарств может быть усилена или подавлена употреблением антацидов или кислой пищи. Заряженная форма, однако, часто более растворима в крови и цитозоль, обе водные среды. Когда внеклеточная среда более кислая, чем нейтральный pH внутри клетки, определенные кислоты будут существовать в своей нейтральной форме и будут растворимы в мембранах, позволяя им пересекать фосфолипидный бислой. Кислоты, которые теряют протон в внутриклеточный pH будут существовать в своей растворимой заряженной форме и, таким образом, смогут диффундировать через цитозоль к своей мишени. Ибупрофен, аспирин и пенициллин являются примерами лекарств, являющихся слабыми кислотами.
Общие кислоты
Минеральные кислоты (неорганические кислоты)
- Галогениды водорода и их решения: плавиковая кислота (ВЧ), соляная кислота (HCl), бромистоводородная кислота (HBr), йодистоводородная кислота (ЗДРАВСТВУЙ)
- Галогенные оксикислоты: хлорноватистая кислота (HClO), хлористая кислота (HClO2), хлорная кислота (HClO3), хлорная кислота (HClO4), и соответствующие аналоги для брома и йода
- Гипофтористая кислота (HFO), единственная известная оксокислота фтора.
- Серная кислота (ЧАС2ТАК4)
- Фтористоводородная кислота (HSO3F)
- Азотная кислота (HNO3)
- Фосфорная кислота (ЧАС3PO4)
- Фторантимоновая кислота (HSbF6)
- Фторборная кислота (HBF4)
- Гексафторфосфорная кислота (HPF6)
- Хромовая кислота (ЧАС2CrO4)
- Борная кислота (ЧАС3BO3)
Сульфоновые кислоты
А сульфоновая кислота имеет общую формулу RS (= O)2–OH, где R - органический радикал.
- Метансульфоновая кислота (или мезиловая кислота, CH3ТАК3ЧАС)
- Этансульфоновая кислота (или эсиловая кислота, CH3CH2ТАК3ЧАС)
- Бензолсульфоновая кислота (или безиловая кислота, C6ЧАС5ТАК3ЧАС)
- п-толуолсульфоновая кислота (или тозиловая кислота, CH3C6ЧАС4ТАК3ЧАС)
- Трифторметансульфоновая кислота (или трифликовая кислота, CF3ТАК3ЧАС)
- Полистиролсульфоновая кислота (сульфированный полистирол, [CH2CH (C6ЧАС4)ТАК3ЧАС]п)
Карбоновые кислоты
А карбоновая кислота имеет общую формулу R-C (O) OH, где R представляет собой органический радикал. Карбоксильная группа -C (O) OH содержит карбонил группа, C = O, и a гидроксил группа, O-H.
- Уксусная кислота (CH3COOH)
- Лимонная кислота (C6ЧАС8О7)
- Муравьиная кислота (HCOOH)
- Глюконовая кислота HOCH2- (CHOH)4-COOH
- Молочная кислота (CH3-CHOH-COOH)
- Щавелевая кислота (HOOC-COOH)
- Винная кислота (HOOC-CHOH-CHOH-COOH)
Галогенированные карбоновые кислоты
Галогенирование при альфа-позиция увеличивает силу кислоты, так что все следующие кислоты сильнее уксусной кислоты.
- Фторуксусная кислота
- Трифторуксусная кислота
- Хлоруксусная кислота
- Дихлоруксусная кислота
- Трихлоруксусная кислота
Винилогистые карбоновые кислоты
Нормальные карбоновые кислоты представляют собой прямое объединение карбонильной группы и гидроксильной группы. В винилогичный карбоновые кислоты, двойная связь углерод-углерод разделяет карбонильные и гидроксильные группы.
Нуклеиновых кислот
использованная литература
- ^ а б c Золотая книга ИЮПАК - кислота
- ^ Петруччи, Р. Х .; Harwood, R. S .; Херринг, Ф. Г. (2002). Общая химия: принципы и современные приложения (8-е изд.). Прентис Холл. п. 146. ISBN 0-13-014329-4.
- ^ Онлайн-словарь Мерриам-Вебстера: кислота
- ^ а б c d Отоксби, Д. У .; Gillis, H.P .; Батлер, Л. Дж. (2015). Принципы современной химии (8-е изд.). Брукс Коул. п. 617. ISBN 978-1305079113.
- ^ а б c d Эббинг, Даррелл; Гаммон, Стивен Д. (1 января 2016 г.). Общая химия (11-е изд.). Cengage Learning. ISBN 9781305887299.
- ^ Шталь PH, Накамо М (2008). «Фармацевтические аспекты солевой формы». В Stahl PH, Warmth CG (ред.). Справочник фармацевтических солей: свойства, выбор и использование. Вайнхайм: Wiley-VCH. С. 92–94. ISBN 978-3-906390-58-1.
- ^ Vogel G.C .; Драго, Р. С. (1996). «Модель ECW». Журнал химического образования. 73: 701–707. Bibcode:1996JChEd..73..701V. Дои:10.1021 / ed073p701.
- ^ Лоуренс, К. и Гал, Дж.Ф. Шкалы основности и сродства Льюиса, данные и измерения, (Wiley 2010), стр. 50-51, IBSN 978-0-470-74957-9
- ^ Cramer, R.E .; Бопп, Т. Т. (1977). «Графическое отображение энтальпий образования аддуктов для кислот и оснований Льюиса». Журнал химического образования. 54: 612–613. Дои:10.1021 / ed054p612. На графиках, представленных в этом документе, использовались более старые параметры. Улучшенные параметры E&C перечислены в Модель ECW.
- ^ де Леви, Роберт (1999). Водные кислотно-основные равновесия и титрование. Нью-Йорк: Издательство Оксфордского университета.
- ^ Джеймсон, Реджинальд Ф. (1978). «Определение констант ассоциации протонов для 3- (3,4-дигидроксифенил) аланина (L-допа)». Журнал химического общества, Dalton Transactions. 0 (1): 43–45. Дои:10.1039 / DT9780000043.
- ^ Гельфферих, Фридрих Г. (1 января 1962 г.). Ионный обмен. Курьерская корпорация. ISBN 9780486687841.
- ^ «Титрование дипротоновой кислоты». dwb.unl.edu. Архивировано из оригинал 7 февраля 2016 г.. Получено 24 января 2016.
- ^ а б Коц, Джон С .; Treichel, Paul M .; Таунсенд, Джон; Трейхель, Дэвид (24 января 2014 г.). Химия и химическая реакционная способность. Cengage Learning. ISBN 9781305176461.
- ^ Lehninger, Albert L .; Нельсон, Дэвид Л .; Кокс, Майкл М. (1 января 2005 г.). Принципы биохимии Ленингера. Макмиллан. ISBN 9780716743392.
- ^ «10 лучших промышленных химикатов - для чайников». dummies.com. Получено 5 февраля 2016.
- ^ "Серная кислота". Essentialchemicalindustry.org. Получено 6 февраля 2016.
- ^ Макмиллин, Джон Р .; Tracy, Gene A .; Harvill, William A .; Кредл, Уильям С. младший (8 декабря 1981 г.), Способ и устройство для приготовления и розлива газированного напитка с использованием газообразного диоксида углерода-вытеснителя для газирования, получено 6 февраля 2016
- ^ «8 - Биологическая роль аминокислот и пептидов - University Publishing Online». ebooks.cambridge.org. Июнь 2012 г. Дои:10.1017 / CBO9781139163828.
- ^ Грэм, Тимур (2006). «Кислотная буферизация». Онлайн-руководство по кислотной основе. Университет Коннектикута. Архивировано из оригинал 13 февраля 2016 г.. Получено 6 февраля 2016.
- ^ Voet, Judith G .; Воет, Дональд (2004). Биохимия. Нью-Йорк: J. Wiley & Sons. стр.496–500. ISBN 978-0-471-19350-0.
- Список сильных сторон обычных кислот и оснований
- Зумдал, Стивен С. (1997). Химия (4-е изд.). Бостон: Хоутон Миффлин. ISBN 9780669417944.
- Павия, Д. Л .; Лэмпман, Г. М .; Криз, Г. С. (2004). Органическая химия, том I. Мейсон, Огайо: Обучение Cengage. ISBN 0759347271.
внешние ссылки
- Curtipot: Диаграммы кислотно-основного равновесия, pH расчет и титрование моделирование и анализ кривых - бесплатное ПО


![{ displaystyle K_ {a} = { frac {{ ce {[H +] [A ^ {-}]}}} {{ ce {[HA]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ad1f54a70a45ea863263baa691826f3ee6cfb58)
![{ displaystyle { begin {align} alpha _ { ce {H2A}}} & = { frac {{ ce {[H +] ^ 2}}} {{ ce {[H +] ^ 2} } + [{ ce {H +}}] K_ {1} + K_ {1} K_ {2}}} = { frac {{ ce {[H2A]}}} {{ ce {{[H2A] }}} + [HA ^ {-}] + [A ^ {2 -}]}} alpha _ {{ ce {HA ^ -}}} & = { frac {[{ ce {H + }}] K_ {1}} {{ ce {[H +] ^ 2}} + [{ ce {H +}}] K_ {1} + K_ {1} K_ {2}}} = { frac { { ce {[HA ^ -]}}} {{ ce {[H2A]}} + {[HA ^ {-}]} + {[A ^ {2 -}]}}} alpha _ {{ ce {A ^ {2 -}}}} & = { frac {K_ {1} K_ {2}} {{ ce {[H +] ^ 2}} + [{ ce {H +}} ] K_ {1} + K_ {1} K_ {2}}} = { frac {{ ce {[A ^ {2 -}]}}} {{ ce {{[H2A]}}} + { [HA ^ {-}]} + {[A ^ {2 -}]}}} end {выровнено}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8e09f46996e12e5d2c821158e6bc6f70f54edbe7)
![{ Displaystyle альфа _ {{ ce {H}} _ {ni} A ^ {i -}} = {{[{ ce {H +}}] ^ {ni} displaystyle prod _ {j = 0 } ^ {i} K_ {j}} over { displaystyle sum _ {i = 0} ^ {n} { Big [} [{ ce {H +}}] ^ {ni} displaystyle prod _ {j = 0} ^ {i} K_ {j}} { Big]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5a82c39009cacb7d891f1f06a46a6558c3c91e76)
